
04.Гидроксильные производные
.pdf
CH2 OH CH OH CH2 OH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
CH2 |
|
|
|
|
O |
|
|
C |
|
CH3 CH |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
CH |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
OH |
|||
3 |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
- H2O |
|
|
|
|
|
|
|
|
- H2O |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
CH2 |
|
|
|
|
OH |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
глицеринмоноацетат
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
CH3 |
|
|
|
O |
CH2 |
|
|
|
|
O |
|
|
|
C |
|
|
|
|
CH3 |
|||
CH2 |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 C |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH |
|
|
|
|
|
OH |
|
O |
|
|
|
CH |
|
|
|
|
O |
|
|
|
C |
|
|
|
|
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
CH2 |
|
|
|
|
O |
|
|
|
C |
|
|
|
CH3 |
|
|
|
|
CH2 |
|
|
|
|
O |
|
|
|
C |
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
глицериндиацетат |
|
|
|
|
|
глицеринтриацетат |
|||||||||||||||||||||||||||||||
При нагревании глицерина с безводной щавелевой кислотой в результате распада промежуточно образующегося щавелевокислого эфира глицерина получается аллиловый спирт:
CH2 |
|
|
|
|
OH |
H |
|
|
|
|
O |
|
|
|
|
C |
|
O |
CH2 |
|
|
|
|
O |
|
|
|
|
|
C |
|
|
|
O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
OH + H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 2 CO2 |
||||||
CH |
|
|
|
|
|
O |
|
|
|
C |
|
|
O |
|
CH |
|
|
|
O |
|
C |
|
|
|
O |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
OH |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щавелевокислый эфир глицерина |
||||||||||||||||||||
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
CH |
|
|
|
|
CH2 |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
аллиловый спирт
Если же нагревать глицерин с кристаллической щавелевой кислотой, содержащей две молекулы кристаллизационной воды, то промежуточно образуется муравьиный эфир глицерина. Он омыляется кристаллизационной водой до глицерина и муравьиной кислоты, которая в процессе реакции отгоняется, а глицерин снова вступает во взаимодействие со щавелевой кислотой:
|
CH2 |
|
|
|
|
|
OH |
- CO2 |
|
CH2 |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
OH O O |
CH |
|
|
|
|
|
|
OH |
O |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
O |
|
|
|
C |
|
C |
|
O |
|
H |
|
CH2 |
|
|
|
|
O |
|
C |
|
|
|
H |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
H
 OH
OH
|
|
|
|
|
|
|
|
|
муравьиный эфир глицерина |
омыление |
CH2 |
|
|
|
|
|
OH |
+ HCOOH |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||
|
CH |
|
|
|
|
OH |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
CH2 |
|
|
|
OH |
||||
|
|
|
|||||||
106

Большое практическое значение имеют полиэфиры глицерина и фталевой (бензол-1,2-дикарбоновой) кислоты – глифталевые смолы, широко применяемые для изготовления лаков.
Взаимодействие глицерина с гидросульфатом калия. При нагревании с гидросульфатом калия или другими водоотнимающими средствами глицерин подвергается внутримолекулярной дегидратации с образованием непредельного альдегида акролеина:
|
CH2 |
|
|
|
|
OH |
KHSO4 |
|
|
CH2 |
|
|
|
|
CH2 |
||||||||
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH |
|
|
OH |
|
|
|
C |
|
|
|
CH O |
||||||||||||
|
|
- 2 H2O |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH2 |
|
|
|
|
OH |
|
|
|
CH |
|
O |
|
H |
|
|
|
C |
H |
|||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
акролеин |
|||
Акролеин обладает острым неприятным запахом. Образуется при пригорании жиров и жиросодержащих веществ.
=============================================================
4.5. АРОМАТИЧЕСКИЕ СПИРТЫ (АРИЛАЛКАНОЛЫ)
=============================================================
Гидроксильные производные ароматических углеводородов, содержащие группу ОН в боковой цепи, называются ароматическими спиртами:
CH2 OH |
CH2 CH2 OH |
фенилметанол (бензиловый спирт) |
2-фенилэтанол |
Практический интерес этот класс соединений представляет по двум причинам. Во-первых, ароматические спирты в свободном виде и в виде эфиров широко распространены в растительном мире. Во-вторых, они имеют приятный запах и применяются в парфюмерии (часто в виде сложных эфиров).
По способам получения и химическим свойствам ароматические спирты скорее похожи на предельные спирты жирного ряда, чем на фенолы.
Ароматические спирты с гидроксилом у соседнего с ядром углеродного атома получают следующими методами:
Гидролиз соответствующих галогенопроизводных. Атом галогена в соседстве с бензольным ядром имеет «аллильный характер» и весьма подвижен. Для полного гидролиза хлористого бензила достаточно кратковременного нагревания его с раствором щѐлочи. Так в промышленности получают бензиловый спирт:
|
|
CH2 |
|
Cl |
NaOH (H2O) |
|
|
CH2 |
|
OH |
|
|
|
- NaCl |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
хлористый бензил |
|
бензиловый спирт |
|
|||||||
107
По реакции Канниццаро. Под действием концентрированного раствора щѐлочи ароматические альдегиды превращаются в соответствующие спирт и соль кислоты.
2 |
C |
O KOH |
CH2 OH |
+ |
C |
O |
H |
OK |
|||||
|
|
|
|
|
|
|
|
бензальдегид |
|
бензиловый спирт |
калиевая соль бензойной кислоты |
||
Восстановление альдегидов и эфиров кислот.
C |
O |
H2 |
CH2 OH |
H |
|
||
бензальдегид |
|
бензиловый спирт |
|
|
O |
4 H |
|
C |
|
CH2 OH + C2H5OH |
|
|
OC2H5 |
|
|
этиловый эфир бензойной кислоты |
бензиловый спирт |
||
По химическим свойствам ароматические спирты похожи на алканолы. При действии щелочных металлов они дают алкоголяты и в отличие от фенолов не реагируют со щелочами. Подобно спиртам жирного ряда образуют с кислотами сложные эфиры и т.д.
=============================================================
4.6. ФЕНОЛЫ
=============================================================
Фенолы – это гидроксильные производные углеводородов, у которых гидроксильная группа находится при атоме углерода в sp2-гибридизации, входящем в цикл ароматического углеводорода.
4.6.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
По числу гидроксильных групп фенолы делят на одноатомные, двух-,
трѐх- и полиатомные.
По правилам заместительной номенклатуры ИЮПАК названия одноатомных фенолов образуют от названий соответствующих аренов с добавлением префикса гидрокси-. Чаще всего в качестве основы названий гомологов фенола используют слово фенол. Для многих фенолов используют также тривиальные названия.
108

|
OH |
|
OH |
|
|
|
|
|
|
OH |
|
OH |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
5 |
|
|
|
|
3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||
|
фенол |
|
2-метилфенол |
|
|
|
|
3-метилфенол |
4-метилфенол |
|||||||||||||||||||||
(гидроксибензол) |
|
(о-метилфенол, |
|
|
|
|
(м-метилфенол, |
(п-метилфенол, |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
о-крезол) |
|
|
|
|
м-крезол) |
|
|
п-крезол) |
|||||||||||||
|
|
|
|
OH |
|
|
|
|
|
|
OH |
OH |
||||||||||||||||||
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH2CH3 |
CH2CH2CH3 |
||||||||||||||||||
2,4,6-триметилфенол 2-метил-4-этилфенол 4-пропилфенол (1-гидрокси-2,4,6-триметилбензол) (1-гидрокси-2-метил-4-этилбензол) (1-гидрокси-4- пропилбензол)
Структурная изомерия фенолов обусловлена изомерией положения заместителей, как это имеет место в случае трѐх изомерных крезолов, или различным строением заместителей, как в случае изомерных 2,4,6- триметилфенола, 2-метил-4-этилфенола и 4-пропилфенола.
Названия многоатомных фенолов образуют по общим правилам номенклатуры ИЮПАК. Для простейших соединений используют и тривиальные названия:
|
|
OH |
|
|
|
|
|
|
OH |
|
OH |
||||||||||
|
|
1 |
|
|
|
2 |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
5 |
|
4 |
|
|
|
3 |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
пирокатехин |
|
резорцин |
гидрохинон |
||||||||||||||||||
(1,2-дигидроксибензол) |
(1,3-дигидроксибензол) |
(1,4-дигидроксибензол) |
|||||||||||||||||||
|
|
|
OH |
|
|
|
OH |
|
OH |
||||||||||||
HO |
|
|
|
|
|
|
OH |
HO |
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
пирогаллол |
флороглюцин |
оксигидрохинон |
|||||||||||||||||||
(1,2,3-тригидроксибензол) |
(1,3,5-тригидроксибензол) |
(1,2,4-тригидроксибензол) |
|||||||||||||||||||
4.6.2. ПОЛУЧЕНИЕ ФЕНОЛОВ
Природные источники. Фенол и крезолы выделяют из каменноугольной смолы. Они также образуются при крекинге нефти.
109

Однако фенол чаще всего получают синтетическими методами. Промышленный синтез фенола осуществляют из бензола.
Из бензола через сульфопроизводные. Образующуюся при сульфировании бензола бензолсульфокислоту превращают в соль и подвергают щелочному плавлению. При этом получается фенолят щелочного металла. Последний в кислой среде превращается в фенол:
|
|
|
|
|
|
SO3H |
|
|
SO3Na |
|
|
ONa |
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
H2SO4 |
|
|
|
|
NaOH |
|
|
|
|
|
2NaOH (сплавл.) |
|
|
|
|
H2SO4 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
- Na2SO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- NaHSO4 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
бензол |
бензолсульфокислота |
|
|
|
|
|
- H2O |
фенолят натрия |
фенол |
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
Из бензола через хлорбензол. Бензол хлорируют в присутствии кислоты Льюиса, а затем гидролизуют образовавшийся хлорбензол в жѐстких условиях:
|
|
|
|
|
|
Cl |
|
|
|
|
ONa |
|
|
OH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 NaOH (водн.) |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Cl2, FeCl3 |
|
|
|
|
|
|
300 оC; 200 атм. |
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
- NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- NaHSO4 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
бензол |
|
|
хлорбензол |
|
- H2O |
|
|
фенол |
||||||||||||||||||
|
|
|
|
фенолят натрия |
||||||||||||||||||||||
Из бензола через кумол (кумольный способ). В основе этого метода лежит окисление кумола (изопропилбензола), образующегося при взаимодействии бензола с пропеном (пропиленом). Наряду с фенолом при этом получается ещѐ один ценный продукт – ацетон. Это делает кумольный способ получения фенола экономически выгодным и наиболее широко использующимся в промышленности:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AlCl3 |
CH3 |
|
|
|
CH |
|
|
CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
+ |
|
|
CH3 |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[ O ] |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кумол |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(изопропилбензол) |
||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
O |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
CH3 |
|
|
|
C |
|
|
|
CH3 |
|
|
|
OH |
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
[ O ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
+ CH3 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
CH3 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
гидропероксид кумола |
|
фенол |
|
|
|
|
|
|
ацетон |
|||||||||||||||||||||||||||||||
Окислительное |
декарбоксилирование |
ароматических карбоновых |
|||||||||||||||||||||||||||||||||||||||||
кислот. При нагревании до температуры 200-300 оС в присутствии солей меди (ІІ) аренкарбоновые кислоты превращаются в соответствующие фенолы:
110
COOH |
OH |
O |
|
2+ |
+ CO2 |
Cu , t |
|
бензойная кислота |
фенол |
Из первичных ароматических аминов через соли арилдиазония. При нагревании водных растворов солей арилдиазония выделяется азот и образуются фенолы:
|
NH2 |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
N |
|
|
N |
|
|
|
OH |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
NaNO2+2HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl - |
H2O |
N2 |
|
+ HCl |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
- NaCl, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
- 2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенол |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
анилин |
солянокислый |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
фенилдиазоний |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
NaNO2 |
|
+ HCl |
|
|
|
HNO2 + NaCl |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Гомологи фенола могут быть получены аналогичными реакциями из сульфо-, галогенили аминопроизводных гомологов бензола. Существуют также методы введения алкильной группы в ядро фенола (см. ниже алкилирование фенолов).
4.6.3. ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛОВ
Фенолы существенно отличаются по своим химическим свойствам от спиртов. Главной причиной этих отличий является различный характер электронных взаимодействий гидроксильной группы с углеводородными радикалами спиртов и фенолов. В спиртах гидроксильная группа связана с атомом углерода в sp3-гибридизации. За счѐт отрицательного индуктивного эффекта (-I) гидроксильной группы происходит смещение электронной плотности по σ-связи и образование на атоме кислорода частично отрицательного заряда.
В фенолах кислородный атом гидроксильной группы связан с углеродом ароматической системы и поэтому наряду с отрицательным индуктивным эффектом (-I) имеет место положительный мезомерный эффект (+М). Это делает атом водорода фенольного гидроксила более подвижным в сравнении с атомом водорода спиртового гидроксила.
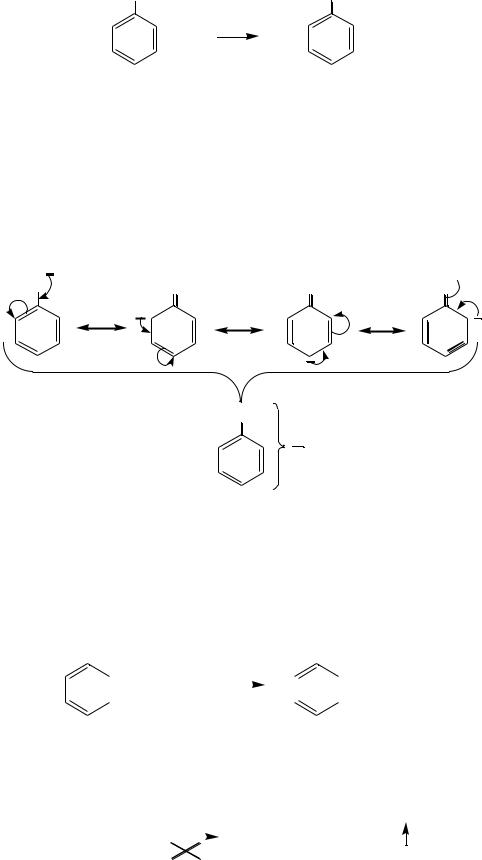
При отрыве протона от фенола образуется феноксианион, при отрыве протона от спирта – алкоксианион:
111
OH |
O- |
- H+
феноксианион
- H+
CH3CH2OH  CH3CH2O-
CH3CH2O-
этоксианион
Феноксианион – более стабильная частица, чем алкоксианион. Причина этого в том, что образование феноксианиона сопровождается выйгрышем энергии, а его строение описывается четырьмя мезомерными структурами (чем больше резонансных структур, тем стабильнее частица). В то время как у алкоксианиона мезомеров нет.
O O O O
O
Таким образом, фенолы легче отщепляют протон, чем спирты, а, значит, фенолы – более кислые соединения, чем спирты.
Образование солей (кислотные свойства фенолов). Доказательством более сильных кислотных свойств фенолов по сравнению со спиртами может служить их реакция с водными растворами щелочей с образованием солей – фенолятов:
OH |
|
|
O- Na+ |
||||||||
|
|
|
|
+ NaOH |
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
||
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
фенолят натрия
В отличие от фенолов спирты, как более слабые кислоты, способны образовывать алкоголяты только со щелочными металлами:
2C H OH |
2Na |
2C H O-Na+ |
+ H |
|
||
|
2 |
|||||
|
||||||
2 |
5 |
NaOH |
2 |
5 |
|
|
|
|
этилат натрия |
|
|
||
|
|
|
|
|
||
Феноляты железа имеют комплексный характер. Их растворы интенсивно окрашены. Это используется для качественного открытия фенолов. Фенол даѐт
112
с раствором FeCl3 фиолетовую окраску, крезолы – голубую. Железо в этих комплексах имеет координационное число 6.
|
OH |
|
H |
O |
H |
|
|
|
O |
O |
|
6 |
+ FeCl3 |
|
Fe |
||
|
|
- 3HCl |
O |
|
O |
|
|
|
|
|
|
|
|
|
|
O H |
|
Образование простых и сложных эфиров фенола. При взаимодействии фенолятов с галогеналканами образуются простые эфиры. Поскольку при этом алкилируется атом кислорода, такие реакции называют О-алкилированием. Под действием ацилирующих агентов (галогенангидридов и ангидридов карбоновых кислот) феноляты превращаются в сложные эфиры:
|
|
|
O C2H5 |
||
C2H5Br |
|
|
|
|
|
- NaBr |
|
|
|
|
|
O- Na+ |
|
|
фенилэтиловый эфир |
||
O |
|
|
|
||
CH3 |
C |
Cl |
|
|
O |
|
|
O |
C |
|
|
- NaCl |
|
CH3 |
|||
|
|
|
|||
|
|
|
|
|
|
фенолят натрия |
|
|
|
|
|
( CH3CO )2O |
фенилацетат |
|
|||
|
|
|
|
||
- CH3COONa |
|
|
|
||
В реакцию ацилирования могут вступать и фенолы:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
( CH3CO )2O |
|
|
O |
|
|
|
|
C |
CH3 |
||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
- CH3COOH |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||||
фенол |
|
фенилацетат |
|
|||||||||||
Реакции электрофильного замещения в ароматическом кольце.
Гидроксильная группа, как заместитель І рода, сильно активирует бензольное кольцо по отношению к реакциям электрофильного замещения и направляет входящие электрофильные реагенты в орто- и пара-положения.
113
Г а л о г е н и р о в а н и е. Реакция идѐт очень легко (даже в отсутствие кислот Льюиса). Фенолы обесцвечивают бромную воду, причѐм происходит замещение всех атомов водорода в орто- и пара-положениях. Избытком бромной воды бромфенолы могут бромироваться и дальше, но уже с нарушением ароматичности цикла:
. |
.. |
O |
|
. |
|
фенол
H |
|
|
OH |
|
|
|
|
O |
|
|
|
|||||||
|
|
3Br |
(H O) |
Br |
|
|
|
Br |
Br2 (H2O) |
Br |
|
|
|
|
Br |
|||
|
|
|
|
|
|
|
||||||||||||
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-3HBr |
|
|
|
|
|
- HBr |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Br |
Br |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
Br |
|
|
|||||||||||
|
|
|
|
2,4,6-трибромфенол |
|
|
2,4,4,6-тетрабром- |
|||||||||||
циклогексадиен-2,5-он-1
Если бромирование проводить в низкополярном растворителе (CCl4, CHCl3), можно получить преимущественно монобромфенолы с преобладающим количеством пара-изомера:
OH
2
2Br2 (CCl4)
-2HBr
OH |
OH |
|
Br |
|
+ |
|
Br |
фенол |
о-бромфенол |
п-бромфенол |
Можно также подобрать условия, при которых в реакции бромирования получается преимущественно дибромзамещѐнный фенол. При хлорировании фенолов образуются, главным образом, орто-изомеры. Йод непосредственно не йодирует фенолы.
Н и т р о в а н и е. Реакция нитрования фенола происходит уже при действии разбавленной азотной кислоты при комнатной температуре и приводит к образованию смеси орто- и пара-нитрофенолов (с преобладанием первого изомера). При действии концентрированной HNO3 фенол превращается в 2,4,6-тринитрофенол (пикриновую кислоту):
|
OH |
|
|
OH |
|
OH |
|
|
|
|
|
OH |
||||||||||||
|
|
|
|
2HNO3 |
(разб.) |
|
|
|
NO2 |
|
4HNO3 |
(конц.) |
O2N |
|
|
|
NO2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2 |
|
|
|
|
|
|
+ |
|
|
|
|
2 |
|
|
|
|
||||||||
|
|
|
|
- 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
- 4H O |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
фенол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
NO2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2,4,6-тринитрофенол (пикриновая кислота)
С у л ь ф и р о в а н и е. Сульфирование фенола идѐт очень легко и в зависимости от температуры приводит к орто- или пара-изомерам. Причѐм первый при нагревании его до 100 оС перегруппировывается во второй:
114
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
SO3H |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
25 C |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
о-фенолсульфокислота |
||||||||||||||||||
|
|
|
|
H2SO4(конц.) |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
фенол |
|
|
|
|
|
||||||||||||||
100 оC |
|
|
|
|
|
|
|
|
|
|
|
100 оC |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3H
п-фенолсульфокислота
А л к и л и р о в а н и е. Алкилирование фенолов можно проводить по реакции Фриделя-Крафтса, но выходы продуктов при этом, как правило, невысокие. Обычно для алкилирования используют спирты и алкены в присутствии H2SO4, H3PO4 или BF3 :
|
OH |
|
|
OH |
|
OH |
|||||||||
|
|
|
|
+ 2CH3OH |
BF3 |
|
|
|
|
CH3 |
|
|
|
|
+ 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
+ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
|
фенол |
|
орто-крезол |
пара-крезол |
|||||||||||
А ц и л и р о в а н и е. Ацилирование фенолов также можно проводить по реакции Фриделя-Крафтса, действуя на фенолы хлорангидридами или ангидридами кислот в присутствии кислот Льюиса:
|
OH |
|
|
|
|
|
|
|
OH |
O |
|
|
OH |
|||||||||
|
|
|
|
|
|
|
|
O |
AlCl3 |
|
|
|
|
C |
|
|
|
|
|
|
||
2 |
|
|
|
+ 2CH |
|
|
C |
|
|
|
|
CH3 |
+ |
|
|
|
|
+ 2HCl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
3 |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенол |
|
|
|
|
|
|
2-гидроксиацетофенон |
|
|
C |
CH3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
(2-ацетилфенол) |
|
|
O |
||||||||
4-гидроксиацетофенон (4-ацетилфенол)
Однако чаще ацильные производные фенолов получают в две стадии: вначале фенолы превращают в сложные эфиры, которые затем нагревают с AlCl3. При этом происходит миграция ацильной группы от атома кислорода гидроксильной группы в орто- или пара-положения ароматического кольца. Эта реакция получила название перегруппировки Фриса:
115
