
04.Гидроксильные производные
.pdf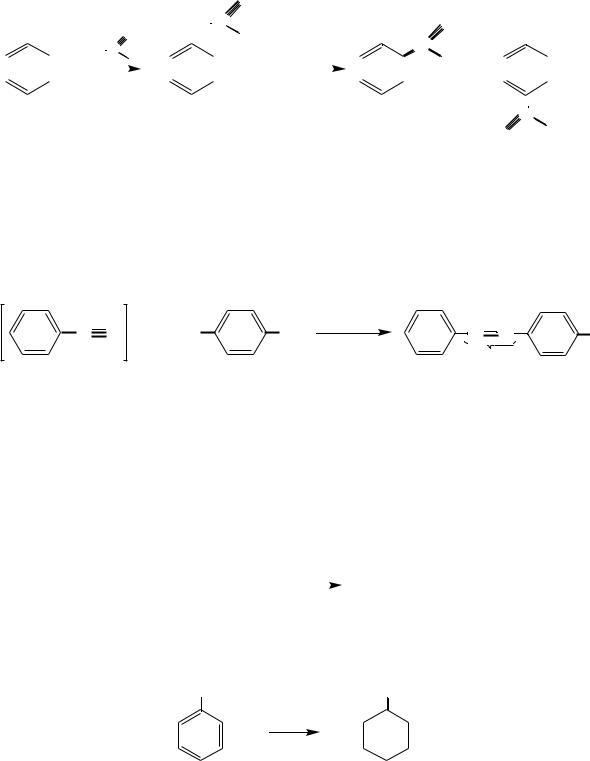
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
O |
|
O |
|
C |
CH3 |
|
|
OH |
O |
OH |
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
|
|
|
2CH3 |
|
C |
Cl |
2 |
|
|
|
|
|
|
AlCl3; t |
|
|
|
|
CH3 + |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
- 2HCl |
|
|
|
|
|
|
|
|
CS2 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
фенол |
|
|
|
|
фенилацетат |
|
2-гидроксиацетофенон |
C |
CH3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2-ацетилфенол) |
O |
|
|
|
||||||
4-гидроксиацетофенон (4-ацетилфенол)
Азосочетание. Водород ароматического ядра в фенолах может замещаться катионом фенилдиазония с образованием азосоединений. Сочетание идѐт в пара-положение, если же оно занято, - в орто-положение относительно фенольного гидроксила.
+ |
|
NaOH |
|
|
|
N N Cl - + H |
OH |
N N |
OH |
||
- NaCl; |
|||||
|
|
|
|
||
|
|
- H2O |
азогруппа |
|
|
|
|
|
|
||
бензолдиазоний хлорид |
фенол |
|
4 - гидроксиазобензол |
|
|
(солянокислый фенилдиазоний) |
|
|
|
|
Восстановление. В зависимости от того, какой реагент используется в качестве восстановителя, восстановление фенолов может затрагивать фенольные гидроксилы или ароматическое ядро.
При перегонке фенолов с цинковой пылью происходит замещение гидроксильных групп водородом. Этим методом иногда пользуются для определения структуры сложных фенолов:
C6H5OH + Zn |
|
C6H6 + ZnO |
|
При каталитическом гидрировании, например действии водорода в присутствии никеля, фенолы восстанавливаются до циклоалканолов:
OH OH
3H2
Ni
фенол циклогексанол
Приведенная реакция имеет важное промышленное применение в производстве искусственного волокна найлон, капрон.
П о л у ч е н и е н а й л о н а. Образовавшуюся в результате глубокого окисления циклогексанола адипиновую кислоту подвергают поликонденсации с гексаметилендиамином:
116
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
H2C |
CH |
CH2 |
[ O ] |
|
|
|
|
|
|
|
|
H2C |
|
C |
CH2 |
|
|
3 [ O ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
C |
|
|
|
|
(CH2)4 |
|
|
|
|
C |
|
|
OH |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
H2C |
|
|
CH2 |
- H2O |
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
циклогексанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
циклогексанон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
адипиновая кислота |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
HO |
|
|
|
|
C |
|
|
|
(CH2)4 |
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
OH |
|
|
H2N |
|
|
(CH2)6 |
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гексаметилендиамин |
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
C |
|
( CH2 )4 |
|
C |
|
OH |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
N |
|
|
|
|
|
|
(CH2)6 |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и т. д. |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
|
|
N |
|
|
|
|
|
N |
|
|
C |
|
|
|
|
C |
|
|
OH |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
C |
|
|
|
|
|
(CH2)4 |
|
|
|
|
C |
|
|
N |
|
|
(CH2)6 |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
найлон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
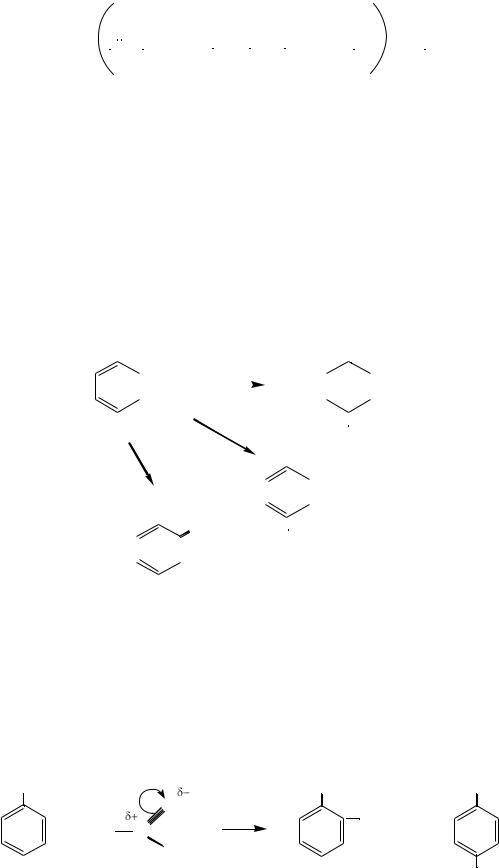
П о л у ч е н и е |
|
|
|
|
к а п р о н а. При |
|
окислении циклогексанола можно |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
получить циклогексанон, который в реакции с гидроксиламином даѐт циклогексаноноксим. Последний с помощью перегруппировки Бекмана превращают в капролактам. Гидролиз капролактама приводит к образованию ε- аминокапроновой кислоты. При полимеризации капролактама или при поликонденсации ε-аминокапроновой кислоты получается пластмасса капрон, которая и используется для приготовления синтетического капронового
волокна: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
O |
|
|
|
|
|
|
|
N |
|
O |
|
H |
|
|
|
|
|
O |
|
H |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H C C |
CH |
|
NH2OH |
H C |
C |
|
CH |
|
|
H2SO4 |
H C |
C CH |
|
||||||||||||||||
2 |
|
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
2 |
H2C |
CH2 |
- H2O |
H2C |
|
|
|
|
CH2 |
перегруппировка |
H2C CH2 |
|||||||||||||||||||
|
|
|
|
Бекмана |
|||||||||||||||||||||||||
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
CH2 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
циклогексанон |
циклогексаноноксим |
||||||||||
|
|
|
|
O |
H |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
H C C |
|
|
|
||||
|
|
|
|
CH |
|
H2O |
|||||
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
H2C CH2
CH2
O
HO C (CH2)5 NH2
карполактам |
-аминокапроновая кислота |
117
|
|
O |
|
H |
|
O |
|
|
|
H |
|
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)5 |
HO |
|
C |
|
(CH2)5 |
|
N |
|
C |
|
(CH2)5 |
|
N |
|
C |
|
|||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|||||
капрон
Окисление. Фенолы легко окисляются даже при действии кислорода воздуха. При этом они изменяют свой цвет, окрашиваясь в розовый, краснорозовый или тѐмно-коричневый цвет. Примеси ускоряют окисление и поэтому неочищенные фенолы быстро темнеют. В зависимости от природы окислителя и условий проведения реакции окисления фенолы могут превращаться в различные продукты. Например, оксид хрома (VI) в кислой среде окисляет фенол в п-бензохинон; персульфат калия в щелочной среде – в гидрохинон (реакция Эльбса); перекись водорода в щелочной среде в присутствии закисного сернокислого железа – в пирокатехин:
OH |
|
|
|
|
|
|
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
CrO3, H+ |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K2S2O8 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
O п-бензохинон |
|||||||||
|
|
|
H2O2 |
|
OH - |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
OH - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
гидрохинон |
|||||||
|
|
|
OH |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
пирокатехин |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
В условиях более энергичного окисления ароматическое ядро фенолов разрушается.
Поликонденсация фенола с формальдегидом. Фенол легко вступает в реакцию конденсации с формальдегидом в кислой или щелочной среде. При этом вначале образуется смесь орто- и пара-гидроксиметилфенолов, способных далее реагировать с фенолом и между собой, образуя фенолформальдегидные смолы :
OH |
|
OH |
OH |
|
|
O |
CH2OH |
|
|
2 |
+ 2 H C |
+ |
||
|
||||
|
H |
|
|
|
фенол |
формальдегид |
о-гидроксиметилфенол |
CH2OH |
|
|
|
|
п-гидроксиметилфенол
118

Вкислой среде в избытке фенола гидроксиметилфенолы конденсируются
смолекулами фенола, давая полимеры линейного строения – новолачные смолы:
|
OH |
|
|
|
OH |
|
|
|
|
|
OH |
|
|
|
|
|
OH |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
n |
|
|
|
|
CH2OH |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
+ |
n H2O |
|||||
|
|
|
|
|
|
+ n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
о-гидроксиметилфенол |
|
|
|
фенол |
|
|
|
|
|
|
|
|
|
|
|
|
(n-1) |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
новолачная смола |
|
|
|||||||||||||||||||||
Новолачные смолы (новолаки) – термопластичные, растворимые в органических растворителях полимеры. Используются для изготовления лаков
ифенопластов.
Вщелочной среде в избытке формальдегида в результате поликонденсации гидроксиметилфенолов между собой образуется линейный растворимый полимер резол (легкоплавкая фенол-формальдегидная смола):
|
OH |
|
|
OH |
|
|
OH |
|
|
|
OH |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ОH - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
n |
|
|
|
|
CH2OH |
H |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
+ |
n H2O |
||||
+ n |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о-гидроксиметилфенол |
|
|
CH2OH |
|
|
|
|
|
|
|
|
CH OH |
|
n |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
п-гидроксиметилфенол |
|
|
|
резол (резольная смола) |
|
|
|
|
|||||||||||||||
При нагревании резола до 150-160 оС происходит «сшивание» его полимерных цепей с образованием сетчатого нерастворимого полимера резита (неплавкой фенол-формальдегидной смолы):
OH |
OH |
OH |
OH |
CH2 |
CH2 |
|
CH2 |
CH2 |
CH2 |
CH2 |
CH2 |
CH2 |
CH2 |
|
CH2 |
OH |
OH |
OH |
OH |
|
резит |
|
|
119
