
- •Министерство образования и науки украины
- •Содержание
- •Введение
- •Варианты контрольных заданий для расчетно-графической работы
- •План выполнения расчетно – графической работы
- •Пример выполнения индивидуального задания
- •1. Характеристика объекта исследования.
- •2. Расчет водородного показателя воды
- •2.1. Теоретическая часть
- •Расчет рН растворов сильных и слабых электролитов
- •Сильные электролиты
- •Константы диссоциации слабых кислот и оснований при 25 оС
- •3. Гидролиз солей
- •3.1. Теоретическая часть
- •3.2. Примеры решения индивидуального задания
- •Решение
- •Решение
- •3.3. Индивидуальные задания
- •Состав солей исследуемой воды
- •4. Расчет показателей жесткости воды
- •4.1. Теоретическая часть
- •4.2. Пример решения индивидуального задания
- •Решение
- •Показатели жесткости исследуемой воды
- •4.3 Индивидуальные задания
- •Состав исследуемой воды
- •5. Расчет дозы реагентов для умягчения исследуемой воды
- •5.1. Теоретическая часть
- •5.2. Пример решения индивидуального задания
- •Значения коэффициента Стьюдента
- •6.2. Пример решения индивидуального задания
- •Решение
- •0,146 Г содержится в 100 см3
- •6.3. Индивидуальные задания
- •Содержание взвешенных веществ в исследуемой воде
- •7. Расчетное задание по оценке качества питьевой воды
- •7.1. Теоретическая часть
- •7.2. Пример решения индивидуального задания
- •Состав исследуемой воды
- •Решение
- •Соответствует гСанПиН
- •Содержание главных ионов в воде
- •7.3. Индивидуальные задания
- •8. Графическое выражение результатов анализа воды
- •8.1. Теоретическая часть
- •Состав исследуемой воды
- •8.2. Пример решения индивидуального задания
- •Содержание главных ионов в воде
- •Решение
- •Состав исследуемой воды
- •Гипотетический состав солей
- •8.3. Индивидуальные задания
- •Состав исследуемой воды
- •9. 2. Расчет содержания карбонатных ионов в воде
- •9.1. Теоретическая часть
- •Пример решения индивидуального задания
- •Оценка стабильности воды
- •10.3. Пример решения индивидуального задания
- •Решение
- •10.3. Индивидуальные задания
- •Состав исследуемой воды
- •11. Расчетно - графическое определение величины хлорпоглощаемости воды
- •11.1 Теоретическая часть
- •11.2. Пример решения индивидуального задания
- •Решение
- •Результаты пробного хлорирования воды
- •11.3. Индивидуальные задания
- •Результаты хлорирования воды
- •Литература
4. Расчет показателей жесткости воды
4.1. Теоретическая часть
Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Различают общую, карбонатную и некарбонатную жесткость.
Общей жесткостью (Жо) называется суммарная концентрация ионов Ca2+ и Mg2+ в воде, выраженная в моль/м3 или ммоль/дм3. Общая жесткость воды (ЖО) равна сумме карбонатной и некарбонатной жесткости.
ЖО = [Са2+] + [Mg2+] = ЖК + ЖНК; (ммоль/дм3)
Количественно жесткость воды определяется суммой молярных концентраций эквивалентов ионов кальция и магния, содержащихся в 1 дм3 воды (ммоль/дм3, мг - экв/дм3 ).
Карбонатная (временная) жесткость (ЖК) обусловлена содержанием в воде преимущественно гидрокарбонатов (и карбонатов при рН > 8,3) солей кальция и магния: Ca(НСО3)2, Мg(НСО3)2, (МgСО3).
Некарбонатная жесткость воды (ЖНК) обусловлена присутствием в воде сульфатов и хлоридов солей кальция и магния: СаSO4, MgSO4, СаС12, MgС12. Некарбонатная жесткость – часть общей жесткости, равная разности между общей и карбонатной жесткостью:
Жнк = Жо – Жк
По величине жесткости природную воду делят на: очень мягкую — до 1,5 ммоль/дм3; мягкую — от 1,5 до 4 ммоль/дм3; средней жесткости — от 4 до 8 ммоль/дм3; жесткую — от 8 до 12 ммоль/дм3; очень жесткую — свыше 12 ммоль/дм3.
В зависимости от конкретных требований производства допускаемая жесткость воды может быть различной. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/дм3 (мг-экв/дм3).
4.2. Пример решения индивидуального задания
Пример.
Условие задания: Рассчитать карбонатную, некарбонатную и общую жесткость воды, если в 1м3 исследуемой воды содержится 80 г Ca2+; 55 г Mg2+; 415 г HCO3-.
Дано:
m (Са2+) = 80 г = 80 000 мг
m (Mg2+) = 55 г = 55 000 мг
m (HCO3-) = 415 г = 415 000 мг
V(Н2О) = 1 м3 = 1000 дм3
Жо -? Жк - ? Жнк - ?
Решение
1). Жесткость общую рассчитывают по формуле:
Жо
=[Са2+]
+ [Mg2+]
=
![]() +
+![]() ;
мг – экв/дм3
;
мг – экв/дм3
где: [Са2+], [Mg2+] – концентрация ионов в мг-экв/дм3;
m (Са2+), m (Mg2+) – содержание ионов Са2+ и Mg2+ в мг;
V(Н2О) – объем воды, дм3;
Э (Са2+), Э (Mg2+) – эквивалентная масса ионов Са2+ и Mg2+, которая равна:
Э
(Са2+)
=
![]()
Э(Mg2+)
=
![]()
Тогда:
Жо
= [Са2+]
+
[Mg2+]
=
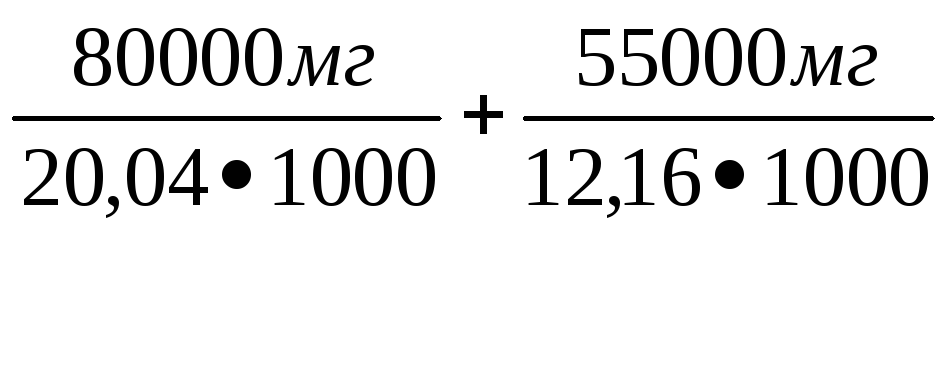 =3,99
+
4,52
= 8,5 мг-экв/дм3
=3,99
+
4,52
= 8,5 мг-экв/дм3
2). Рассчитываем жесткость карбонатную (Жк) по формуле:
Жк
= [НСО3-]
=
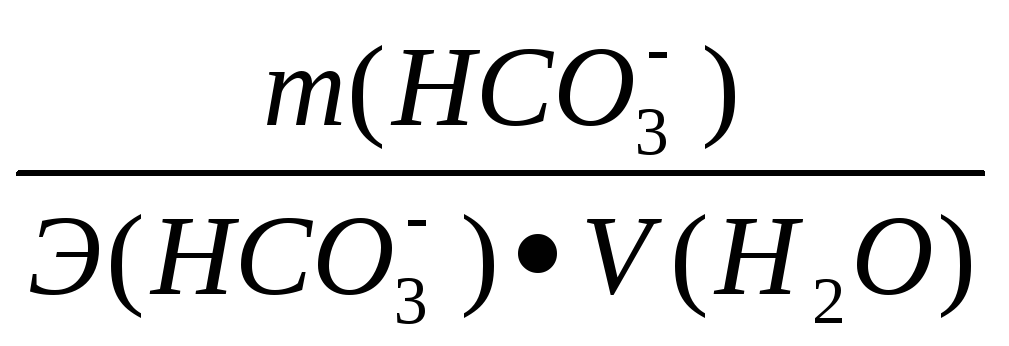
где: [НСО3-] - концентрация в мг-экв/дм3; m (НСО3-) – содержание иона НСО3- в мг; V(Н2О) – объем воды, дм3; Э (НСО3-) – эквивалентная масса иона НСО3-, которая равна:
Э
(НСО3-)
=
![]()
Тогда:
Жк
= [НСО3-]
=![]()
3). Рассчитываем жесткость некарбонатную (Жнк), как разность между жесткостью общей и карбонатной:
Жнк = Жо – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3
4). Результаты расчетов приведены в табл. 4.6.
Таблица 4.6
Показатели жесткости исследуемой воды
|
Наименование показателя: |
Содержание в: | |
|
мг-экв/дм3 |
мг/дм3 | |
|
Са2+ |
3,99 |
3,99 • 20,04 = 80 |
|
Mg2+ |
4,52 |
4,52 • 12,16 = 55 |
|
Жесткость общая, Жо |
8,5 |
- |
|
Жесткость карбонатная, Жк |
6,8 |
- |
|
Жесткость некарбонатная, Жнк |
1,7 |
- |
