
- •Министерство образования и науки украины
- •Содержание
- •Введение
- •Варианты контрольных заданий для расчетно-графической работы
- •План выполнения расчетно – графической работы
- •Пример выполнения индивидуального задания
- •1. Характеристика объекта исследования.
- •2. Расчет водородного показателя воды
- •2.1. Теоретическая часть
- •Расчет рН растворов сильных и слабых электролитов
- •Сильные электролиты
- •Константы диссоциации слабых кислот и оснований при 25 оС
- •3. Гидролиз солей
- •3.1. Теоретическая часть
- •3.2. Примеры решения индивидуального задания
- •Решение
- •Решение
- •3.3. Индивидуальные задания
- •Состав солей исследуемой воды
- •4. Расчет показателей жесткости воды
- •4.1. Теоретическая часть
- •4.2. Пример решения индивидуального задания
- •Решение
- •Показатели жесткости исследуемой воды
- •4.3 Индивидуальные задания
- •Состав исследуемой воды
- •5. Расчет дозы реагентов для умягчения исследуемой воды
- •5.1. Теоретическая часть
- •5.2. Пример решения индивидуального задания
- •Значения коэффициента Стьюдента
- •6.2. Пример решения индивидуального задания
- •Решение
- •0,146 Г содержится в 100 см3
- •6.3. Индивидуальные задания
- •Содержание взвешенных веществ в исследуемой воде
- •7. Расчетное задание по оценке качества питьевой воды
- •7.1. Теоретическая часть
- •7.2. Пример решения индивидуального задания
- •Состав исследуемой воды
- •Решение
- •Соответствует гСанПиН
- •Содержание главных ионов в воде
- •7.3. Индивидуальные задания
- •8. Графическое выражение результатов анализа воды
- •8.1. Теоретическая часть
- •Состав исследуемой воды
- •8.2. Пример решения индивидуального задания
- •Содержание главных ионов в воде
- •Решение
- •Состав исследуемой воды
- •Гипотетический состав солей
- •8.3. Индивидуальные задания
- •Состав исследуемой воды
- •9. 2. Расчет содержания карбонатных ионов в воде
- •9.1. Теоретическая часть
- •Пример решения индивидуального задания
- •Оценка стабильности воды
- •10.3. Пример решения индивидуального задания
- •Решение
- •10.3. Индивидуальные задания
- •Состав исследуемой воды
- •11. Расчетно - графическое определение величины хлорпоглощаемости воды
- •11.1 Теоретическая часть
- •11.2. Пример решения индивидуального задания
- •Решение
- •Результаты пробного хлорирования воды
- •11.3. Индивидуальные задания
- •Результаты хлорирования воды
- •Литература
7.2. Пример решения индивидуального задания
Условие задания: Оценить качество исследуемой воды заданного состава по ГСанПиН 2.2.4-171-10:
Таблица 7.10
Состав исследуемой воды
|
Показатели |
Исследуемая вода: |
ГСанПиН 2.2.4-171-10 | |
|
мг/дм3 |
мг-экв/дм3 | ||
|
Температура, оС |
10 |
- |
|
|
рН |
7,1 |
- |
6,5 – 8,5 |
|
Цветность, град. |
10 |
- |
≤ 20 (35) |
|
Запах при 20оС (60о), баллы |
2 |
- |
≤ 2 |
|
Мутность |
0,5 |
- |
≤ 0,58 (1,74) |
|
Кальций |
80 |
80 : 20,04 = 4,0 |
|
|
Магний |
55 |
55 : 12,16 = 4,5 |
|
|
Натрий (расчетный) |
- |
- |
≤ 200 |
|
Гидрокарбонаты |
415 |
415 : 61 = 6,8 |
|
|
Сульфаты |
168 |
168 : 48 = 3,5 |
≤ 250 (500) |
|
Хлориды |
149 |
149 : 35,5 = 4,2 |
≤ 250 (350) |
|
Углекислый газ |
120 |
|
|
|
Общая щелочность |
- |
6,8 |
|
|
Перманганатная окисляемость, мгО/дм3 |
2,5 |
- |
≤ 5 |
|
ОМЧ, КОЕ/см3 |
150 |
- |
≤ 100 |
Решение
1). Для решения данного задания необходимо рассчитать концентрацию ионов в мг - экв/дм3.
Для этого концентрацию иона в мг/дм3 следует разделить на эквивалентную массу иона (см. табл. 7.10). Например:
![]()
где: [Ca2+] - концентрация иона в мг/дм3; Э - эквивалентная масса иона кальция.
2). На основании экспериментальных данных состава воды, приведенных в табл. 7.10, рассчитываем концентрацию неизвестного иона натрия.
Поскольку вода электронейтральна:
å анионов = å катионов, мг - экв/дм3.
[SO4 2-] + [Cl-] + [HCO3-] = [Ca2+] + [Mg2+] + [Na+]
где: [SO42-], [Cl-], [HCO3-], [Ca2+], [Mg2+], [Na+] – концентрация ионов в
мг -экв/дм3.
Концентрацию неизвестного иона (натрия) рассчитываем следующим образом:
[Na+] (расчетный) = ( [SO4 2- ]+ [Cl-] + [HCO3-] ) – ( [Ca2+] + [Mg2+] ) =
= (3,5 + 4,2 + 6,8) – (4,0 + 4,5) = 6,0 мг-экв/дм3
[Na+] = 6,0 мг-экв/дм3 • 23 = 138 мг/дм3
Содержание в исследуемой воде иона [Na+] = 138 мг/дм3 ≤ ПДК = 200 мг/дм3
– соответствует ГСанПиН
3). Расчет величины сухого остатка (солесодержание). Рассчитываем сухой остаток как сумму анионов и катионов в мг/дм3 (концентрацию гидрокарбонатных ионов делят на 2):
сухой
остаток (расчетный)=
[SO4
2- ]+
[Cl-]+
![]() +
[Ca2+]
+ [Mg2+]+
[Na+]
= =168 + 149 + 415/2 + 80 + 55 + 138 = 798
мг/дм
3
< 1000
мг/дм3
-
+
[Ca2+]
+ [Mg2+]+
[Na+]
= =168 + 149 + 415/2 + 80 + 55 + 138 = 798
мг/дм
3
< 1000
мг/дм3
-
Соответствует гСанПиН
4). Результаты расчетов содержания главных ионов в исследуемой воде
вносим в табл. 7.11.
Таблица 7.11
Содержание главных ионов в воде
|
Концентрация: | |||||
|
катионы |
мг/ дм3 |
мг - экв/дм3 |
анионы |
мг/ дм3 |
мг - экв/дм3 |
|
Ca2+ |
80 |
4,0 |
HCO3- |
415 |
6,8 |
|
Mg2+ |
55 |
4,5 |
SO42- |
168 |
3,5 |
|
Na+ |
138 |
6,0 |
Cl- |
149 |
4,2 |
5). Содержание взвешенных веществ (мутность) в исследуемой воде не превышает допустимую норму:
0,5 мг/дм3 ≤ 0,58 мг/дм3 - соответствует ГСанПиН
6). Содержание хлоридов и сульфатов в пределах ПДК:
[Cl-] = 149 мг/дм3 < 250 мг/дм3
[ SO4 2-] = 168 мг/дм3 < 250 мг/дм3
Сумма отношений концентраций хлоридов и сульфатов к ПДК не должна превышать 1:
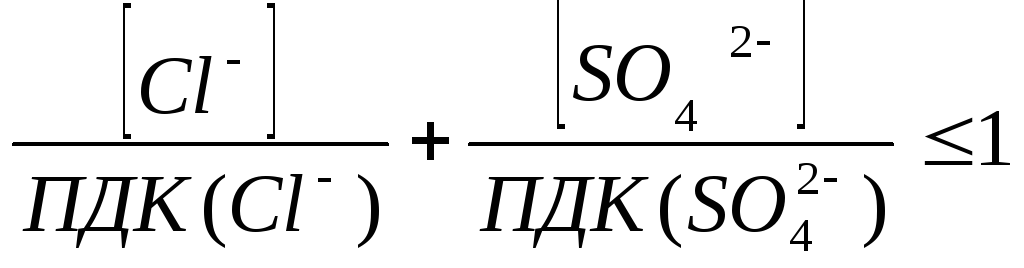
Соответственно:
![]() - не
соответствует ГСанПиН
- не
соответствует ГСанПиН
7). Величина показателя жесткость общая равна:
Жо
=
![]() >
7 мг – экв/дм3
>
7 мг – экв/дм3
- не соответствует ГСанПиН
8). рН = 7,1 находится в пределах 6,5 – 8,5 – соответствует ГСанПиН.
9). Вычислить концентрацию водородных и гидроксильных ионов в воде при
рН = 7,1.
Концентрация водородных ионов рассчитывается по формуле:
[Н+] = 10-рН = 10 -7,1 = 7,94 •10-8 моль/дм3
Концентрация гидроксильных ионов рассчитывается по формуле:
[OН-] = 10-рOН
рОН = 14 – рН = 14 – 7,1 = 6,9
[OН-] = 10 -6,9 = 1,26 • 10 -7 моль/дм3
10). Показатель перманганатная окисляемость 2,5 мгО/дм3 < 5,0 мгО/дм3
– соответствует ГСанПиН.
11). Оценка качества воды по микробиологическим показателям:
ОМЧ = 150 КОЕ/см3 > 100 КОЕ/см3 – не соответствует ГСанПиН.
12). Показатели цветность, запах и мутность - соответствуют ГСанПиН.
Заключение: Качество исследуемой воды по приведенным показателям не соответствует требованиям ГСанПиН 2.2.4-171-10 для воды централизованного питьевого водоснабжения.
