
- •Министерство образования и науки украины
- •Содержание
- •Введение
- •Варианты контрольных заданий для расчетно-графической работы
- •План выполнения расчетно – графической работы
- •Пример выполнения индивидуального задания
- •1. Характеристика объекта исследования.
- •2. Расчет водородного показателя воды
- •2.1. Теоретическая часть
- •Расчет рН растворов сильных и слабых электролитов
- •Сильные электролиты
- •Константы диссоциации слабых кислот и оснований при 25 оС
- •3. Гидролиз солей
- •3.1. Теоретическая часть
- •3.2. Примеры решения индивидуального задания
- •Решение
- •Решение
- •3.3. Индивидуальные задания
- •Состав солей исследуемой воды
- •4. Расчет показателей жесткости воды
- •4.1. Теоретическая часть
- •4.2. Пример решения индивидуального задания
- •Решение
- •Показатели жесткости исследуемой воды
- •4.3 Индивидуальные задания
- •Состав исследуемой воды
- •5. Расчет дозы реагентов для умягчения исследуемой воды
- •5.1. Теоретическая часть
- •5.2. Пример решения индивидуального задания
- •Значения коэффициента Стьюдента
- •6.2. Пример решения индивидуального задания
- •Решение
- •0,146 Г содержится в 100 см3
- •6.3. Индивидуальные задания
- •Содержание взвешенных веществ в исследуемой воде
- •7. Расчетное задание по оценке качества питьевой воды
- •7.1. Теоретическая часть
- •7.2. Пример решения индивидуального задания
- •Состав исследуемой воды
- •Решение
- •Соответствует гСанПиН
- •Содержание главных ионов в воде
- •7.3. Индивидуальные задания
- •8. Графическое выражение результатов анализа воды
- •8.1. Теоретическая часть
- •Состав исследуемой воды
- •8.2. Пример решения индивидуального задания
- •Содержание главных ионов в воде
- •Решение
- •Состав исследуемой воды
- •Гипотетический состав солей
- •8.3. Индивидуальные задания
- •Состав исследуемой воды
- •9. 2. Расчет содержания карбонатных ионов в воде
- •9.1. Теоретическая часть
- •Пример решения индивидуального задания
- •Оценка стабильности воды
- •10.3. Пример решения индивидуального задания
- •Решение
- •10.3. Индивидуальные задания
- •Состав исследуемой воды
- •11. Расчетно - графическое определение величины хлорпоглощаемости воды
- •11.1 Теоретическая часть
- •11.2. Пример решения индивидуального задания
- •Решение
- •Результаты пробного хлорирования воды
- •11.3. Индивидуальные задания
- •Результаты хлорирования воды
- •Литература
Решение
1.Уравнение реакции гидролиза соли NH4Cl, которая образована слабым основанием NH4OH и сильной кислотой HCl, имеет вид:
NH4Cl + НОН ⇄ NH4ОН + HCl
NH4+ + Cl- + НОН ⇄ NH4ОН + H+ + Cl-
NH4+ + НОН ⇄ NH4ОН +H+
2. Константа гидролиза Кг для соли, которая образована слабым основанием и сильной кислотой, рассчитывается по формуле:
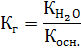
Тогда:
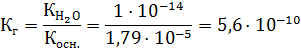
3. Концентрация ионов водорода равна:
![]() г –
ион/дм3
г –
ион/дм3
4. Рассчитываем рН раствора соли:
pH = – lg 7,5 • 10-6 = 3,84
Пример № 5.
Условие задания: Написать уравнение гидролиза соли CH3COONH4. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли CH3COONH4, если известно, что константа диссоциации гидроксида аммония Кд(NH4OH) = 1,79 • 10-5, а константа диссоциации уксусной кислоты Кд (СH3COOH) = 1,86 • 10–5 (табл. 2.2).
Решение
1.Уравнение реакции гидролиза соли CH3COONH4, которая образована слабым основанием NH4OH и слабой кислотой СH3COOH, имеет вид:
CH3COONH4 + НОН ⇄ CH3COOН + NH4ОН
CH3COO- + NH4 + + НОН ⇄ CH3COOН + NH4ОН
2. Константа гидролиза Кг для соли, которая образована слабым основанием и слабой кислотой, рассчитывается по формуле:
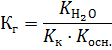
Тогда:
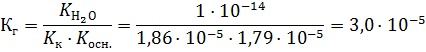
3. Концентрация ионов водорода равна:
![]() г
– ион/дм3
г
– ион/дм3
4. Рассчитываем рН раствора соли:
pH = – lg 1,02 • 10-7 = 6,99
3.3. Индивидуальные задания
Условия заданий (табл. 3.5):
Задание № 1. Написать уравнение ступенчатого гидролиза соли с указанием реакции среды. Привести константу равновесия для каждой стадии (см. примеры № 1,2);
Задание № 2. Написать уравнение гидролиза соли. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли (см. примеры № 3,4,5).
Таблица 3.5
Состав солей исследуемой воды
|
№ задания |
Условия заданий: | ||
|
Задание № 1 |
Задание № 2 | ||
|
Формула соли |
Концентрация соли, С (М) |
Формула соли | |
|
1 |
Al2(SO4)3 |
0,25 |
(CH3COO)2Ba |
|
2 |
K2SiO3 |
0,12 |
NH4OCl |
|
3 |
SnBr2 |
0,37 |
NaOBr |
|
4 |
Rb2CrO4 |
0,55 |
NH4NO3 |
|
5 |
FeCl3 |
0,48 |
KNO2 |
|
6 |
Na2S |
0,11 |
AgF |
|
7 |
CuSO4 |
0,63 |
KF |
|
8 |
Cs3PO4 |
0,14 |
CH3COOAg |
|
9 |
Bi(NO3)3 |
0,08 |
NaBO2 |
|
10 |
Na3AsO4 |
0,15 |
NH4F |
|
11 |
ZnCl2 |
0,71 |
CH3COOLi |
|
12 |
K3PO4 |
0,22 |
NH4Br |
|
13 |
CdBr2 |
0,35 |
RbCN |
|
14 |
K2S |
0,1 |
NH4NO2 |
|
15 |
AlCl3 |
0,54 |
NaOCl |
|
16 |
Na2SiO3 |
0,18 |
NH4BO2 |
|
17 |
Ni(NO3)2 |
0,45 |
KIO |
|
18 |
Li2S |
0,61 |
(NH4)2SO4 |
|
19 |
Fe2(SO4)3 |
0,09 |
LiNO2 |
|
20 |
Li2CO3 |
0,15 |
NH4CN |
|
21 |
Cu(NO3)2 |
0,27 |
(CH3COO)2Ca |
|
22 |
K3BO3 |
0,07 |
AgNO3 |
|
23 |
PbCl2 |
0,36 |
NaIO |
|
24 |
Na2SO3 |
0,18 |
NH4ClO4 |
|
25 |
Cr2(SO4)3 |
0,45 |
Ba(NO2)2 |
|
26 |
Li2CrO4 |
0,12 |
NH4OCN |
|
27 |
Al(NO3)3 |
0,34 |
NaCN |
|
28 |
K3AsO4 |
0,16 |
AgClO4 |
|
29 |
MnBr2 |
0,62 |
CH3COORb |
Продолжение табл. 3.5
|
30 |
Rb2S |
0,06 |
NH4I |
|
31 |
Na3AsO4 |
0,11 |
NH4F |
|
32 |
ZnCl2 |
0,70 |
CH3COOLi |
|
33 |
K3PO4 |
0,23 |
NH4Br |
|
34 |
CdBr2 |
0,34 |
RbCN |
|
35 |
K2S |
0,13 |
NH4NO2 |
|
36 |
AlCl3 |
0,34 |
NaOCl |
|
37 |
Na2SiO3 |
0,12 |
NH4BO2 |
|
38 |
Ni(NO3)2 |
0,44 |
KIO |
|
39 |
Li2S |
0,62 |
(NH4)2SO4 |
|
40 |
Fe2(SO4)3 |
0,07 |
LiNO2 |
|
41 |
Li2CO3 |
0,35 |
NH4CN |
|
42 |
Cu(NO3)2 |
0,23 |
(CH3COO)2Ca |
|
43 |
K3BO3 |
0,04 |
AgNO3 |
|
44 |
PbCl2 |
0,38 |
NaIO |
|
45 |
Na2SO3 |
0,12 |
NH4ClO4 |
|
46 |
Cr2(SO4)3 |
0,41 |
Ba(NO2)2 |
|
47 |
Li2CrO4 |
0,18 |
NH4OCN |
|
48 |
Al(NO3)3 |
0,33 |
NaCN |
|
49 |
K3AsO4 |
0,11 |
AgClO4 |
|
50 |
MnBr2 |
0,65 |
CH3COORb |
