
- •Министерство образования и науки украины
- •Содержание
- •Введение
- •Варианты контрольных заданий для расчетно-графической работы
- •План выполнения расчетно – графической работы
- •Пример выполнения индивидуального задания
- •1. Характеристика объекта исследования.
- •2. Расчет водородного показателя воды
- •2.1. Теоретическая часть
- •Расчет рН растворов сильных и слабых электролитов
- •Сильные электролиты
- •Константы диссоциации слабых кислот и оснований при 25 оС
- •3. Гидролиз солей
- •3.1. Теоретическая часть
- •3.2. Примеры решения индивидуального задания
- •Решение
- •Решение
- •3.3. Индивидуальные задания
- •Состав солей исследуемой воды
- •4. Расчет показателей жесткости воды
- •4.1. Теоретическая часть
- •4.2. Пример решения индивидуального задания
- •Решение
- •Показатели жесткости исследуемой воды
- •4.3 Индивидуальные задания
- •Состав исследуемой воды
- •5. Расчет дозы реагентов для умягчения исследуемой воды
- •5.1. Теоретическая часть
- •5.2. Пример решения индивидуального задания
- •Значения коэффициента Стьюдента
- •6.2. Пример решения индивидуального задания
- •Решение
- •0,146 Г содержится в 100 см3
- •6.3. Индивидуальные задания
- •Содержание взвешенных веществ в исследуемой воде
- •7. Расчетное задание по оценке качества питьевой воды
- •7.1. Теоретическая часть
- •7.2. Пример решения индивидуального задания
- •Состав исследуемой воды
- •Решение
- •Соответствует гСанПиН
- •Содержание главных ионов в воде
- •7.3. Индивидуальные задания
- •8. Графическое выражение результатов анализа воды
- •8.1. Теоретическая часть
- •Состав исследуемой воды
- •8.2. Пример решения индивидуального задания
- •Содержание главных ионов в воде
- •Решение
- •Состав исследуемой воды
- •Гипотетический состав солей
- •8.3. Индивидуальные задания
- •Состав исследуемой воды
- •9. 2. Расчет содержания карбонатных ионов в воде
- •9.1. Теоретическая часть
- •Пример решения индивидуального задания
- •Оценка стабильности воды
- •10.3. Пример решения индивидуального задания
- •Решение
- •10.3. Индивидуальные задания
- •Состав исследуемой воды
- •11. Расчетно - графическое определение величины хлорпоглощаемости воды
- •11.1 Теоретическая часть
- •11.2. Пример решения индивидуального задания
- •Решение
- •Результаты пробного хлорирования воды
- •11.3. Индивидуальные задания
- •Результаты хлорирования воды
- •Литература
Оценка стабильности воды
|
Показатель стабиль- ности |
Индекс стабильности (индекс Ланжелье) |
Характеристика стабильности воды |
Стабилизационная обработка воды |
|
С = 1 Свсп.=1 |
J = 0 (±0,25 – 0,3) рНисх. = рНs |
Вода стабильна [СО2]исх. =[СО2 ]равн. |
- |
|
С > 1 Свсп. > 1 |
J > 0 рНисх. > рНs |
Вода нестабильная. Склонна к карбонатным отложениям. [СО2]исх.<[СО2 ]равн. |
Насыщение углекислым газом (рекарбонизация). Обработка кислотами (сульфатной, хлоридной): NаНСО3 +НСl = NaCl+ H2O+CO2 Обработка гексаметафосфатом Na6Р6О18, или фосфатом натрия Na3РО4. |
|
С < 1 Свсп. < 1 |
J < 0 рНисх. < рНs |
Вода нестабильная. Агрессивная по отношению к цементу и бетону. [СО2 ]исх.>[СО2 ]равн. |
Обработка щелочными реагентами: - известью: Са(ОН)2 + 2 СО2 = Са(НСО3)2 - гидроксидом натрия: NаОН + СО2 = NаНСО3 - карбонатом натрия: Nа2СО3+СО2 + Н2О= 2 NаНСО3 |
10.3. Пример решения индивидуального задания
Пример.
Условия заданий:
1). Рассчитать индекс насыщения воды следующего состава: температура воды – 10оС, рН = 7,1, концентрация иона кальция – 80 мг/дм3, общая щелочность – 6,8 мг-экв/ дм3, общее солесодержание – 0,8 г/ дм3;
2). Оценить стабильность исследуемой воды;
3). Рекомендовать метод стабилизационной обработки.
Решение
При отсутствии данных технологических анализов стабильность воды допускается определять по индексу насыщения карбонатом кальция (индекс Ланжелье J) по формуле:
J = pHисх. - рНs
где: J - индекс Ланжелье; pHисх. — опытное значение рН исходной воды;
pHs — значение рН в условиях насыщения воды карбонатом кальция, рассчитывают на основании данных анализа воды по формуле:
pHs = f1(tо) - f2(Ca2+) - f3(Щ) + f4(Р)
где: f1, f2, f3, f4 — значения функций: f1 – температура воды; f2 - содержание Са2+; f3 – показатель щелочности (Щ); f4 - общее солесодержание (Р) в воде.
Значения функций определяют по номограмме (рис. 5). На четырех шкалах номограммы слева отложены температура воды (t,оС), щелочность (Щ, мг-экв/дм3), концентрация кальция (Са2+, мг/дм3), общее солесодержание (Р, г/дм3); справа функции этих величин.
1). Определяем значение f1. По номограмме (рис. 5) на шкале температуры напротив точки - 10оС определяем соответствующее значение коэффициента f1 = 2,35.
2). Определяем значение f2. По номограмме (рис. 5) на шкале «содержание Са2+, мг/дм3» отмечаем точку - 80 мг/дм3 и определяем соответствующее значение коэффициента f2 = 1,9.
3). Определяем значение f3. По номограмме (рис. 5) на шкале «общая щелочность, мг - экв/дм3» отмечаем точку – 6,8 мг - экв/дм3 и определяем соответствующее значение коэффициента f3 = 1,84.
4). Определяем значение f4. По номограмме (рис. 5) на шкале «общее солесодержание, мг/дм3» отмечаем точку – 0,80 г/дм3 и определяем соответствующее значение коэффициента f4 = 8,94.
5). Рассчитываем значение pHs:
pHs = f1(tо) + f2(Ca2+) - f3(Щ) + f4(Р) = 2,35 – 1,9 – 1,84 + 8,94 = 7,55
6). Индекс стабильности вычисляем по формуле:
J = pHисх. - pHs = 7,1 – 7,55 = - 0,45 < 0
где: рНисх..— значение рН исходной воды; pHs — рассчитанный по номограмме (рис. 5) водородный показатель в условиях насыщения воды карбонатом кальция.
7). Заключение о стабильности исследуемой воды выполняем в соответствии с табл. 10.15.
Заключение: J < 0, вода агрессивна по отношению к цементу и бетону. Содержание свободной углекислоты превышает равновесную концентрацию. Требуется проводить стабилизационную обработку исследуемой воды щелочными реагентами:
- известью:
Са(ОН)2 + 2 СО2 = Са(НСО3)2
- гидроксидом натрия:
NаОН + СО2 = NаНСО3
- карбонатом натрия:
Nа2СО3+СО2 + Н2О= 2 NаНСО3
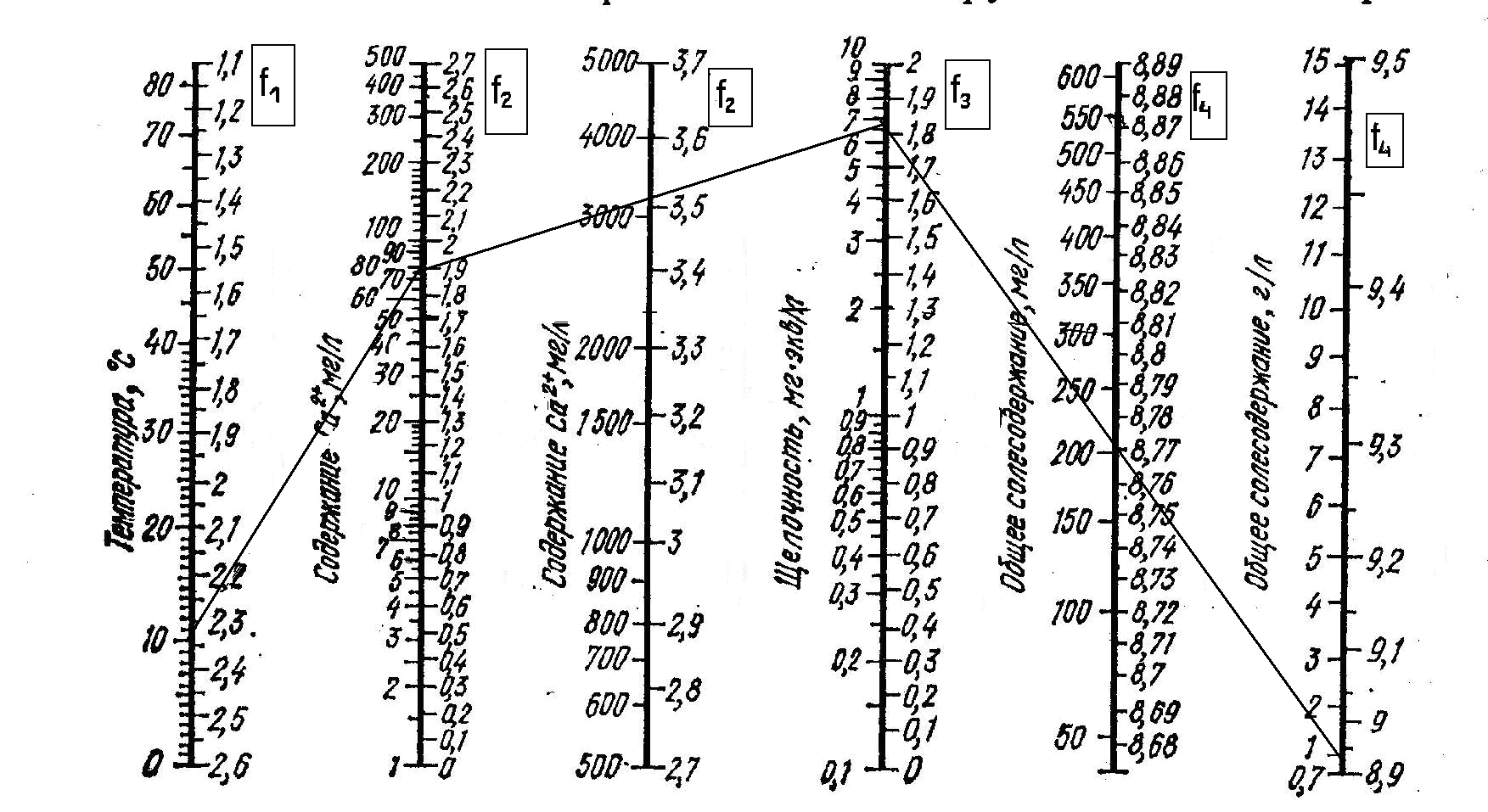
Рис. 5. Номограмма для расчета величины рНs
