
военная мед фотки и методички / Токсикол
.pdf
171
Рисунок 2. Схема, иллюстрирующая совместное действие механизмов, влияющих на почечную экскрецию
О механизмах, лежащих в основе выведения ксенобиотиков через почки, можно судить и по соотношению их концентраций в моче и плазме крови. Если это соотношение близко 100 - в основе процесса лежит фильтрация; если существенно меньше 100 - фильтрации сопутствует реабсорбция значительной части токсиканта; если больше 100 - превалируют механизмы секреции ксенобиотика (таблица 3).
Таблица 3. Соотношение концентраций в моче и плазме крови (моча/плазма) некоторых органических соединений
|
|
Вещество |
Моча/плазма |
Алифатические углеводороды |
0,07 - 0,09 |
Хлорированные углеводороды |
0,1 - 1,0 |
Кетоны |
1,0 - 1,3 |
Алифатические спирты |
1,0 - 1,3 |
Гликоли |
3,0 - 5,0 |
Эфиры полигликолей |
40 - 70 |
Динитро-о-крезол |
0,2 |
Трихлоруксусная кислота |
3,0 |
Конъюгированные фенолы |
300 |
3. Выделение печенью
Вотношении ксенобиотиков, попавших в кровоток, печень выступает и как орган экскреции и как основной орган их метаболизма. Печень выделяет химические вещества в желчь, причем не только экзогенные, но и эндогенные, такие как желчные кислоты, желчные пигменты, электролиты.
Выделяющиеся вещества должны проходить через барьер, образуемый эндотелием печеночных синусов, базальной мембраной и гепатоцитами. Структура барьера более подробно рассмотрена ранее.
Впроцессе экскреции ксенобиотиков осуществляется в два этапа:
-захват гепатоцитами;
-выделение в желчь.
Оба этапа могу проходить либо в форме простой диффузии, либо активного транспорта. Механизм выделения определяется строением вещества:
1.Захват гепатоцитами. А. Диффузия:
- липофильные молекулы.
Б. Система активного транспорта:
- желчные кислоты и соединения с близким строением (фаллотоксин); - билирубин; - органические анионы (варфарин, оротовая кислота, рифампицин);
- органические катионы (четвертичные соединения азота, прокаинамид); - нейтральные органические молекулы (оуабаин, стероидные гормоны); - металлы (железо, кадмий).
В. Пиноцитоз:
- макромолекулы, протеины;
2.Билиарная экскреция.
А. Диффузия:
- неорганические ионы.
Б. Система активного транспорта:
-желчные кислоты;
-органические анионы;
а) без биотрансформации: - хлортиозид и др.
б) после конъюгации:
-билирубин, стероиды, гексахлорфенол и др.
-органические анионы (тубокурарин);
-нейтральные органические соединения (оуабаин, моносахариды). 3. Пиноцитоз:
-макромолекулы, белки.
Свободная диффузия веществ, связанных с белками плазмы крови, практически не возможна. Напротив, путем активного захвата (пиноцитоза) из плазмы могут удаляться и связанные с белками вещества.
Ксенобиотики, попавшие в гепатоциты, отчасти определяются в цитозоле, отчасти - в отдельных субклеточных фракциях. Как известно в печени осуществляется метаболизм многих веществ. Именно они, прежде всего, и фиксируются различными протоплазматическими структурами. Часть соединений, в том числе и эндогенных (билирубин), находится в цитозоле в связанной с белками форме, что также имеет значение для их элиминации и детоксикации. Гепатоциты синтезируют специальные белки, ответственные за выведение ксенобиотиков из клеток, это так называемые мультиспецифичные переносчики органических анионов (MRP) и р-гликопротеины (P-gp). Оба типа белков первоначально были обнаружены в клетках резистентных к токсическому действию противоопухолевых препаратов. Позже было установлено, что их функция - активный транспорт ксенобиотиков через клеточные мембраны. MRP способны переносить

172
лиганды, конъюгированные с глутатионом, глукуроновой кислотой, сульфатом. Таким образом, ll фаза метаболизма не только превращает вещества в более растворимые в воде, но и "подготавливает" к активному транспорту за пределы клетки. P-gp транспортируют в основном жирорастворимые ароматические соединения с молекулярной массой 300 - 500 дальтон и амфифильные молекулы, содержащие катионную аминогруппу.
В желчи в том или ином количестве обнаруживаются вещества, относящиеся практически ко всем классам химических соединений. В соответствии со значением коэффициента СЖ/СП (СЖ - концентрация в желчи; СП - концентрация в плазме крови) ксенобиотики могут быть разделены на три группы.
Вещества, выделяющиеся печенью путем простой диффузии, могут оказаться в желчи лишь в концентрации, равной его концентрации в плазме крови (СЖ = СП). Так, для ионов Na+, K+, Cl- коэффициент СЖ/СП приблизительно равен 1,0.
Для веществ, попадающих в гепатоцит, а затем и в желчь, с помощью механизмов активного транспорта, коэффициент может быть существенно выше 1,0. Как правило, активно выделяются печенью амфифильные вещества, содержащие в молекуле как полярные, так и неполярные группы. У некоторых соединений, нашедших применение в клинической практике, значение коэффициента очень велико (прокаинамид-этобромид - 118, хинин - 19,7). Из веществ, активно секретируемых в желчь, наиболее изученным является бромсульфолеин. У крыс при введении в дозе 5 мг/кг лишь 10% сохраняется в плазме крови, а 90% переходит в ткани, из них 80% - в печень, с последующим выделением в желчь.
Наконец, некоторые химические вещества плохо проникают в гепатоциты и желчь. Для них коэффициент СЖ/СП меньше 1,0. Среди таковых - макромолекулы, например, инсулин, фосфолипиды, белки.
Молекулярная масса соединения является важнейшим фактором, определяющим путь его элиминации. Существует порог, ниже которого располагаются вещества, выделяющиеся преимущественно через почки, выше - через печень. Значение порога достаточно условно, поскольку неодинаково у представителей различных видов: у крыс - 325 дальтон, у морских свинок - 400, у кроликов - 475, 500 - 700 - у человека. Кроме того, преимущественно через почки выделяются вещества, хорошо растворяющиеся в воде, даже с молекулярной массой выше "пороговых" значений (таблица 4).
Таблица 4. Экскреция производных бифенила у крыс
Ксенобиотик |
Мол. масса |
Моча (%) |
Кал (%) |
Бифенил |
154 |
80 |
20 |
4-монохлорбифенил |
188 |
50 |
50 |
4,4-дихлорбифенил |
223 |
34 |
66 |
2,4,5,2,5-петахлорбифенил |
326 |
11 |
89 |
2,3,6,2,3,6-гексахлорбифенил |
361 |
1 |
99 |
(Hodgson E., Guthrie F.E., 1980)
Попавшие в желчь вещества увеличивают ее осмотическое давление, что вторично способствует переходу в этот секрет воды и растворенных в ней ионов. Вследствие этого ксенобиотики, активно выделяющиеся в желчь, в той или иной степени обладают желчегонным действием.
Печеночный клиаренс определяется как:
Cl = Fhep (Ca - Cv)/Ca, где
Ca - концентрация веществ в крови печеночной артерии и портальной вены; Cv - концентрация веществ в крови печеночной вены;
Fhep - интенсивность печеночного кровотока (мл/мин).
Если захват вещества гепатоцитами осуществляется с большой скоростью, то клиаренс пропорционален скорости печеночного кровотока. Эта величина в норме у человека составляет около 1 мл/мин на г печеночной ткани.
Скорость выведения некоторых веществ в желчь весьма велика. Например период полувыведения бенз(а)пирена печенью крыс после внутривенного введения составляет около 1,7 минуты, т.е. в течение 5 минут выделяется около 60% от введенной дозы. Однако это совсем не означает, что с такой же скоростью вещество выводятся из организма. Дело в том, что если с желчью выделяется липофильное соединение, то
впросвете кишечника, оно подвергается быстрой обратной резорбции и по системе портальной вены вновь поступает в печень - развивается "внутрипеченочная циркуляция" ксенобиотика. Поэтому жирорастворимые вещества (в том числе и бенз(а)пирен) надолго задерживаются в организме. Их элиминация возможна лишь
врезультате биотрансформации в той же печени и/или других органах (см. выше). Таким образом, путем билиарной экскреции из организма с калом могут выделяться только плохо растворимые в жирах соединения.
4.Выделение через кишечник
С экскрементами вещество или его метаболит выделяются в следующих случаях: а) в результате неполного всасывания в желудочно-кишечном тракте; б) в результате билиарной экскреции без последующей реабсорбции в кишечнике; в) в результате выделения слизистой желудочно-кишечного тракта.
Упомянутые обстоятельства могут складываться изолированно, либо действовать в комплексе.
Под интестинальной экскрецией понимают процесс перехода вещества или его метаболитов из крови в просвет кишечника с последующим выделением с фекалиями.
Некоторые вещества выделяются в значительном количестве уже в желудке (морфин, некоторые другие алкалоиды). Это наблюдается даже при парентеральном способе введения указанных соединений и является следствием значительного различия рН крови и содержимого желудка (см. выше). Токсиканты, способные выделяться в просвет желудка, в кислой среде находятся исключительно в протонированной форме и потому не всасываются обратно в кровь. Однако если при переходе в кишечник (щелочная среда),
173
выделившееся вещество вновь превращается в неионизированную форму, оно всасывается обратно в кровь и не выделяется из организма. Промывание желудка в подобных ситуациях может оказаться весьма полезной процедурой, позволяющей существенно ускорить удаление токсиканта из организма.
Жирорастворимые вещества могут выделяться в просвет кишечника путем простой диффузии, однако вследствие реабсорбции, их концентрация при этом не будет превышать концентрацию в плазме крови. Тем не менее, сравнение в эксперименте интенсивности выделения жирорастворимых веществ почками и кишечником показывает, что преобладает кишечная экскреция.
Некоторые соединения, например моночетвертичные азотсодержащие вещества (N-метилскополамин, N-метилникотинамид, тетраэтиламмоний и т.д.) после внутривенного введения экспериментальному животному обнаруживаются в просвете кишечника.
Выделение с калом характерно для тяжелых металлов. Особенности и механизмы процесса до конца не изучены. Не исключено, что экскретируются элементы в связанной с белками форме. Выведение свинца, например, существенно увеличивается при увеличении в рационе белковых продуктов.
5. Другие пути выведения Некоторое практическое значение имеет выведение веществ с молоком кормящих матерей и секретом
потовых, сальных, слюнных желез. Как правило, в основе появления токсиканта в секрете желез лежит механизм простой диффузии. Эти способы экскреции практически не сказываются на продолжительности нахождения веществ в организме, но могут лежать в основе появления отдельных признаков интоксикации (угреобразная сыпь при отравлении полигалогенированными полициклическими углеводородами; свинцовая кайма на деснах). Возможно отравление новорожденных, питающихся молоком матери, кантаминированным такими веществами как кофеин, алкоголь, витамины, гормональные препараты, галогенсодержащие инсектициды, металлы и т.д.
Элиминация ксенобиотиков в молоко зависит от степени их персистентности в организме. Быстро элиминируемые, хорошо растворимые в воде ксенобиотики таким путем практически не выделяются. Жирорастворимые соединения с большим периодом полувыведения определяются в молоке порой в значительных количествах. Так в эксперименте установлено, что элиминация хлорсодержащих инсектицидов в коровье молоко может составлять до 25% от введенного количества.

174
ГЛАВА 4.6. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ТОКСИКОКИНЕТИКИ Важнейшим этапом изучения токсикокинетики ксенобиотика является определение количественных
характеристик процессов резорбции, распределения, элиминации. Методология определения токсикокинетических констант постоянно совершенствуется. Её развитие сопряжено с внедрением в практику исследований новых методов количественного определения веществ в биосредах и развитием математического аппарата анализа данных. Ниже будет представлена характеристика некоторых, наиболее часто встречающихся, методических приемов.
1. Скорость элиминации. Константа скорости элиминации. Время полуэлиминации Как указывалось ранее, в понятие элиминации включаются все процессы, приводящие к снижению
содержания чужеродного вещества в организме. Для количественной характеристики элиминации прибегают к проведению основного (базисного) токсикокинетического эксперимента. В ходе эксперимента внутривенно вводят исследуемое вещество в дозе "Д", а затем определяют в динамике концентрацию вещества "С" в плазме крови. Полученные результаты представляют в графической форме зависимости "С" от времени после введения "t" (рисунок 1). В большинстве случаев зависимость имеет вид экспоненты: временная зависимость 1-го порядка. В соответствии с кинетическим уравнением 1-го порядка имеем:
dC/dt = -КЕС,
т.е. скорость процесса в каждый момент времени пропорциональна концентрации вещества.
Мерой скорости элиминации вещества является величина угла наклона касательной к кривой, проведенной в интересующей исследователя точке, или величина дифференциала dC/dt. Скорость элиминации уменьшается с течением времени, поскольку уменьшается величина C. Однако неизменной характеристикой процесса остается коэффициент пропорциональности КЕ.
Рисунок 1. Зависимость концентрации вещества в плазме крови от времени после внутривенного введения
Интегрируя уравнение, имеем:
lnC0/Ct = KEt , где
C0 - исходная концентрация вещества;
Ct - концентрация вещества в момент времени t; t - время после введения вещества;
KE - константа скорости процесса элиминации;
Для определения КЕ необходимо представить зависимость концентрации вещества в плазме от времени в полулогарифмической системе координат (рисунок 2). При этом зависимость приобретает
линейный характер. Константа элиминации определяется как честное от деления  lnС/
lnС/ t. После определения величины КЕ легко определить еще один важный токсикокинетический параметр, а именно величину времени полуэлиминации (t1/2), т.е. время в течение которого из организма элиминируется половина введенного вещества. Время полуэлиминации связано простой зависимостью с величиной константы скорости элиминации:
t. После определения величины КЕ легко определить еще один важный токсикокинетический параметр, а именно величину времени полуэлиминации (t1/2), т.е. время в течение которого из организма элиминируется половина введенного вещества. Время полуэлиминации связано простой зависимостью с величиной константы скорости элиминации:
t1/2 = ln2/КЕ = 0,693/КЕ

175
Рисунок 2. Зависимость концентрации вещества в плазме крови от времени после внутривенного введения в системе полулогарифмических координат
2. Объем распределения.
Представление зависимости концентрации вещества в крови от времени в полулогарифмических координатах (рисунок 2) позволяет расширить информацию об особенностях токсикокинетики вещества, введенного внутривенно.
Начальная концентрация вещества СО в плазме крови не доступна для непосредственного измерения, поскольку необходимо время перемешивания ксенобиотика в крови (этап конвекции). Однако как условная величина СО имеет токсикокинетическое значение. Она может быть определена путем экстраполяции прямой зависимости lnC от времени к моменту t = 0. Значение С0 и величина введенной дозы Д позволяют рассчитать объем распределения вещества Vd до того, как начался процесс элиминации ксенобиотика:
Vd = Д/СО
Отнеся полученную величину к массе тела (М) получаем значение (VR):
VR = Vd/М
Значения относительного объема распределения и времени полуэлиминации некоторых ксенобиотиков представлены в таблице 1.
Таблица 1. Токсикокинетические характеристики некоторых веществ
Вещества |
VК |
t1/2 |
|
(л/кг) |
(ч) |
||
|
|||
Ацетилсалициловая кислота |
0,14 |
0,25 |
|
Пенициллин G |
0,30 |
0,5 |
|
Нитроглицерол |
0,35 |
6,5 |
|
Дигитоксин |
0,50 |
180 |
|
Этанол |
0,55 |
- |
|
Фенобарбитал |
0,80 |
80 |
|
Морфин |
3,0 |
2,5 |
|
Дигоксин |
10,0 |
36 |
|
Хлорпромазин |
20,0 |
40 |
3. Клиаренс Под клиаренсом понимают условный объем плазмы крови (мл), который полностью освобождается от
находящегося в ней ксенобиотика в единицу времени. По Досту (Dost) все процессы, участвующие в элиминации вещества в конечном итоге суммируются и определяют так называемый "общий клиаренс" вещества (Cltot). При этом можно выделить элементы общего клиаренса, обеспечиваемые деятельностью основных органов выведения: почек, печени, легких, и метаболизмом ксенобиотиков, и рассматривать их отдельно как почечный (ClR), печеночный (ClH) и т.д. клиаренс:
Cltot = ClR + ClH + Cl ...
Определение общего клиаренса осуществляется на основе данных, полученных в ходе базисного токсикокинетического эксперимента (см. выше). Для этого по данным, представленным на рисунке 1, определяют величину площади под кривой зависимости "концентрация-время" (ППК). Клиаренс рассчитывают как:
Cltot = Д/ППК
Чем больше площадь под кривой при введенной дозе ксенобиотика, тем ниже значение клиаренса, т.е. тем дольше вещество выводится из организма. Клиаренс через отдельные органы рассчитывают с учетом количества вещества, выделяемого через эти органы. Значения клиаренса некоторых летучих токсикантов представлены в таблице 2.
Таблица 2. Респираторный и метаболический клиаренс некоторых летучих органических растворителей у человека
|
|
|
Растворители |
Респираторный клиаренс |
Метаболический клиаренс |

176
|
л/ч |
% |
л/ч |
% |
Бензол |
43 |
36 |
75 |
64 |
Толуол |
22 |
18 |
100 |
82 |
Ксилол |
13 |
10 |
116 |
90 |
Стирол |
6 |
4 |
157 |
96 |
Дихлорметан |
35 |
18 |
157 |
96 |
Хлороформ |
33 |
23 |
108 |
77 |
Четыреххлористый углерод |
140 |
93 |
11 |
7 |
1,1-дихлорэтан |
72 |
41 |
105 |
59 |
1,2-дихлорэтан |
17 |
12 |
130 |
88 |
1,1,1-трихлорэтан |
102 |
97 |
3 |
3 |
1,1,2-трихлорэтан |
9 |
7 |
116 |
93 |
1,1,1,2-тетрахлоэтан |
11 |
20 |
45 |
80 |
1,1,2,2,-тетрахлорэтан |
3 |
4 |
73 |
96 |
Трихлорэтилен |
36 |
25 |
104 |
75 |
Тетрахлорэтилен |
26 |
90 |
3 |
10 |
(A. Sato, T. Nakajima, 1987)
На принципе определения величины ППК основывается расчет и другой токсикокинетической характеристики вещества - биодоступности.
4. Биодоступность
Под биодоступностью понимают способность вещества, находящегося в определенном агрегатном состоянии и связи с инертными носителями (почва, пища, растворитель и т.д.), абсорбироватся во внутренние среды организма и достигать места взаимодействия с системамимишенями.
Поскольку место действия для подавляющего большинства токсикантов не определено, или недоступно для экспериментального анализа, принято допущение, согласно которому содержание вещества в крови линейно связано с величиной его биодоступности.
В соответствии с принципом Доста мерой биодоступности вещества в водимой дозе может являться величина ППК, которая не зависит от временных характеристик процесса резорбции. Чем больше ППК вещества при различных способах введения, тем выше его биодоступность, тем более выражено действие данного ксенобиотика на организм. Сравнение ППК при внутривенном способе и иных способах аппликации (например, ингаляционном, трансдермальном и т.д.) позволяет определить квоту резорбции токсиканта через различные "входные ворота" - частный случай характеристики биодоступности:
QR = ППКинг/ППКв/в и т.д.
Фракция (F) апплицированной дозы вещества (в конкретном примере равна QR) определяет то количество действующего агента, которое достигло общего кровотока. При иных, кроме внутривенного, способах введения ксенобиотиков F < 1. В основе этого лежат неполная абсорбция вещества или/и его метаболизм в органах поступления (коже, легких, кишечнике, печени).
При поступлении вещества через рот следует выделять несколько фракций токсиканта в крови: FG - фракция токсиканта в крови портальной системы;
FL - фракция токсиканта экстрагируемая печенью;
F - фракция токсиканта, попавшая в общий кровоток. Причем:
F = FG (1 - FL)
Так, если 80% вещества достигает портальной системы, а 30% при этом еще и экстрагируется печенью, то общего кровотока достигает: F = 0,8 0,7 = 0,56, т.е. 56% от введенного количества.
Однако в таком прочтении величина биодоступности не может в полной мере отражать последствия действия токсиканта на организм. Дело в том, что ППК при разных способах воздействия может быть одинаковой, но различная скорость поступления и одновременно протекающая элиминация соединения могут привести к совершенно разным эффектам одного и того же вещества. Пример такой ситуации приведен на рисунке 3.

177
Рисунок 3. Кривые динамики концентрации вещества Д в плазме крови экспериментального животного при различных способах воздействия:
N1 - внутривенное введение
N2 - введение через желудочно-кишечный тракт
N3 - введение через желудочно-кишечный тракт в форме, адсорбированной на ионно-обменной смоле Как показано на рисунке, площадь под кривыми 1, 2, 3 после воздействия вещества в дозе Д
различными способами практически одинакова, однако формирующиеся эффекты различны.
5. Соотношение между значениями клиаренса, объема распределения и времени полувыведения вещества
Клиаренс - характеристика скорости элиминации ксенобиотика. Независимой от клиаренса является величина объема распределения. Она определяется способностью веществ растворяться в воде, липидах, связываться с биосубстратом. Сильное связывание молекул токсиканта тканями приводит, при расчетах, к большим значениям Vd. Период полувыведения является функцией объема распределения и скорости элиминации:
t1/2 = ln2 Vd/Cltot
Из уравнения следует, что чем больше объем распределения при одном и том же значении клиаренса, тем дольше выводится вещество из организма. Усиление клиаренса сокращает период полувыведения.
Клиаренс может быть определен, как произведение константы элиминации на объем распределения:
Cltot = KE Vd = ln2 Vd/t1/2
При оценке полученных результатов необходимо иметь в виду, что в реальных условиях ни константа элиминации ни объем распределения не являются в полной мере величинами независимыми от времени после введения препарата.
6. Компартменты Под компартментом в количественной токсикокинетике понимают некий гипотетический объем жидкости
организма, в котором, в соответствии с едиными количественными характеристиками, "растворяется" вещество, поступившее во внутренние среды. Токсикокинетические компартменты не имеют ни анатомических, ни физиологических эквивалентов. В зависимости от желания исследователя можно представить организм в виде одного, двух, нескольких, многих компартментов и на основе этого представления произвести расчет интересующих токсикокинетических констант.
При определении и расчетах упомянутых в предыдущих разделах характеристик исходили из представления о наличии в организме лишь одного компартмента равного по величине Vd. Реально в организме существует множество сред с различными свойствами и неодинаковой способностью связывать вещества. Желание экспериментаторов учесть эти особенности привели к созданию многокомпартментных математических моделей описания токсикокинетики соединений (рисунок 4). Однако в настоящее время нет возможности доказать, что двух- , трех-, наконец многокомпартментные модели более корректны, чем однокомпартментная, так как с биологических позиций они все же не физиологичны. Поэтому полагают, что любая математическая модель в принципе без большого ущерба может быть редуцирована до двухкомпратментной (водная фаза - липидная фаза) модели, а на практике по-прежнему наиболее часто используемой является однокомпартментная модель описания поведения вещества в организме.

178
Рисунок 4. Токсикокинетические модели: ka - константа скорости абсорбции;
ke - константа скорости элиминации;
k1 3 - константы скорости движения веществ между компартментами 6.1. Однокомпартментная модель
При описании токсикокинетических процессов с помощью этой модели исходят из допущения, что вещество, попав в организм, полностью распределяется в едином пространстве, равном по величине объему распределения (Vd). Хотя такая модель достаточно груба для реальных процессов, происходящих в организме, она позволяет дать количественные характеристики, необходимые для описания свойств токсиканта. Эта модель получила самое широкое распространение в практике токсикологических исследований и используется значительно чаще, чем любая другая. Ниже приведены примеры её использования для описания нескольких ситуаций.
6.1.1. Моделирование поведения ксенобиотика при однократном внутривенном введении В этой модели делается допущение, что вещество, быстро введенное внутривенно, мгновенно и
равномерно распределяется в жидкостях и тканях организма. Под "организмом" понимают некий компартмент с определенным объемом. При этом в единице объема крови содержится количество ксенобиотика, которое отражает его содержание во всем "организме" (объеме). Метаболизм вещества не учитывается, а выведение рассматривается, как процесс, подчиняющийся закону кинетики 1-го порядка (скорость выведения определяется концентрацией вещества в крови: v = f(С)). Это позволяет
предположить:
-b* = KЕb и bt = b0 e-Kеt , где
b* - изменение содержания вещества в крови;
b0 - содержание вещества в крови в момент времени t = 0 (т.е. величина, равная дозе вещества Д, введенной внутривенно);
bt - содержание вещества в крови в любое другое время после введения.
Если в качестве органа элиминации выступает только какой-то один орган, например почки, то
количество вещества, ушедшего из крови, должно быть равно количеству, выделившегося с мочой: ut = b0 - bt , или иначе: ut = b0 (1 - e-Ke t).
Течение этих процессов (выделения и снижения содержания в крови) графически представлено на рисунке 5.
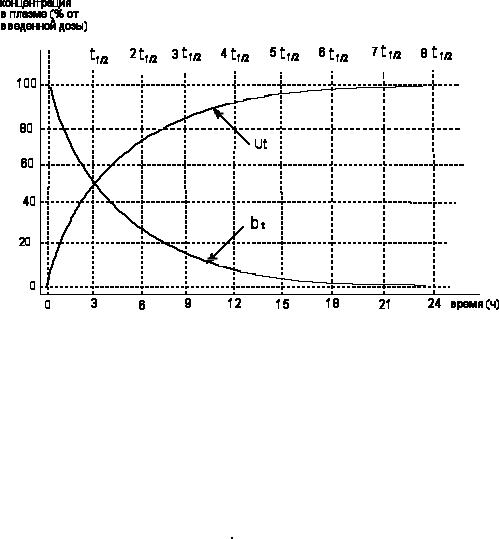
179
Рисунок 5. Однокомпартментная модель: кривая элиминации из крови (bt) и поступления в мочу (Ut) вещества с периодом полувыведения 3 часа (КЕ = 0,23 ч-1)
Для характеристики концентрации вещества в крови справедливо выражения:
Сt = bt/Vd
При переводе данных в систему полулогарифмических координат можно легко определить значение КЕ и С0 (см. выше).
Исходя из дозы, введенного в организм вещества, и его концентрации С0 рассчитывают объем распределения Vd. В связи с тем, что процесс подчиняется кинетике 1-го порядка можно записать:
t1/2 = 0,693/KE
По прошествии времени, равного 5t1/2 в "организме" остается около 3% введенного количества вещества.
Почечный клиаренс рассчитывается как:
ClR = KE Vd
Поскольку - b* = u = KEb, а b = C Vd, имеем: u = ClR C, т.е. клиаренс есть константа пропорциональности между величинами скорости выведения вещества через почки и концентрацией его в плазме крови. Иными словами клиаренс можно представить, как угол наклона прямой зависимости между количеством вещества,
выделившегося в мочу за единицу времени  t (u*) и концентрацией вещества в плазме. 6.1.2. Моделирование поведения ксенобиотика с параллельными путями выведения
t (u*) и концентрацией вещества в плазме. 6.1.2. Моделирование поведения ксенобиотика с параллельными путями выведения
Помимо выведения вещества через почки (u) возможно выведение и другими органами, например печенью (G), что приводит к более быстрому снижению его содержания в крови. Полагают, что оба процесса выведения подчиняются закону кинетики 1-го порядка. При этом КЕ = К1 + К2, где:
b* = - (К1 + К2)b; u* = К1 b; G* = К2 b.
При этом для характеристики количества вещества, выделяющегося с мочой или желчью, имеем:
u0/D = K1/K2 ; G0/D = K2/K1 , где
u0/D - часть введенной дозы вещества, выведенная за исследуемое время через почки; G0/D - часть введенной дозы вещества, выведенная за исследуемое время через печень.
Т.е. соотношение количества вещества, выделяющегося различными путями пропорционально константам скоростей элиминации через эти органы:
Cltot = ClH + ClR
6.1.3. Моделирование поведения ксенобиотика полностью резорбирующегося из места введения Как правило, токсикант поступает в организм не путем внутривенного введения, а в результате
резорбции через легкие, кожу, желудочно-кишечный тракт, из подкожного или внутримышечного депо. При моделировании поведения ксенобиотика полагают, что резорбция также есть кинетический процесс первого порядка.
Предположим в момент времени t = 0 вещество в дозе Д быстро попало в депо М и начался процесс его резорбции в кровь с одновременной элиминацией через почки (u).
Все процессы, приводящие к повышению содержания вещества в крови, вследствие выхода его из места депонирования (поступления в организм) можно обозначить как инвазивные и условно объединить их в единый процесс с константой скорости инвазии КА. Напротив, все процессы, приводящие к уменьшению содержания вещества в организме, обозначаются как элиминационные (см. выше) с константой КЕ. Как правило, при воздействии вещества наблюдаются оба процесса.
Динамика концентрации вещества в плазме крови при этом может быть описана функцией Батемана
(Bateman):
Сt = D/Vd KA(KA - KE) (e-Ke t- e-Ka t).
Типичная кривая Батемана представлена на рисунке 6 (для вещества с соотношением КА/КЕ равным 2)
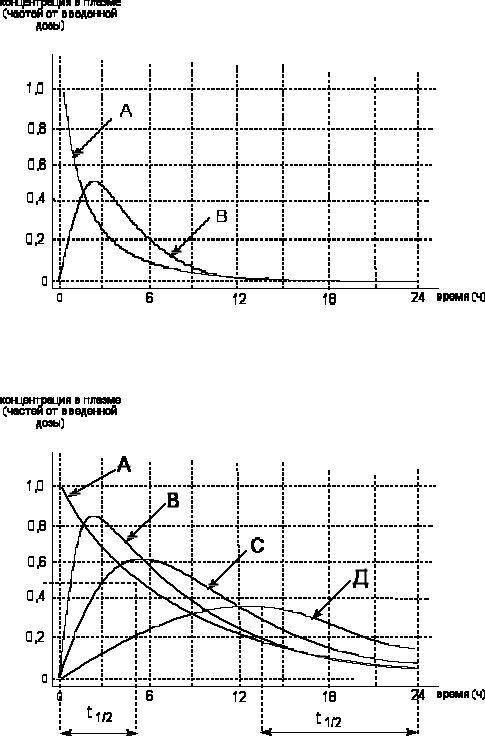
180
Рисунок 6. Динамика концентрации вещества в крови (кривая В) при одновременном течении процессов резорбции и элиминации. Соотношение КА/КЕ равно 2. Кривая А - концентрация вещества в месте аппликации.
На рисунке 7 представлены кривые Батемана для веществ с различными значениями констант скорости инвазивного процесса и одинаковым значением константы скорости элиминации. Все максимумы функций лежат выше кривой, отражающей динамику содержания веществ в крови при их внутривенном введении.
Рисунок 7. Функции Батемана для веществ В, С, Д с различными значениями константы скорости процесса инвазии (В = 2,0; С = 0,5; Д = 0,125 ч-1) при одинаковом значении константы скорости элиминации (0,125 ч-1). Кривая А отражает динамику содержания веществ В, С, Д при их внутривенном введении.
На рисунке также видно, что при одинаковом значении t1/2 элиминации рассматриваемых веществ (кривая А, t1/2 = 5 ч), кажущееся время полувыведения, наблюдаемое при постепенной резорбции токсикантов, существенно отличается от истинного значения и зависит от скорости процесса резорбции. Чем меньше скорость резорбции, тем более выражены различия истинного и кажущегося значений периода полувыведения (для вещества Д t1/2 = 10 часам).
Таким образом, при анализе кривой динамики концентрации вещества в "организме", достаточно корректные данные о скорости элиминации можно получить лишь в тех случаях, когда скорость инвазии вещества значительно превышает скорость элиминации, и лишь в том временном интервале, когда процесс резорбции токсиканта полностью завершен.
6.2. Многокомпартментные модели Однокомпартментная модель не учитывает физиологические особенности организма, поэтому
предположили, что с увеличением числа компартментов, принятых в математической модели кинетики токсиканта, можно улучшить качество описания поведения вещества в организме. Таким образом, в модели
