
военная мед фотки и методички / Токсикол
.pdf
151
Рисунок 6. Кофакторы энзимов l фазы метаболизма ксенобиотиков: (1) цитохромР-450 зависимые оксидазы (Р-450); (2) флавинсодержащие монооксигеназы (ФМО)
Входе микросомального окисления часто образуются реакционноспособные промежуточные продукты. Некоторые из них нестабильны и подвергаются дальнейшему превращению, другие достаточно устойчивы.
Втаблице 3 представлены некоторые примеры биопревращений, приводящих к образованию реактивных продуктов.
Таблица 3. Примеры биотрансформации ксенобиотиков с образованием активных промежуточных продуктов в ходе l фазы метаболизма
Исходное |
Продукт реакции |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
вещество |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлороформ |
фосген |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллиловый спирт |
акролеин |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дихлорэтан |
хлорацетальдегид |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диметил |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
ион метилдиазониума |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
нитрозамин |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гексан |
гександион |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
винилхлорид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
хлорэтиленэпоксид |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бенз(а)пирен |
бензпирендиолэпоксид |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
бензол |
бензохинол |
||||||||||||||||||||||||||||||||||||||||||||||
CCL4 |
CCL3* |
||||||||||||||||||||||||||||||||||||||||||||||
тетрахлор |
тетрахлорметил- |
||||||||||||||||||||||||||||||||||||||||||||||
метан |
радикал |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
р-аминофенол |
р-бензохинонимин |
||||||||||||||||||||||||||||||||||||||||||||||
Класс соединения
ацилгалоген
ненасыщенный
альдегид
альдегид
алкил
диазониум
дикетон
эпоксид
диол эпоксид
хинол
алкильный
радикал
хинонимин
Энзимы
Р-450
алкоголь
дегидрогеназа
Р-450
Р-450
Р-450 алкоголь дегидрогеназа
Р-450
Р-450 эпоксидгидролаза пероксидаза
Р-450 пероксидаза
Р-450
пероксидаза
3.1. Окислительно-восстановительные превращения 3.1.1. Оксидазы смешанной функции
3.1.1.1. ЦитохромР-450-зависимая монооксигеназная система

152
Энзимы рассматриваемой группы, цитохромР-450 зависимые оксидазы (Р-450), как правило, обладают низкой субстратной специфичностью, вызывая превращения веществ самого разного строения, и потому часто называются оксидазами смешенной функции (ОСФ). Р-450 относятся к группе гемопротеинов типа цитохромов b - пигментов, активно связывающих монооксид углерода. Название "цитохромР-450" энзимы получили в силу того, что максимум поглощения света пигментом, связанным с СО, осуществляется при длине волны 450 нм.
Р-450 представляют собой семейство энзимов, локализующихся в эндоплазматическом ретикулуме, которые могут быть разделены с помощью иммунологических и иных методов на несколько подсемейств. Отдельные ткани содержат несколько различных изоформ Р-450. Встречаются тканеспецифичные формы энзимов. Изоферменты Р-450 часто проявляют перекрестную субстратную специфичность, таким образом, как правило, более чем один изофермент принимает участие в метаболизме ксенобиотика. Наличие специфических форм энзимов обусловлено генетическими механизмами, а повышение содержания в тканях различных изоферментов индуцируется действием на организм различных ксенобиотиков: лекарств, ядов, экотоксикантов. Р-450 подвержены не только активации, но и инактивации, как исходными ксенобиотиками, так и их реактивными метаболитами.
Реакции микросомального окисления, протекающие при участии Р-450, как правило, зависят от содержания O2 и НАДФН в среде. Молекулярный кислород активируется цитохромомР-450 (или другими цитохормами, например, Р-448). Активация осуществляется с помощью НАДФН при участии флавинсодержащего энзима НАДФН-цитохромР-450 редуктазы. Поскольку донором электронов в превращениях субстратов, катализируемых этими энзимами, является НАДФН, суммарное уравнение реакции может быть записано следующим образом:
ЦитохромР-450, НАДФН-цитохромР-450 редуктаза и фосфолипиды биологических мембран, в которые встроены оба энзима, образуют микросомальный монооксигеназный комплекс. Несмотря на то, что энзимы комплекса связаны с биологическими мембранами, их свойства могут быть изучены in vitro.
Установлены основные закономерности протекания ферментативных процессов с участием микросомального монооксигеназного комплекса (рисунок 7).
Рисунок 7. Упрощенная схема превращения субстрата при участии Р-450
Как видно из рисунка на начальном этапе ксенобиотик (S) вступает во взаимодействие с окисленной формой цитохромаР-450. Затем к этому комплексу с помощью НАДФН-зависимой цитохромР-450 редуктазы присоединяется электрон, донором которого является восстановленный НАДФН. После этого комплекс взаимодействует с кислородом. После взаимодействия со вторым электроном (донор - НАДФН) происходит активация связанного с цитохромом кислорода, который приобретает способность связывать протоны и образовывать воду. Образовавшаяся при этом форма цитохромаР-450 гидроксилирует субстрат.
Метаболизируемое вещество не связывается непосредственно с геминовой группой цитохромаР-450. Оно присоединяется к белковой части цитохрома. Процесс превращения ксенобиотиков чувствителен к СО, поскольку это вещество вытесняет кислород из связи с железом геминовой группы цитохромаР-450. Некоторые оксидазы резистентны к СО (образование N-оксидов).
Поскольку Р-450 - гемопротеины, их активность отчасти регулируется процессами синтеза гема, т.е. связана с метаболизмом железа. Нарушение метаболизма, голодание, понижение соотношения НАДФН/НАДФ+ могут приводить к снижению активности Р-450.
3.1.1.1.1. Реакции, катализируемые цитохромомР-450
Окисление ксенобиотиков при участии Р-450 - основной механизм их биотрансформации в l фазе метаболизма. Р-450 катализирует окисление практически всех классов органических молекул. Субстратом для энзимов являются и простые молекулы типа хлороформа и стероиды и сложные гетероциклические соединения, например антибиотик циклоспорин. Р-450 могут катализировать не только окисление, но и восстановление некоторых биосубстратов, например четыреххлористого углерода, галотана, некоторых
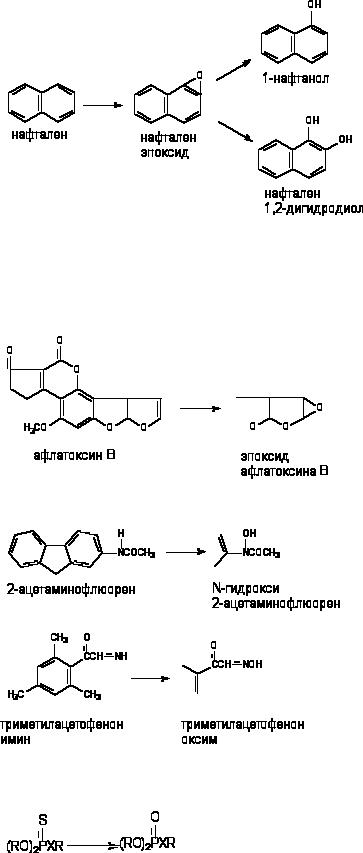
153
других галогенированных углеводородов с образованием свободных радикалов. Такое необычное превращение реализуется в условия пониженного парциального давления кислорода в тканях.
Эпоксидирование и гидроксилирование ароматических соединений.
Метаболизм полициклических и ароматических углеводородов сопровождается образованием реакционно-способных промежуточных продуктов метаболизма, в частности ареноксидов, способных вызывать некроз клеток и являющихся канцерогенами. Таким образом осуществляется, в частности, превращение бенз(а)пирена (см. выше) или нафталена:
Эпоксид, возникающий в процессе метаболизма, может подвергаться неэнзиматическому гидролизу с образованием нафтанола, либо, взаимодействуя с эпоксидгидролазой, превращаться в дигидродиол, а также образовывать конъюгаты с глутатионом, которые выделяются из организма в виде производных меркаптуровой кислоты.
Эпоксидирование алифатических и алициклических соединений.
Многие алифитические и алициклические соединения, содержащие в молекуле непредельные связи метаболизируют с образованием чрезвычайно стабильных эпоксидов (превращение алдрина в диалдрин). Это же превращение лежит в основе образования канцерогенных продуктов метаболизма афлатоксинов:
N-окисление.
Превращению могут подвергаться такие вещества, как анилин и его производные, ацетаминофлюорен и др. В результате окисления атома азота могут образовываться гидроксиламины, оксимы и N-оксиды:
Оксимы образуются в процессе гидроксилирования иминов или первичных аминов:
Десульфурирование и расщепление эфиров.
Фосфоротиоаты (1) и фосфородитиоаты (2), являющиеся представителями большой группы инсектицидов, приобретают способность угнетать активность ацетилхолинэстеразы (за счет этого реализуется их биологическая активность) в результате ферментативного преобразования соединений:

154
Х = О (1); Х = S (2).
Процесс разрушения эфирных связей при атоме фосфора ФОС также во многом обусловлен действием Р-450, хотя процесс может идти и при участии гидролитических энзимов.
Оксилительное деалкилирование.
Классическим примером превращения данного типа является О-деалкилирование р-нитроанизола. Поскольку продукт превращения легко определяется, реакцию нередко используют для оценки активности Р-450:
Другим примером может служить метаболизм инсектицида этоксихлора:
В результате деятельности монооксигеназ возможно и N-деалкилирование ксенобитиков:
Окисление тиоэфиров.
При участии цитохромаР-450 и других монооксигеназ происходит окисление тиоэфирных связей, в молекулах таких ксенобиотиков как хлорпромазин, альдикарб, метиокарб и др. Этот вид превращения характерен также для метаболизма сернистого иприта:
Установлено, что при этом токсичность вещества возрастает (сульфон иприта токсичнее исходного вещества).
3.1.1.2. Флавинсодержащие монооксигеназы (ФМО)
Флавинсодержащие монооксигеназы (ФМО) также локализуются в эндоплазматическом ретикулуме. В отличии от Р-450, ФМО встречается в тканях в форме одного, свойственного виду, энзима, не подвергающегося индукции. ФМО, получая электрон непосредственно от НАДФН, окисляет ксенобиотики лишь определенного строения, главным образом азотсодержащие вещества основного характера (гидразины, ариламины) и тиокарбамильные соединения (тиоацетамид и т.д.). Примеры некоторых превращений представлены на рисунке 8. Многие из субстратов ФМО одновременно являются субстратами и Р-450.

155
Рисунок 8. Превращение ксенобиотиков при участии флавинмонооксигеназ 3.1.2. Простогландинсинтетаза-гидропероксидаза и другие пероксидазы
Обширная группа пероксидаз участвует в разрушении перекиси водорода и других перекисей, превращая их в воду и спирты. В ходе этих реакций возникают побочные продукты, обладающие окислительными свойствами, способные взаимодействовать с различными химическими веществами, такими как ароматические амины, фенолы, гидрохиноны, алкены, полициклические ароматические углеводороды:
Например, лейкоцитарная пероксидаза, пероксидаза эозинофилов разрушают перекись водорода, продуцируемую в легких клетками крови при их контакте с кислородом. Поэтому эти энзимы могут участвовать в биопревращении чужеродных веществ в легких.
Простогландинсинтетаза активирует образование простогландинов (гидроперекисей жирных кислот) из арахидоновой кислоты. В ходе последующего восстановления гидроперекисей окисляются другие субстраты и среди них ксенобиотики, содержащиеся в тканях. Такой механизм окисления веществ называется кооксидация. В ходе процесса потребляется арахидоновая кислота и ксенобиотики, а продуцируются простогландины и окисленные формы этих ксенобиотиков. Широкое распространение ПГС в тканях млекопитающих позволяет предположить, что этот механизм может лежать в основе целого ряда реакций биопревращения чужеродных соединений, особенно в тканях с низкой активностью Р-450, например, мозговом слое почек, эндотелии мочевого пузыря и т.д.
3.1.3. Дегидрогеназы Помимо микросом, энзимы, участвующие в окислении ксенобиотиков, выявляются также в
митохондриях и растворимой фазе цитозоля. Процесс дегидрирования ксенобиотиков проходит в организме чаще в форме гидроксилирования. Среди прочих веществ такому превращению подвергаются многочисленные спирты и альдегиды при участии алкоголь- и альдегиддегидрогеназ. Благодаря высокой активности этих энзимов, печень - основной орган метаболизма спиртов. Энзимы идентифицированы также в почках и легких.
НАД-зависимая алкогольдегидрогеназа печени обладает невысокой субстратной специфичностью. Так, под влиянием этого энзима метаболизируют не только первичные и вторичные алифатические спирты, но и ароматические спирты, а также такие соединения, как р-нитробензиловый спирт и т.д. В результате окисления образуются соответствующие альдегиды:
Алкогольдегидрогеназа существует в множественной форме с перекрестной субстратной специфичностью. Ее активность индуцируется этанолом и угнетается альдегидами.
В превращении альдегидов в соответствующие кислоты принимает участие НАД-зависимые альдегиддегидрогеназы. Специфическая формальдегиддегидрогеназа в качестве кофактора использует еще и восстановленный глутатион. В организме грызунов (мыши, крысы, кролики) метаболизм некоторых альдегидов (например, превращение хлоралгидрата в трихлоруксусную кислоту) проходит при участии альдегиддегидрогеназ с иными свойствами.
Среди веществ, метаболизируемых при участии рассматриваемых энзимов наибольшее токсикологическое значение имеют метанол, этиленгликоль, аллиловый спирт. В процессе метаболизма этих веществ образуются высоко токсичные промежуточные (формальдегид, гликолиевый альдегид) и конечные (муравьиная кислота, оксалат) продукты.

156
Процесс дегидрирования лежит в основе превращений целого ряда ароматических соединений. Так, в ходе метаболизма бензойной кислоты образуется гиппуровая кислота. Участвующие в превращении энзимы локализуются в митохондриях.
3.1.4. Флавопротеинредуктазы Флавопротеинредуктазы участвуют в метаболизме некоторых ксенобиотиков, причем превращение в
частности хинонов приводит к генерации свободных радикалов в клетках. Продукты превращения хинонов могут переносить электроны на молекулярный кислород, что сопровождается регенерацией исходного субстрата и инициацией образования каскада кислородных радикалов. Образование свободных радикалов - один из общих механизмов цитотоксичности (рисунок 9).
Рисунок 9. Образование кислородных радикалов в результате окислительно-восстановительного цикла хинона, катализируемого флавопротеинредуктазой
Активируемое таким образом превращение субстратов, дающее начало образованию кислородных радикалов, обозначается как "окислительно-восстановительный цикл". Помимо хинона по такому механизму метаболизируют нитроароматические соединения, биспиридины и т.д. К числу токсикантов, активирующих свободнорадикальные процессы в клетке в процессе метаболизма при участии флавопротеинредуктаз, относятся в частности пестицид паракват, противоопухолевое средство адриамицин, антибиотик нитрофурантион, комплексные соединения железа и меди (см. раздел "Механизмы цитотоксичности").
3.1.5. Восстановление В тканях человека и других млекопитающих содержатся ферменты, восстанавливающие молекулы
некоторых ксенобиотиков. К их числу относятся, в частности, нитрозоредуктазы (превращают группы NO2- в NH2-), нитроредуктазы (восстанавливают нитраты до нитритов), азоредуктазы (активируют восстановительное расщепление азогрупп с образованием первичных аминогрупп), дегалогеназы (контролируют восстановительное дегалогенирование таких веществ как гексахлоран, ДДТ и др.).
3.2. Гидролитические превращения 3.2.1. Расщепление эфиров
В тканях человека и животных, а также в жидкостях организма, например крови, содержатся энзимы, обладающие эстеразной активностью. Их низкая специфичность обеспечивает гидролиз эфиров различного строения. Так, в плазме крови содержатся эстеразы, разрушающие эфиры холина, прокаина, производных прокаина и др. Среди наиболее изученных: карбоксилэстераза и арилэстераза. Эфиры фосфорной кислоты в крови и тканях также расщепляются эстеразами. Гидролиз эфиров изменяет биологическую активность веществ.
3.2.2. Расщепление амидов кислот Токсиканты, содержащие эфирные связи расщепляются в организме с большой скоростью (см. выше).
Результатом такого расщепления является изменение токсичности ксенобиотиков. При синтезе новых токсикантов (пестицидов) для повышения их стабильности в организме в молекулу вместо эфирной, вводят амидную связь.
Некоторые ткани содержат энзимы, разрушающие и амидные группировки (печень: дезаминидазы). Однако активность ферментов, разрушающих амидные связи в тканях млекопитающих, низка и потому процесс метаболизма таких соединений проходит медленно.
3.2.3. Эпоксидгидролазы Эпоксидгидролазы активируют превращение эпоксидов в трансдигидродиолы. Описаны
микросомальная и цитозольная фракции энзима. Для осуществления превращения ксенобиотиков не требуется присутствие в среде кофакторов. Под влиянием энзима осуществляется гидролиз моноэпоксидов полициклических ароматических углеводородов. Образующиеся при этом дигидродиолы являются субстратами Р-450, которые превращают их в диэпоксиды:
Диэпоксиды являются более активными канцерогенами, чем исходные моноэпоксиды. 3.2.4. Другие гидролазы
В 1955 году Mounter et al. обнаружили в разных тканях и крови млекопитающих энзим (флюорогидролаза), активирующий отщепление от атома фосфора высокотоксичных фосфорорганических соединений (ДФФ, зарин, зоман и т.д.) атом фтора. Токсичность веществ, в процессе такого превращения, резко снижается (рисунок 10).

157
Рисунок 10. Гидролиз зарина при участии флюорогидролазы
Наивысшая активность энзима определяется в печени, наименьшая в мозге. Ионы Mg+2, производные пиридина и имидазола повышают активность флюорогидролазы. Соли ртути, меди угнетают активность.
4. Вторая фаза метаболизма. Конъюгация Превращение молекул в первой фазе биотрансформации усиливает их полярность, уменьшает
способность растворяться в липидах. Уже только благодаря этому целый ряд чужеродных соединений лучше выделяется с мочой. Эффект еще более усиливается, когда к образовавшимся в ходе 1 фазы метаболизма продуктам присоединяются такие эндогенные вещества, как ацетат, сульфат, глюкуроновая кислота, глутатион и т.д. Как и энзимы l фазы метаболизма ксенобиотиков, энзимы ll фазы обладают слабой субстратной специфичностью и участвуют в превращениях большой группы химических веществ.
Рассматриваемую группу энзимов можно классифицировать следующим образом:
1.Энзимы, формирующие эфирные или амидные связи с промежуточными метаболитами: - ацетил КоА: амин N-ацетилтрансфераза;
- сульфотрансфераза; - УДФ-глюкуронозилтрансфераза.
2.Энзимы, активирующие конъюгацию веществ с глутатионом:
- глутатион S-трансферазы.
3. Энзимы, активирующие конъюгацию веществ с цистеином:
- цистеин-конъюгирующие 
 -лиазы.
-лиазы.
Общая характеристика реакций конъюгации ксенобиотиков представлена в таблице 4. Таблица 4. Характеристика основных реакций конъюгации ксенобиотиков
Реакция |
|
Присоединяемый агент |
Функциональная |
группа |
|
|
ксенобиотика |
|
|||
|
|
|
|
|
|
А. Реакции, протекающие при участии активированных форм присоединяемых агентов |
|
||||
Конъюгация |
с |
УДФ-глюкуроновая |
-ОН; -СООН; NH2; |
|
|
глюкуроновой кислотой |
|
кислота |
|
-NR2; -SH; -CH |
|
Конъюгация с глюкозой |
УДФ-глюкоза |
|
-ОН; -SH; COOH; =NH |
|
|
Сулфатация |
|
ФАФС |
|
-ОН; -NH2; -SH |
|
Метилирование |
|
S-аденозилметионин |
-ОН; -NH2 |
|
|
Ацетилирование |
|
Ацети КоА |
|
-ОН; -NH2 |
|
Детоксикация цианида |
Сульфон-сульфид |
-CN- |
|
||
Б. Реакции, протекающие при участии активированных форм ксенобиотиков |
|
||||
Конъюгация |
с |
|
|
Ареноксиды; |
эпоксиды; |
Глутатион |
|
галогенированные алкильные и арильные |
|||
глутатионом |
|
|
|||
|
|
|
углеводороды |
|
|
|
|
|
|
|
|
Конъюгация |
с |
Глицин; |
глутамин; |
-СООН |
|
аминокислотами |
|
орнитин; таурин; цистеин |
|
||
|
|
|
|||
(J. Caldwell, 1979)
В ряде случаев, в ходе метаболизма ксенобиотиков во ll фазе также образуются токсичные продукты (токсификация).
4.1. Ацетилирование Аминогруппы ароматических соединений часто подвергаются ацетилированию. Уксусная кислота
переносится на аминогруппу в форме ацетил-КоА с помощью соответствующих трансфераз, в частности - ацетил-КоА:амин-N-ацетилтрансферазы.
Ацетилированию могут подвергаться ариламингруппы, сульфамидные группы, алифатические амины, группы гидразина. У людей выражены генетически обусловленные различия в способности к реакции N- ацетилирования. Замедленное ацетилирование отмечается у гомозиготных по рецессивному аллелю индивидов. Высокая активность ацетилирования отмечается у гетерозиготных индивидов или людей, гомозиготных по доминантному аллелю.
4.2. Другие реакции ацилирования Не только уксусная кислота, но и другие органические кислоты способны превращаться в организме в
активную форму, вступая во взаимодействие с КоА (жирные кислоты, карболовая кислота, бензойная кислота, фенилуксусная кислота и др.). В этой форме вещества вступают в реакцию взаимодействия с соединениями, содержащими аминогруппу (глицином, глутаматом), с образованием конъюгатов. Так, известно, что при поступлении в организм бензойной кислоты с мочой выделяется гиппуровая кислота. Гиппуровая кислота представляет собой конъюгат бензойной кислоты с глицином. В данном случае эндогенная молекула глицина выступает в качестве акцептора, с которым связывается бензойная кислота, активированная КоА. В организме человека активированная форма фенилуксусной кислоты связывается с глутаматом.
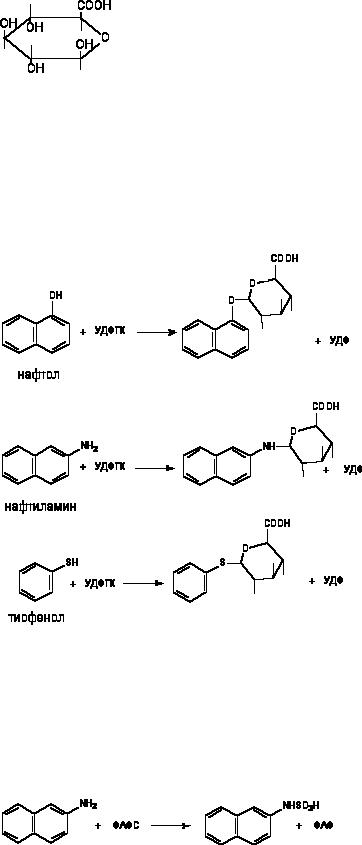
158
4.3. Конъюгация с глюкуроновой кислотой Глюкуроновая кислота (рисунок 11) имеет большое значение в механизме биотрансформации
ксенобиотиков.
Рисунок 11. Глюкуроновая кислота Она активно присоединяется к молекулам алифатических и ароматических спиртов, органических
кислот, серосодаржащих соединений. Процесс конъюгации приводит к образованию эфиров глюкуроновой кислоты - глюкуронидов.
В реакцию конъюгации глюкуроновая кислота вступает в активной форме уридиндифосфоглюкуроновой кислоты (УДФГК) и переносится на молекулу-акцептор с помощью соответствующей трансферазы: УДФглюкуронозилтрансферазы (УДФ-ГТ). Энзим идентифицирован в микросомальной фракции клеток печени, почек, других органов. УДФГК образуется в процессе взаимодействия глюкозо-1-фосфата с уридинтрифосфорной кислотой (УТФ) в растворимой фракции цитозоля клеток. УДФ-ГТ индуцируется при поступлении в организм таких веществ, как фенобарбитал, ПАУ, диоксины, полигалогенированные бифенилы.
Примеры типов реакции глюкуронидирования представлены на рисунке 12.
Рисунок 12. Некоторые реакции глюкуронидирования ксенобиотиков С помощью конъюгации с глюкуроновой кислотой метаболизируют и некоторые эндогенные вещества,
например стероиды и билирубин.
В кишечнике под влиянием глюкуронидазы, энзима кишечной микрофлоры, глюкурониды могут расщепляться с образованием веществ, способных к реабсорбции и обратному поступлению в кровь (явление кишечно-печеночной циркуляции ксенобиотика).
4.4. Конъюгация с сульфатом Различные соединения, содержащие фенольные группы выделяются из организма в виде конъюгатов с
сульфатом. Эндогенные сульфаты могут взаимодействовать также с ароматическими аминами. Процесс взаимодействия проходит в несколько этапов. На первом этапе образуется активная форма сульфата - 3- фосфоаденазин-S-фосфосульфат (ФАФС). Перенос сульфогруппы на молекулу-акцептор (фенол, стероиды
идр.) осуществляется с помощью энзима сульфотрансферазы:
Взависимости от строения молекулы-акцептора в процесс вовлекаются различные сульфотрансферазы. Энзимы не индуцируются ксенобиотиками. Их активность может быть угнетена пентахлорфенолом, 2,6-дихлор-4-нитрофенолом. Сульфотрансферазы обладают относительно высокой субстратной специфичностью. Система конъюгации сульфата локализуется главным образом в цитозольнй фракции гепатоцитов. Запасы ФАФС в печени незнечительны, легко истощаются, что при высоких

159
токсических нагрузках приводит к переключению метаболизма на другие пути, в частности в сторону образования продуктов глюкуронидирования. Сульфатация, таким образом, является системой с "высоким сродством, но малой мощностью", глюкуронидирование, напротив - с "малым сродством, но высокой мощностью".
4.5. Конъюгация с глутатионом и цистеином Органические вещества, содержащие в молекуле лабильные атомы водорода, галогенов и др., в
организме могут взаимодействовать с SH-содержащими эндогенными соединениями: цистеином, ацетилцистеином, глутатионом и т.д.
Реакции конъюгации восстановленного глутатиона с электрофильными субстратами катализируют энзимы глутатион-S-трансферазы (GST). Хотя GST обнаружены практически во всех тканях организма млекопитающих, уровень энзимов в печени - максимален. В этом органе GST составляет до 10% общего количества цитозольных протеинов. GST - большое семейство энзимов, в котором набор изоформ часто специфичен для отдельных тканей. Их активность индуцируется при поступлении в организм различных ксенобиотиков. В подавляющем большинстве случаев взаимодействие ксенобиотиков с глутатионом приводит к их детоксикации. Однако известны примеры биоактивации. Так, конъюгация глутатиона с 1,2- дигалогеналканами (дихлорэтан, дибромэтан) приводит к образованию продукта: S-(2-галогеналкан), который в дальнейшем превращается в активный циклический эписульфониум-ион (рисунок 13).
Рисунок 13. Биоактивация дибромэтана при участии глутатион-S-трансферазы
Глутатион, вступивший в реакцию конъюгации с веществом подвергается расщеплению (рисунок 14). В результате из организма выделяется метаболит в связанной с N-ацетилцистеином форме (меркаптуровые кислоты).
Рисунок 14. Взаимодействие ксенобиотика с глутатионом и последующее превращение комплекса Аналогичным образом происходит взаимодействие ксенобиотиков с цистеином и ацетилцистеином:
4.6. Метилирование Для многих веществ, процесс превращения завершается этапом метилирования молекулы.
Метилированию могут подвергаться молекулы, содержащие гидроксильные, сульфгидрильные и аминогруппы в структуре. В качестве донора метильной группы выступает метионин в форме S- аденозилметионина (SАМ). Перенос радикала осуществляют соответствующие O-, S-, N- метилтрансферазы:
Среди эндогенных веществ, таким образом, при участии фермента катехол-О-метилтрансферазы (КОМТ) метаболизируют адреналин, норадреналин, дофамин. При этом образуются малоактивные 3- метоксипроизводные катехоламинов.

160
5. Энзимы кишечной флоры При участии кишечной флоры также возможен метаболизм химических соединений. Действие
бактериальных энзимов сопровождается расщеплением продуктов ll фазы метаболизма, поступающих в кишечник с желчью, и образованием исходных метаболитов. Этот процесс проходит при участии гидролаз, разрушающих глюкурониды и сульфаты. Реабсорбция образовавшихся веществ замыкает цикл внутрипеченочной рециркуляции ксенобиотиков. Кроме того, анаэробная среда кишечника обеспечивает возможность восстановления некоторых химических веществ бактериями. Например, восстановление нитроароматических соединений сопровождается образованием аминов, которые, поступая в печень, вновь
подвергается метаболизму. Бактериальная 
 -глюкуронидаза и нитроредуктаза играют исключительно важную роль в процессе многоэтапной биоактивации 2,6-динитротолуола (рисунок 15).
-глюкуронидаза и нитроредуктаза играют исключительно важную роль в процессе многоэтапной биоактивации 2,6-динитротолуола (рисунок 15).
Рисунок 15. Взаимодействие печеночных энзимов и энзимов флоры кишечника в процессе биоактивации канцерогена 2,4-динитротолуола
6. Факторы, влияющие на метаболизм ксенобиотиков Способность органов и тканей метаболизировать ксенобиотики зависит от набора и активности
энзимов, участвующих в процессе. В значительной степени активность энзимов является внутренней характеристикой конкретной ткани, определяется генетическими особенностями организма и зависит от пола и возраста. Дополнительными факторами, порой существенным образом влияющими на содержание и активность энзимов, являются условия окружающей среды. Это прежде всего химические вещества, выступающие в качестве индукторов или ингибиторов энзимов, питание и действие патогенных факторов (таблица 5).
Таблица 5. Факторы, влияющие на метаболизм ксенобиотиков
ЕСТЕСТВЕННЫЕ:
вид, пол, возраст, питание
ИНДУКТОРЫ ФЕРМЕНТОВ:
Барбитураты, полициклические углеводороды, андрогенные стероиды, анаболические стероиды, глюкокортикоиды и др.
ИНГИБИТОРЫ ФЕРМЕНТОВ:
Метирапон, 7,8-бензофлавон, кобальт, SKF-525 и др.
ПОВРЕЖДЕНИЯ СТРУКТУРЫ ОРГАНА:
Хлорированные углеводороды, тироксин, аллоксан, морфин, гепатотомия, адреналэктомия, кастрация самцов, голод
6.1. Генетические факторы Особи одного и того же вида живых существ порой значительно различаются по способности
метаболизировать ксенобиотики. Это во многом детерминировано генетически. Так, в популяции людей выявляются лица, обладающие пониженной активностью цитохромР-450 зависимых оксидаз. "Слабые метаболизанты" могут отличаться отсутствием некоторых изоэнзимов, необходимых для катализа ряда превращений ксенобиотиков.
Полиморфизм метаболизма ксенобиотиков отмечен для процессов ацетилирования ароматических веществ, содержащих амино-, сульфо-, амидную группу. Лица со слабым напряжением процессов ацетилирования более подвержены некоторым аллергическим реакциям, вызываемым химическими веществами. С другой стороны, излишне напряженный процесс ацетилирования ксенобиотиков может иметь пагубные последствия в результате биоактивации арилгидразинов.
6.2. Пол и возраст
