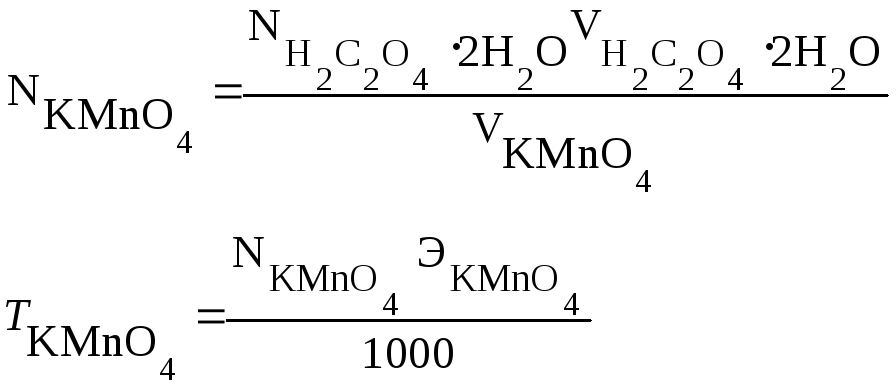- •Глава 1. Введение в титриметрические методы анализа. Вопросы к занятию:
- •§1. Правила техники безопасности.
- •§2. Понятие о химическом эквиваленте и факторе эквивалентности.
- •Основность кислоты
- •§3. Способы выражения концентрации растворов.
- •§4. Задачи для самостоятельного решения.
- •Глава II. Кислотно-основное титрование. Вопросы к занятию:
- •§1. Введение.
- •§2. Теоретические основы титриметрического метода анализа.
- •§3. Кислотно-основное титрование.
- •§4. Кривые титрования. Выбор индикатора.
- •§5. Вопросы и задачи для самостоятельного решения.
- •§6. Лабораторный практикум.
- •Ход работы.
- •Лабораторная работа № 2 Кислотно – основное титрование
- •§7. Учебно-исследовательская работа студентов (уирс).
- •Глава III. Оксидиметрия Вопросы к занятию:
- •§1. Теоретические основы методов оксидиметрии. Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
- •§2. Типы окислительно-восстановительных реакций.
- •§3. Перманганатометрия.
- •Приготовление рабочего раствора kMnO4
- •§4. Иодометрия.
- •§5. Лабораторный практикум. Работа 1. Установление нормальности и титра kMnO4 по 0,05н раствору щавелевой кислоты.
- •Работа 2 Установление нормальности и титра раствора тиосульфата натрия по бихромату калия.
- •§6. Задачи для самостоятельного решения.
- •Глава IV. Химическая термодинамика
- •Вопросы к занятию
- •§1. Основные понятия термодинамики.
- •§2. Первый закон термодинамики. Энтальпия.
- •§3. Закон Гесса.
- •§4. Следствия из закона Гесса.
- •Причем следует учесть, что ∆н° образования простых веществ равна нулю.
- •§5. Второй закон термодинамики. Энтропия.
- •Знак неравенства относится к необратимым процессам, а знак равенства - к обратимым процессам.
- •§6. Энергия Гиббса и направление химических реакций.
- •§7. Химическое равновесие.
- •§8. Основы биоэнергетики.
- •§9. Лабораторный практикум.
- •§10. Примеры решения задач.
- •§11. Задачи для самостоятельного решения.
§4. Иодометрия.
Иодометрия– это титриметрический метод определения окислителей и восстановителей, основанный на реакции
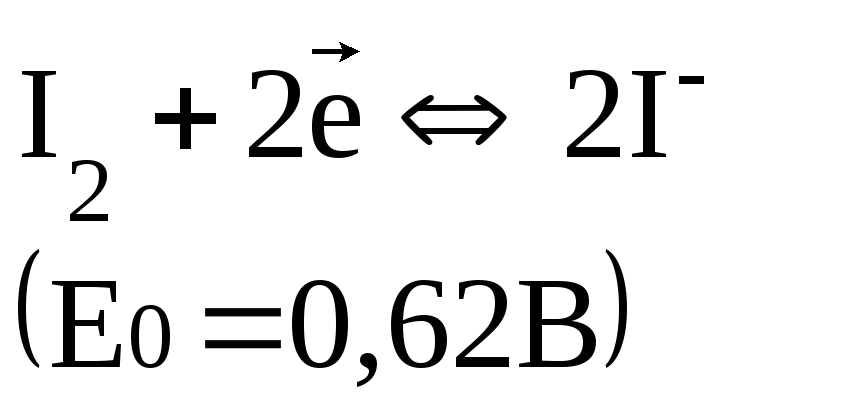
Йод плохо растворим в воде, но в присутствии йодид-ионов образуется комплекс I3-, поэтому при титровании протекает реакция
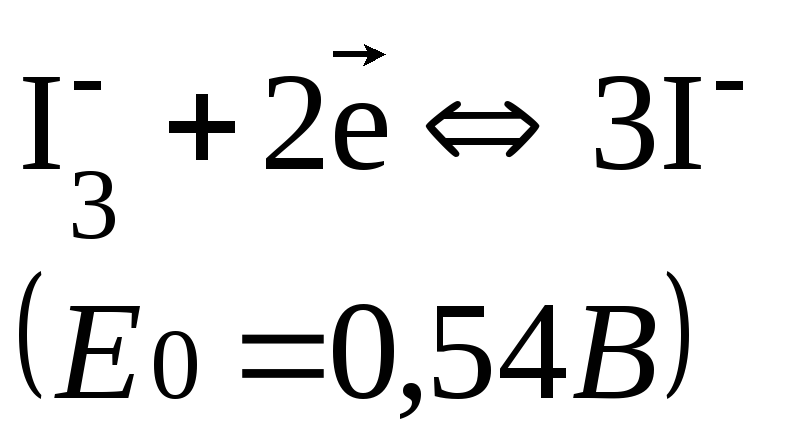
Стандартные потенциалы многих восстановителей меньше Е0(I3-/3I-), а многих окислителей – выше, поэтому система служит для определения и окислителей, и восстановителей.
В иодометрии наибольшее значение имеет реакция взаимодействия йода с тиосульфатом натрия, протекающая по уравнению:
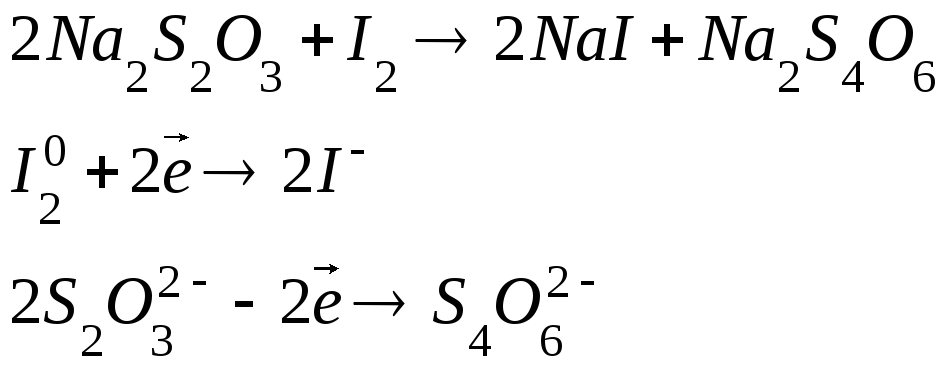
Продуктом реакции является тетратионат натрия Na2S4O6– натриевая соль тетратионовой кислоты.
Йод в зависимости от концентрации окрашивает растворы от желтого до красно-бурого цвета. Для точного фиксирования точки эквивалентности в данной реакции применяют раствор крахмала, который добавляют перед концом титрования (когда раствор становиться бледно-желтым). Йод образует с крахмалом интенсивно синее соединение. В момент эквивалентности, когда восстанавливается весь йод (переходит в иозид-ионы), синяя окраска исчезает, и раствор становится бесцветным.
Прямая реакция восстановления йода идет быстро, но обратная реакция окисления иодида протекает во времени. Поэтому использовать для определения окислителей раствор иодида невозможно. К тому же растворы иодидов (КI) неустойчивые, поскольку иодид окисляется кислородом воздуха. Поэтому используют косвенный прием – добавляют к окислителю избыток иодида, а выделившийся йод оттитровывают стандартным раствором тиосульфата натрия:
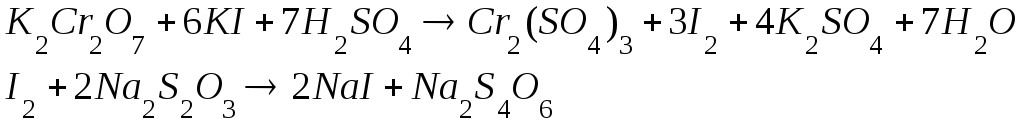
Непосредственное титрование тиосульфата раствором K2Cr2O7невозможно из-за нестехиометричности реакции.
Индикатором так же служит крахмал.
Йодометрические определения восстановителей проводят по методу обратного титрования. К анализируемому раствору добавляют титрованный раствор йода в избытке. С определяемым веществом реагирует эквивалентное количество йода, например
![]()
Избыток йода титруют рабочим раствором тиосульфата натрия. Зная общее количество йода и непрореагировавший избыток, рассчитывают количество йода, эквивалентное анализируемому веществу.
Прямое титрование сульфитов раствором йода обычно дает уменьшенные результаты, т.к. во время титрования часть сульфита окисляется кислородом воздуха
![]()
Прямая йодометрия применяется для определения As(III),Sn(II),Sb(III), сульфитов, сульфидов, тиосульфатов, аскорбиновой кислоты и др., косвенная – для определенияCu(II),O2,H2O2, броматов, иодатов, гипохлоритов
В биохимии и клиническом анализе методом йодометрии определяют содержание альдегидной и кетонной группы, ацетона, хинона, гидрохинона, антипирина и др.
§5. Лабораторный практикум. Работа 1. Установление нормальности и титра kMnO4 по 0,05н раствору щавелевой кислоты.
Нормальность и титр KMnO4 устанавливают по щавелевой кислоте. В основе процесса титрования лежит реакция междуKMnO4 иH2C2O4H2Oв кислой среде:
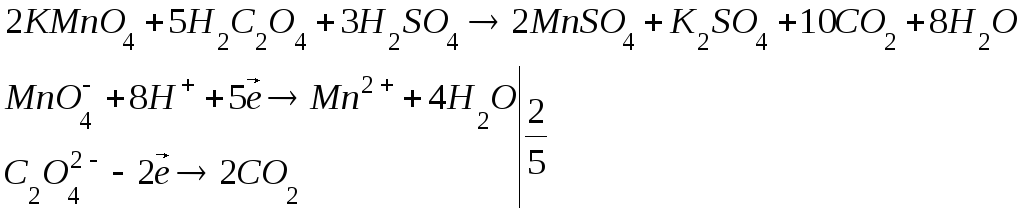
Ход определения
Бюретку заполняют раствором KMnO4. Кончик бюретки должен быть полностью заполнен раствором перманганата.
В коническую колбу для титрования с помощью пипетки вносят 5 мл раствора щавелевой кислоты H2C2O4. Добавляют 2-2,5 мл 2н раствора H2SO4и нагревают на водяной бане до 70o-80oC, не допуская кипения раствора. Горячий раствор титруют перманганатом калия, добавляя его по каплям и непрерывно перемешивая. Первые каплиKMnO4 обесцвечиваются не сразу. Пока не произошло обесцвечивание, не рекомендуется приливать последующие капли. Титрование прекращают, когда прибавление очередной капли раствораKMnO4 вызывает уже неисчезающую розовую окраску содержимого колбы в течение 1-2 минут. ОбъемKMnO4, затраченный на титрование отмечают на бюретке по верхнему мениску.
Титрование повторяют 3 раза и данные записывают в таблицу.
Таблица 7.
|
№ оп. |
V(H2C2O4 ∙ H2O) |
N(H2C2O4 ∙ H2O) |
V(KMnO4) |
N(KMnO4) |
T(KMnO4) |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Cред. |
|
|
|
|
|
Нормальность и титр раствора перманганата калия вычисляют, исходя из среднего объема раствора KMnO4, затраченного на титрование