
- •Глава 1. Введение в титриметрические методы анализа. Вопросы к занятию:
- •§1. Правила техники безопасности.
- •§2. Понятие о химическом эквиваленте и факторе эквивалентности.
- •Основность кислоты
- •§3. Способы выражения концентрации растворов.
- •§4. Задачи для самостоятельного решения.
- •Глава II. Кислотно-основное титрование. Вопросы к занятию:
- •§1. Введение.
- •§2. Теоретические основы титриметрического метода анализа.
- •§3. Кислотно-основное титрование.
- •§4. Кривые титрования. Выбор индикатора.
- •§5. Вопросы и задачи для самостоятельного решения.
- •§6. Лабораторный практикум.
- •Ход работы.
- •Лабораторная работа № 2 Кислотно – основное титрование
- •§7. Учебно-исследовательская работа студентов (уирс).
- •Глава III. Оксидиметрия Вопросы к занятию:
- •§1. Теоретические основы методов оксидиметрии. Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
- •§2. Типы окислительно-восстановительных реакций.
- •§3. Перманганатометрия.
- •Приготовление рабочего раствора kMnO4
- •§4. Иодометрия.
- •§5. Лабораторный практикум. Работа 1. Установление нормальности и титра kMnO4 по 0,05н раствору щавелевой кислоты.
- •Работа 2 Установление нормальности и титра раствора тиосульфата натрия по бихромату калия.
- •§6. Задачи для самостоятельного решения.
- •Глава IV. Химическая термодинамика
- •Вопросы к занятию
- •§1. Основные понятия термодинамики.
- •§2. Первый закон термодинамики. Энтальпия.
- •§3. Закон Гесса.
- •§4. Следствия из закона Гесса.
- •Причем следует учесть, что ∆н° образования простых веществ равна нулю.
- •§5. Второй закон термодинамики. Энтропия.
- •Знак неравенства относится к необратимым процессам, а знак равенства - к обратимым процессам.
- •§6. Энергия Гиббса и направление химических реакций.
- •§7. Химическое равновесие.
- •§8. Основы биоэнергетики.
- •§9. Лабораторный практикум.
- •§10. Примеры решения задач.
- •§11. Задачи для самостоятельного решения.
Глава III. Оксидиметрия Вопросы к занятию:
1. Понятие об окислительно-восстановительных реакциях, их виды.
2. Расчет эквивалентов окислителя и восстановителя.
3. Сущность и методы оксидиметрии.
4. Метод перманганатометрии. Рабочие растворы.
5. Метод йодометрии. Рабочие растворы.
6. Применение методов оксидиметрии в медицинской практике.
§1. Теоретические основы методов оксидиметрии. Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
Окислительно-восстановительными реакциями называются такие процессы, в которых происходит переход электронов от одних молекул, атомов, ионов (восстановителей) к другим (окислителям). В результате изменяются степени окисления атомов, входящих в состав реагирующих веществ:
![]()
Окисление – это процесс отдачи электронов атомом, молекулой, ионом, степень окисления при этом повышается:
![]()
![]()
![]()
Восстановление– это процесс присоединения электронов атомом, молекулой, ионом; степень окисления при этом понижается:
![]()
![]()
![]()
Окисление всегда сопровождается восстановлением и наоборот.
![]()
Окислительно-восстановительные процессы играют исключительно-важную роль в живых системах: снабжают их энергией, необходимым «строительным материалом» и участвуют в механизмах биорегуляции. С помощью регулируемого обмена веществ достигается постоянство содержания окислителей и восстановителей и продуктов их взаимодействия в организме, обеспечивая окислительно-восстановительный гомеостаз. Контроль окислительно-восстановительного гомеостаза, как и нахождение концентраций практически любых ионов биосред, осуществляется с помощью метода ионометрии.
Различные окислители: оксид марганца (1Y) - MnO2, пероксид бария – BaO2, бихромат калия – K2Cr2O7 находят широкое применение при вулканизации стоматологических материалов.
В стоматологической практике для получения сополимерных материалов при нормальных температурах широко используют окислительно-восстановительные, или редокс-системы, на основе пероксида бензоила и замещенных анилинов. Данные вещества используют в качестве инициаторов процесса сополимеризации. Активаторами данного процесса могут выступать различные восстановители, такие как третичные ароматические амины, содержащие заместители, как в ароматическом кольце, так и при атоме азота.
Широкое применение в стоматологии получили самотвердеющие пластмассовые композиции (акриловые пломбировочные материалы). Возможность затвердения их при комнатной температуре обусловлена введением в их состав окислительно-восстановительных (редокс-) систем, состоящих из инициаторов и активаторов. Редокс-системы в отличие от обычных перекисных инициаторов (типа перекиси бензоила) способны регенерировать свободные радикалы при более низких температурах в результате окислительно-восстановительного процесса между инициаторами (окислителями) и активаторами (восстановителями).
§2. Типы окислительно-восстановительных реакций.
1. Реакции межмолекулярного окисления – восстановления– это реакции, в процессе которых обмен электронами происходит между разными молекулами:
![]()

2. Реакции диспропорционирования- это такие реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель вследствие того, что содержавшиеся в них атомы с промежуточной степенью окисления отдают и принимают электроны, переходя один – в состояние с низкой степенью окисления, другой – с высокой степенью окисления:
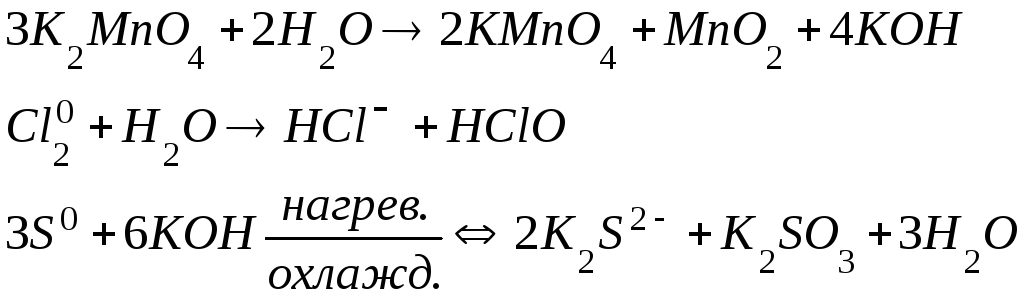
Составьте электронный баланс уравнений самостоятельно.
3. Реакции контродиспропорционирования- это реакции, обратные диспропорционированию:
![]()
4. Реакции внутримолекулярного окисления – восстановления – это реакции, в которых окислитель и восстановитель находятся в одной и той же молекуле:
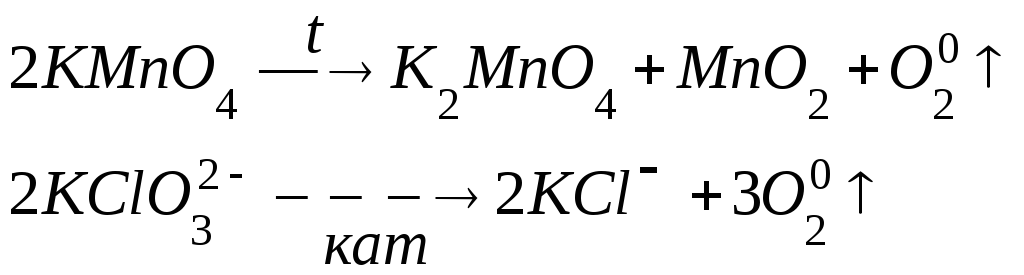
Титранты оксидиметрии. Рабочими растворами в оксидиметрии являются растворы окислителей (KMnO4, К2СrO7,I2,KBrO3и др.) и восстановителей (Na2S2O3,NaAsO2,SnCl2).
Эквиваленты окислителей и восстановителей в оксидиметрии определяют делением молекулярной массы соответствующего вещества на число электронов, которые оно принимает или отдает в рассматриваемой реакции.
Например:
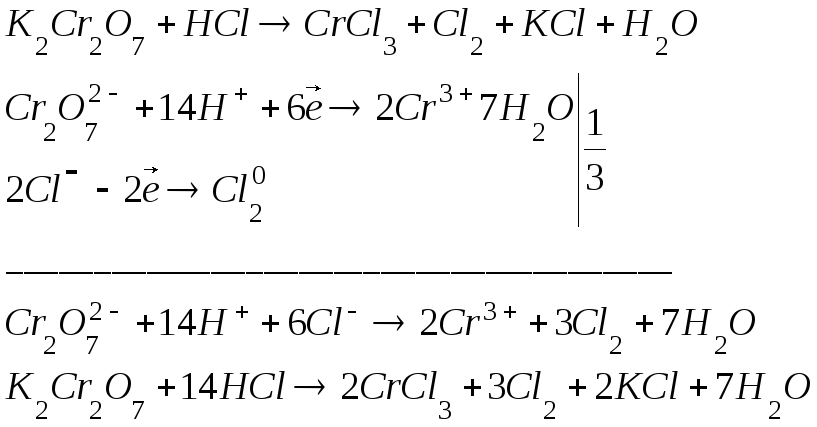
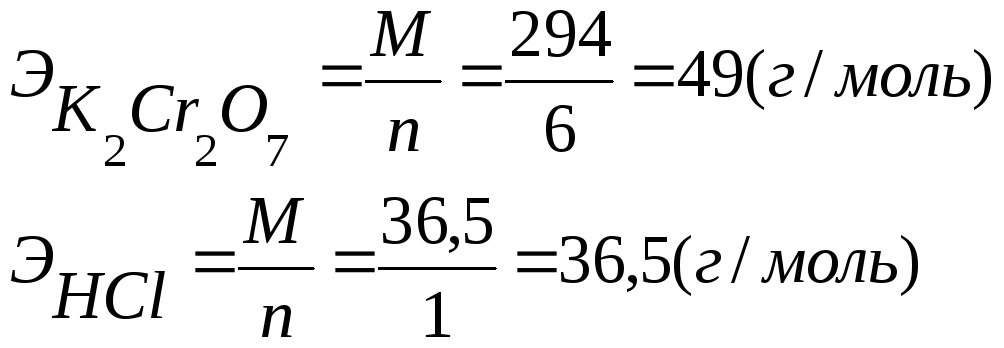
Количественной характеристикой интенсивности окислительно- восстановительного процесса является разность окислительно-восстановительных потенциалов (выражается в вольтах) реагирующих между собой систем.
Окислительно-восстановительный потенциал системы, измеренный при стандартных условиях и при величинах активностей ионов восстановленной и окисленной форм, равных единице, называют нормальным окислительно-восстановительным потенциалом системы. Зависимость окислительно-восстановительного потенциала системы от концентрации ионов восстановленной и окисленной форм выражают уравнением Нернста:
![]()
где [Oх] и [Red] - концентрации восстановленной и окисленной форм системы;n– число принимаемых или отдаваемых электронов при превращении окисленной формы в восстановленную.
Если концентрации [OX]=[Red], тоE=E0, т.е. окислительно-восстановительный потенциал системы будет равен ее нормальному потенциалу.
Все методы оксидиметрии классифицируются в зависимости от окислителя или восстановителя, применяемых в рабочем растворе.
Метод, основанный на окислении перманганатом калия, называют перманганатометрией, на окислении бихроматом калия - хроматометрией и т.д.
В оксидиметрии применяются различные методы определения точки эквивалентности:
исчезновение или появление окраски титранта или титруемого вещества.Например, при титровании раствором KMnO4с концентрацией не менее 0,02М раствор окрашивается в розовый цвет при введении минимального избытка рабочегораствора (титранта);
окислительно-восстановительные и специфические индикаторы.Специфические индикаторы – это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительно-восстановительной системы. Например, при титровании йода используют специфический индикатор – крахмал, образующий темно-синее окрашивание с молекулярным йодом –J2.
Окислительно-восстановительные индикаторы – это соединения, в основном органические, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску (дифениламин и его производные);
физико-химические методы (потенциометрия)
