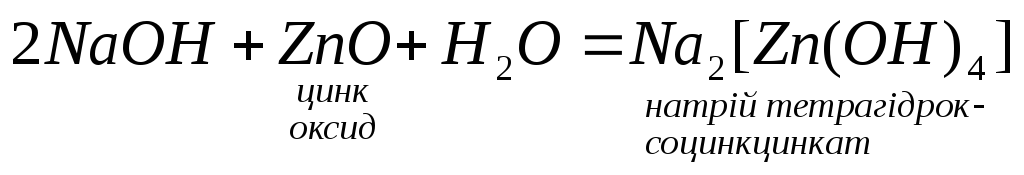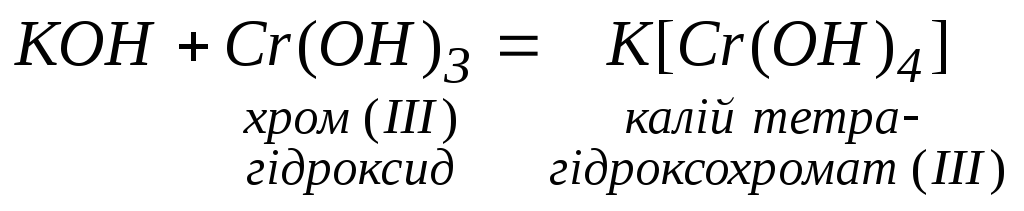- •Міністерство освіти науки
- •Лабораторна робота №1 здобування кислот, гідроксидів та солей
- •1.1 Загальні відомості
- •1.1.1 Здобування та властивості оксидів
- •1.1.2 Здобування та властивості гідроксидів
- •1.1.3 Здобування та властивості кислот
- •1.1.4 Здобування та властивості солей
- •1.2 Завдання для самостійного розв’язання:
- •1.3 Обладнання та реактиви
- •1.4 Вказівки до техніки безпеки
- •1.5 Порядок проведення лабораторної роботи
- •Лабораторна робота
- •Визначення еквівалента металу
- •2.1 Загальні відомості
- •2.1.1 Взаємозв'язок між основними фізичними величинами, що використовуються в хімії
- •2.2 Завдання для самостійного розв’язання
- •2.2.1 Розв’язати задачі
- •2.2.2 Визначити дані (?) для запропонованого варіанту
- •2.3 Обладнання та реактиви
- •2.4 Вказівки до техніки безпеки
- •2.5 Порядок проведення лабораторної роботи
- •Лабораторна робота № 3 окисно-відновні реакції
- •3.1 Загальні відомості
- •3.1.2 Метод електронного балансу
- •3.2 Завдання для самостійного розв’язання
- •3.2.1 Відповісти на запитання та виконати завдання
- •3.3 Реактиви та обладнання
- •3.4 Вказівки до техніки безпеки
- •3.5 Порядок проведення лабораторної роботи
- •Лабораторна робота №4 закономірності перебігу хімічних процесів
- •4.1. Загальні відомості
- •4.1.1. Енергетика хімічних процесів.
- •4.1.2. Основи хімічної кінетики
- •4.1.3. Хімічна рівновага
- •4.2. Завдання для самостійного розв’язання
- •4.2.1. Відповісти на запитання
- •4.2.2. Розв’язати задачі
- •4.3. Реактиви та обладнання
- •4.4. Вказівки до техніки безпеки
- •4.5 Порядок проведення лабораторної роботи
- •Лабораторна робота № 5 розчини
- •5.1 Загальні відомості
- •5.1.1. Загальна характеристика розчинів
- •5.1.2. Розчини електролітів
- •5.2 Завдання для самостійного розв'язання
- •5.2.1. Відповісти на запитання, виконати завдання
- •5.3 Реактиви та обладнання
- •5.4 Вказівки до техніки безпеки
- •5.5 Порядок проведення лабораторної роботи
- •Лабораторна робота №6 гальванічні елементи та електроліз
- •6.1 Загальні відомості
- •6.1.1 Електродні потенціали. Гальванічні елементи.
- •6.1.2 Електроліз
- •6.2 Завдання для самостійного розв’язання
- •6.3 Прилади та реактиви
- •6.4 Вказівки з техніки безпеки
- •6.5 Порядок проведення лабораторної роботи
- •Лабораторна робота №7 корозія та захист металів
- •7.1. Загальні відомості
- •7.2. Завдання для самостійного розв’язання
- •7.3. Реактиви та обладнання
- •7.4. Вказівки до техніки безпеки
- •7.5. Порядок виконання роботи
- •Загальна характеристика металів та їх сполук
- •8.1. Загальні відомості
- •8.2. Завдання для самостійного розв’язання
- •8.3. Реактиви та обладнання
- •8.4. Вказівки щодо техніки безпеки
- •8.5. Порядок виконання лабораторної роботи
- •Легкі конструкційні матеріали та їх властивості
- •9.1 Загальні відомості
- •9.2 Завдання для самостійного розв’язання
- •9.3 Вказівки до техніки безпеки
- •9.4 Реактиви та обладнання
- •9.5 Порядок проведення лабораторної роботи
- •Література
- •Додаток б Стандартні термодинамічні величини речовин
- •Додаток в Стандартні електродні потенціали е0 в при 250с
- •Додаток г Розчинність кислот, основ та солей у воді
Міністерство освіти науки
МОЛОДІ ТА СПОРТУ УКРАЇНИ
Запорізький національний технічний університет
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з дисципліни "ХІМІЯ"
для студентів усіх спеціальностей усіх форм навчання
2012
Методичні вказівки до лабораторних робіт з дисципліни "Хімія" для студентів технічних спеціальностей денної та заочної форм навчання. / Укл.: Н.І. Пономаренко, О.В. Капітан, Л.С. Осаул та інш. - Запоріжжя: ЗНТУ, 2012. - 61с.
Укладачі:
Н.І. Пономаренко, доцент, к.ф.н.
О.В. Капітан, доцент, к.х.н.
Л.П. Осаул, доцент, к.х.н.
В.М. Повзло, ст. викладач
Л.М. Незгода, ст. викладач
О.А. Швець, асистент
М.Ф. Гапоненко, асистент
Рецензент: О.В. Капітан, доцент, к.х.н.
Відповідальний за випуск: Н.І. Пономаренко, доцент, к.ф.н.
Затверджено
на засіданні кафедри
"Хімії та екології"
протокол № 10
від 27.06.2012
Лабораторна робота №1 здобування кислот, гідроксидів та солей
Мета роботи: повторення матеріалу про загальну характеристику основних класів неорганічних сполук.
1.1 Загальні відомості
1.1.1 Здобування та властивості оксидів
|
Здобування |
Хімічні властивості |
|
1.
Взаємодія простих речовин з киснем
(крім
2Са + О2 = 2СаО Кальций оксид 2. Окиснення деяких складних речовин:
2SO4 + O2 = 2SO3 cульфур (IV) cульфур (VI) оксид оксид 3. Розкладання оксидів: 4CrO3 = 2Cr2O3 + 3О2 хром(VI) оксид хром(III) оксид 4. Розкладання гідроксидів: t C Cu(OH)2 = CuO + H2O кальцій гідроксид 5. Розкладання кислот: H2SO3 = SO2 + H2O сульфатна(IV) сульфур(IV) кислота оксид 6. Розкладання солей: СаСО3 = СаО + СО2 Кальций карбонат карбон(IV)оксид
7. Взаємодія кислот-окисників з металами та неметалами: Cu + 4HNO3 = Cu(NO3)2+ 2NO2 + 2H2O Нітратна купрум (ІІ) нітроген(ІV) Кислота нітрат оксид
8. Заміщення леткого оксиду менш летким при нагріванні:
|
1. Взаємодіють з водою з утворенням гідроксидів або кислот: Na2O + H2O = 2NaOH Натрій оксид натрій гідроксид MnO3 + H2O = H2MnO4 Манган(VI) манганатна(ІV) Оксид кислота 2. Основні оксиди взаємодіють з кислотними та амфотерними оксидами (при нагріванні): 3MgO + P2O5 = Mg3(PO4)2 Магній Фосфор (V) магный Оксид оксид ортофосфат
3. Основні та амфотерні оксиди взаємодіють з кислотами:
4. Амфотерні та кислотні оксиди взаємодіють з лугами:
5. Деякі оксиди розкладаються:
|
1.1.2 Здобування та властивості гідроксидів
|
Здобування |
Хімічні властивості |
|
1. Взаємодія активних металів з водою:
2. Взаємодія оксидів лужних та лужноземельних металів з водою:
3. Взаємодія розчинів солей з лугами:
5. У результаті інших реакцій:
|
1. Гідроксиди лужних та лужно-земельних металів дисоціюють в водних розчинах:
2.
Розчини гідроксидів металів та
3. Взаємодіють з кислотними оксидами та кислотами:
4.
Луги взаємодіють з неметалами (
|

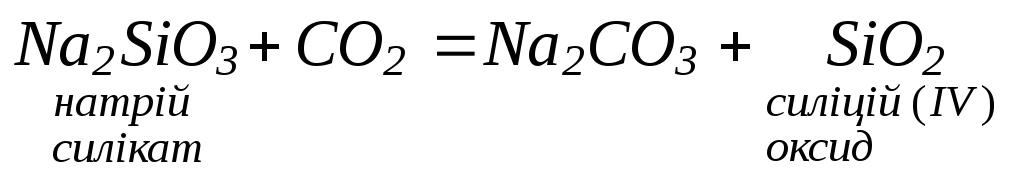
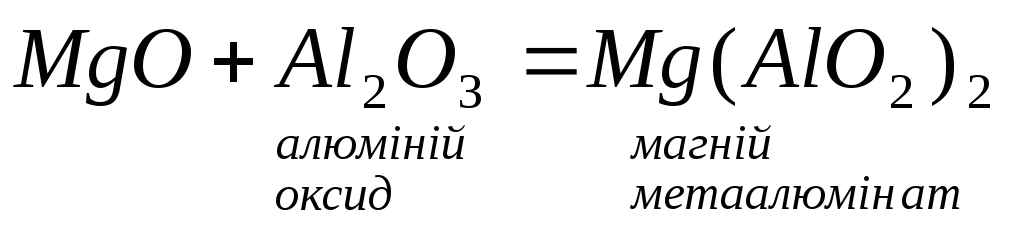
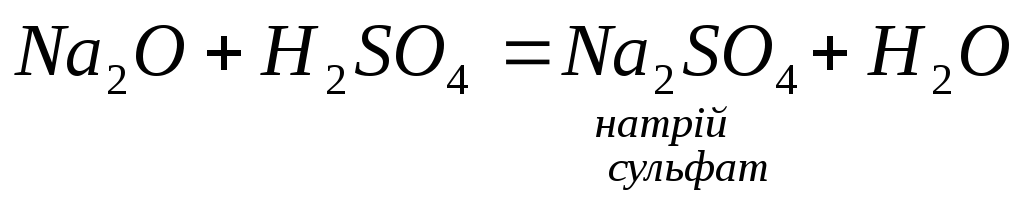
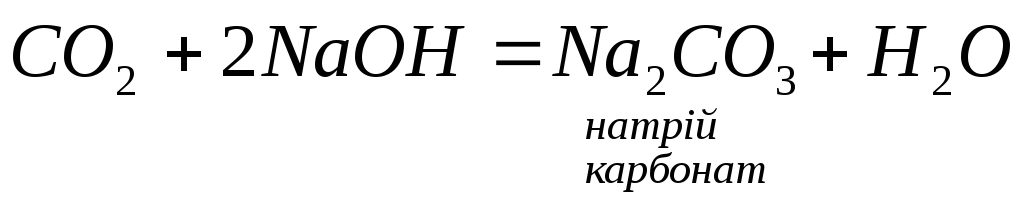
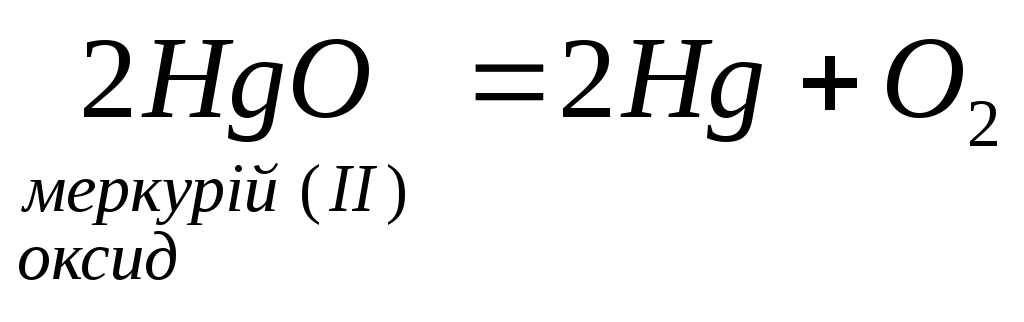
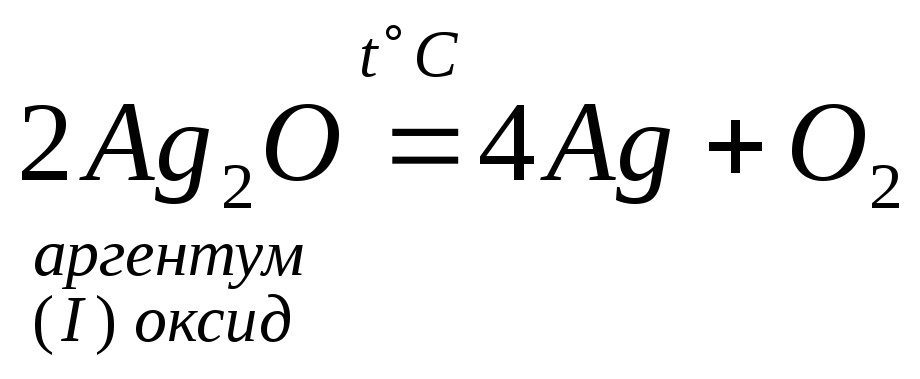
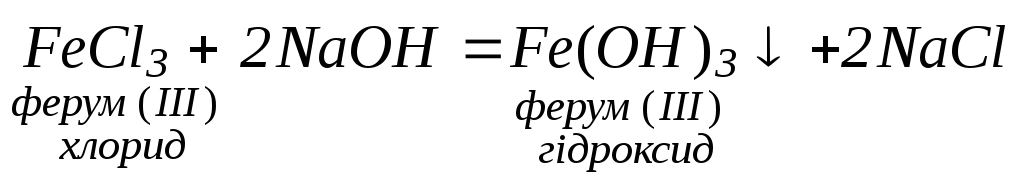
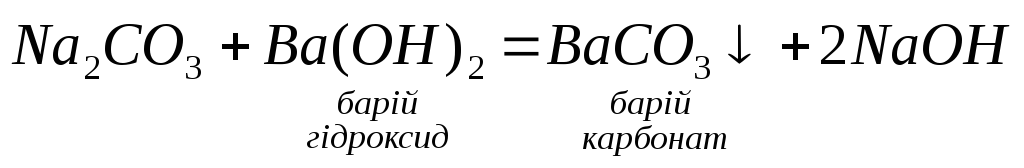 4.
Електроліз водних розчинів солей (в
розчині в катодному просторі
накопичується
4.
Електроліз водних розчинів солей (в
розчині в катодному просторі
накопичується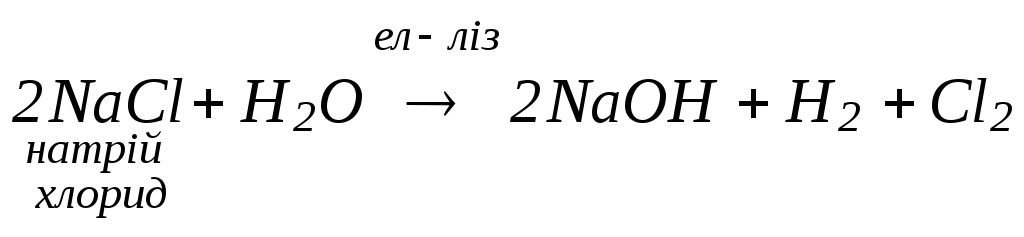

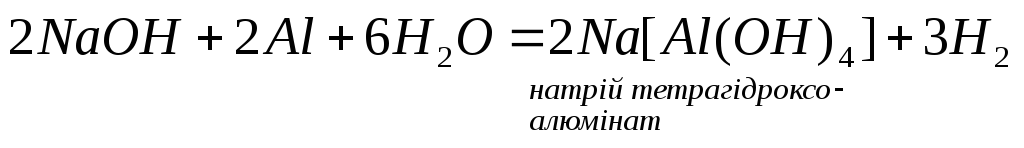 5.
Взаємодіють з амфотерними, оксидами
та гідроксидами:
5.
Взаємодіють з амфотерними, оксидами
та гідроксидами: