
- •52.Загальна характеристика вуглеводів. Значення для живих організмів, їх класифікація.
- •53.Характеристика моносахаридів. Їх фізичні та хімічні властивості (явище таутомерії, мутаротації). Оксикарбонільні та циклічні форми. Представники.
- •54.Характеристика дисахаридів. Їх фізичні та хімічні властивості. Представники.
- •55.Характеристика полісахаридів (крохмаль, целюлоза, гепарин).
- •57.Постійність концентрації глюкози та механізми, які забезпечують цю постійність.
- •60.Нервова та ендокринна регуляція вуглеводного обміну.
- •61.Синтез глікогену. Розщеплення глікогену (глікогеноліз).
- •65.Дихальний ланцюг. Характеристика та структура носіїв протонів водню та електронів дихального ланцюга.
- •71.Утворення аміаку. Шляхи переносу його в печінку та нирки з периферійних тканин та з м’язів.
- •72.Біосинтез сечовини. Орнітиновий цикл.
- •73.Виведення амінного азоту із організму – складна біохімічна проблема. Класифікація живих організмів по виведенню амінного азоту.
- •74.Обмін протеїдів (нуклеопротеїдів, хромопротеїдів).
- •75.Класифікація і номенклатура ліпідів
- •79.Будова та властивості фосфоліпідів і гліколіпідів.
- •80.Перетравлення жирів у шлунково-кишковому тракті.
- •81.Роль жовчі в травленні жиру.
- •82.Всмоктування ліпідів.
- •84.Окислення вищих жирних кислот. Енергетичне значення процесу окислення жирних кислот.
- •85.Роль різних органів та тканин в обміні ліпідів.
- •86.Розщеплення та синтез фосфатидів
- •87.Синтез та обмін холестеролу.
- •88.Взаємозв'язок між обміном білків, вуглеводів та ліпідів.
- •89.Біологічне значення води та її обмін.
- •90.Біологічне значення мінеральних солей та їх обмін.
- •91.Загальна характеристика крові.
- •92.Фізико-хімічні властивості крові.
- •93.Хімічний склад крові.
- •94.Основні функції крові.
- •95.Здатність крові до згортання. Механізм згортання крові.
- •96.Принцип методу визначення холестеролу в сироватці крові
- •97.Будова мембран та роль ліпідів, білків і вуглеводовмісних сполук в їх організації.
- •98.Модифікуюча та пошкоджуюча дія спиртів на біологічні мембрани
- •99.Будова м’язів. Механізм м’язового скорочення.
65.Дихальний ланцюг. Характеристика та структура носіїв протонів водню та електронів дихального ланцюга.
Дихальний ланцюг або дихальний ансамбль – це система ферментів і коферментів, з допомогою яких відбувається транспорт електронів і протонів водню від субстрату до кисню з утворенням Н2О і АТФ. Його складові вбудовані у внутрішню мембрану мітохондрій: від 5 до 20 тисяч ансамблів в одній мітохондрії.
66.Гліконеогенез.
Гликонеогенез — образование углеводов (глюкозы или гликогена) из веществ неуглеводного происхождения. Некоторые промежуточные метаболиты ГБФ-пути могут образоваться из веществ других классов — аминокислот, липидов. Например: пируват может получиться в ходе реакции трансаминирования из аланина.
67.Енергетичні ефекти окислення глюкози.
68.Ферментативний гідроліз білків в органах травлення.
Розчинності білка — ферментативний гідроліз. Але визначено, що високий ступінь гідролізу білка тваринного походження під дією таких ферментів, як пепсин, папаїн, проназа, на тлі підвищення його розчинності супроводжується підсиленням накопичення пептидів гідрофобного характеру.
69.Протеолітичні ферменти. Їх специфічність, активація.
Протеолітичні ферменти (протеази, протеїнази) каталітичного поліпептид або білок гідролізу ферментами колективно називають протеаз. Широкий сегмент тварин, рослин і бактерій Серед широкого спектру в травному тракті тварини, а також у лізосомах різних клітин в живому особливо багата за змістом. Протеази регулюючих обмін речовин в організмі і відіграє важливу біологічну роль. Молекулярна маса звичайно 2 - 30000 або близько того. Протеаза на місці гідролізу субстрату може бути розділена на ендопептідази і екзопептідази, середня частина колишнього гідролізату білка пептидного зв'язком, останній з аміно-або карбокси-кінці деградації амінокислотних залишків.
Природа
За характером різних протеаз активний сайт розділений на чотири категорії:
Серинових протеази
На додаток до активного центру серин включають гістидин і залишків аспарагінової кислоти, такі як підшлункової залози секретують різні ферменти і ендопептідази і згортання, гемоліз волокно, систему комплементу про різні протеаз.
Тіолпротеаза
Поза активних цистеїн сайті, за винятком гістидину повинні брати участь, наприклад, рослинних джерел, і деякі з лізосомних катепсинов.
Аспарагиновую протеазу
Їх активність центр складається з двох залишків аспарагінової кислоти, такий як виділення шлункового мембрани пепсин, нирок ангіотензин звільнити деякі з лізосомних ферментів як катепсини.
Металлопротеінази
На додаток до активного центру іонів інших металів, амінокислотні залишки повинні брати участь, таких як підшлункова залоза карбоксипептидази активність центр включає іони цинку (Zn 2 ) та глутамінової кислоти, залишків тирозину. Більшість іноземних пептиду ферменти протеази і деяких бактерій, як правило, потрапляють в цю категорію.
На додаток до необхідності різних протеаз, що беруть участь в каталітичної групи гідролізу пептидів зв'язок, необхідність мати певну комбінацію підкладки частин, різні частини з них, щоб визначити різні протеази специфічності.
Функціональна класифікація
З моменту відкриття протеази в біологічному процесі важливу роль регулювання після, але й у відповідності з їх фізіологічні функції і специфічність для класифікації.
Обмежуємося протеолітичний фермент
Відноситься до специфічність ферменту погане, гідроліз пептидних зв'язків у білках настільки малі, пептидами або навіть генерувати різноманітні вільних амінокислот. Фізіологічні функції цих протеаз в основному беруть участь у деградації білків, таких як шлунково-кишкового тракту виділяють різних протеаз у пробірці білок перетравлюється їжі; клітини різних лізосомальних тіло катепсина може усунути різні метаболічні продукту. Середня тривалість життя 120 днів еритроцити, гемоглобін, тобто від його деградації катепсини.
Обмежувальні протеолітичний фермент
Специфічності ферменту є дуже сильним, тільки на певному білкові субстрати, в якому конкретний гідролізу пептидного зв'язком, а потім проводити різні фізіологічні функції мають різні активного поліпептиду або білка. Такі протеази в природних умовах регулювання біологічного ефекту, більшість з них відносяться до серинових протеаз, з точки зору схожі на специфічність трипсин, знаходиться тільки на карбокси-кінцевого аргініну або лізину пептидного зв'язку складаються. Ці протеази і протеази взагалі кажучи, різні, загальні білки, такі як казеїн діяльності деградації чи гемоглобін дуже низький або не працює, хоча його специфічним субстратом гидролизованного білка конформацію мають строгі вимоги на підкладці після денатурації Це не може бути знижено, а не обмежувальні навпаки гідроліз протеазой, тим більше ступінь денатурації білкових субстратів більш сприйнятливі до гідролізу. Наприклад тромбін фібриноген, аргінін або лізин в залишку 150 пептидного зв'язком гідролізу фібриногену тільки α, β субодиниці N-терміналу в районі двох Arg - Gly пептидного зв'язком, випускаючи кровотеча волокно пептиду А, В, так що розчинного фібриногену у фібрин мережа гель.
Регулювання
Багато важливі фізіологічні ефекти в природних та біологічних регулювання протеази, такі як наведені в таблиці, коли тіло зовнішніми стимулами зробити відповідні фізіологічні реакції протеази природних мобілізований так що оригінальний не має фізіологічну активність деяких пептидів або білків, і швидко став функціональний сильна відповідного продукту, так як для досягнення захисту організму, виживання і розмноження цілей. Деякі мобілізації процес є відносно простим і може бути досягнуто шляхом каталітичної реакції. При відсутності активності в шлунково-кишковому тракті, коли трипсиногену N-кінцевого кінази гідролізується кишкового пептиду після видалення одного з 6 активного трипсину. Існує складний процес, пройти через багато каталітичні реакції, такі як згортання крові та доповнення реакції, близько 10 або більше компонентів у ньому участь.
Характеризується
Біологічний ефект миттєвого
Завдяки активності ін виво активації проявляють активність білка-попередника швидко. Тому що ні транскрипцію і експресію через дуплікації генів і інших складних процесів, вони не в змозі швидко реагувати на зовнішні сигнали. Крім того, ця реакція не є оборотною орієнтації, на відміну від інших ферментів в природних умовах біологічного механізму регулювання, такі як деякі кінази фосфорилювання шляхом фосфорилювання білка і дефосфорілірованія аллостеріческому ефект, вироблений таким чином оборотно Biomanipulation .
У каскадному режимі вираження
Це реакції на першому етапі активуються білок сам реакції, що каталізується рівня протеаз, так що більш значна грає роль. Приклад 2 У ході катализируемой ферментом навіть при дуже низьких рівнів 1000 реакції молекул субстрату, каталітичної реакції після двох збільшеного в 100 разів, і, отже, поза тіла на слабкий сигнал може виробляти сильне біологічних ефектів.
Існує негативним зворотним зв'язком
Так що весь багатоступінчастої реакційній системі в найкращому стані, наприклад, у згортанні крові активується під час як перетворення каталізується тромбіном фібриногену в фібрин зробити, але і активацію факторів згортання Ⅷ і Ⅴ, який у свою чергу подальше сприяння активації протромбіну, що є позитивного зворотного зв'язку, але саме по собі може тромбіну деградації протромбіну, тому не може бути активований, яка є негативного зворотного зв'язку.
Те ж активність каталітичного попередника білка іноді виробляє два або більше різних біологічних функцій, таких компонентів, як адренокортикотропний гормон, β-ендорфіну гормони і просування жиру білків попередника ж гідролізу.
Протеаз, що беруть участь в біологічної регуляції іноді може бути таким же, у двох різних способів виробництва фізіологічних ефектів, взаємного грати допоміжну роль. Наприклад, як у реакції згортання крові активації ендогенної, але і в організації екзогенної активації системи, обидва з яких в кінцевому рахунку передається протромбін активації згортання крові Х фактора.
Протеази беруть участь у ряді важливих біологічних системою управління, майже всі без винятку, має відповідний присутності інгібіторів протеази. У деяких системах, якщо їх відповідні дисбаланс інгібітор протеази може викликати ушкодження. Таких, як вроджені тромбоз вен і набряк Квінке часто пов'язано з відсутністю відповідних в природних інгібіторів антитромбіну Ⅲ та доповнення C1 інгібітор пов'язані між собою.
Застосування протеаз
Як багате джерело протеази, на додаток до раба, рослинних екстрактів, а й велика кількість ферментації бактерії, був широко використовуються в медичній, харчовій, шкіряної, шовкової нитки та інших галузей промисловості, а й як важливий біохімічних реагентів. Такі, як хімотрипсин для хірургії катаракти, хірургічне спростити, поліпшити шанси на успіх; трипсину видалення некротичних тканин, гнійне запалення, загоєння ран мають очевидний ефект; урокінази, стрептокінази для лікування венозного тромбозу, васкуліт; КАЛІКРЕЇН використані для поліпшення релаксації коронарних мікросудин, зниження артеріального тиску; еластази мають певний ефект на затвердіння артерій; бактеріальні протеази для депіляції шкіра, шовк клей клей. Вироби для виробництва сиру сичужного ферменту, папаїн і бромелайн пиво як стабілізатор, для усунення холодного пива вироблено осадження білка.
70.Загальні шляхи розпаду амінокислот в організмі (переамінування, дезамінування, відновлююче амінування, декарбоксилювання амінокислот і утворення біологічно активних амінів).
ТРАНСАМІНУВАННЯ (переамінування) — реакції перенесення α‑аміногрупи від амінокислоти наα‑вуглецевий атом α‑кетокислоти— акцептора аміногрупи (здебільшого— α‑кетоглутарату). Внаслідок реакції утворюється α‑кетоаналог вихідної амінокислоти та нова амінокислота (уразі використання як акцептора α‑кетоглутарату— L‑глутамат). Уперше процес Т. та ферменти, що його каталізують, були описані в 1937 р. А.О. Браунштейном та М.Г. Крицманом. Ферменти, які каталізують реакції Т., називаються амінотрансферазами (трансаміназами). Амінотрансферази є складними білками‑ферментами, простетичною групою в яких є коферментні форми вітаміну В6(піридоксину, піридоксолу) — піридоксальфосфат (ПАЛФ) та піридоксамінофосфат (ПАМФ), що утворюється з ПАЛФ у процесі перенесення аміногрупи. У під час Т. відбувається циклічне перетворення ПАЛФ на ПАМФ:
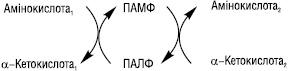
У реакціях Т. не відбувається дезамінування, тобто вивільнення амоніаку, оскільки аміногрупа, що відщеплюється від α‑L‑амінокислоти, акцептується відповідною α‑кетокислотою, здебільшого α‑кетоглутаровою. Реакції Т., які каталізуються амінотрансферазами, активно відбуваються в багатьох органах, найактивніше — в печінці, скелетних м’язах, міокарді, головному мозку, нирках. У різних тканинах організму людини і тварин міститься більше 10 різних амінотрансфераз, які розрізняються за своєю субстратною специфічністю. Найбільш поширеними є такі амінотрансферази:
1) аланін амінотрансфераза (глутамат-піруваттрансаміназа — ГПТ)
L-аланін +
α-кетоглутарат![]() піруват
+ L-глутамат
піруват
+ L-глутамат
2) аспартатамінотрансфераза (глутамат-оксалоацетаттрансфераза — ГОТ)
L-аспартат
+ α-кетоглутарат![]() оксалоацетат
+ L-глутамат
оксалоацетат
+ L-глутамат
3) тирозинамінотрансфераза
L-тирозин
+ α-кетоглутарат![]() р-гідроксифенілпіруват
+ L-глутамат
р-гідроксифенілпіруват
+ L-глутамат
4) лейцинамінотрансфераза
L-лейцин +
α-кетоглутарат![]() α-кетоізокапронат
+ L-глутамат
α-кетоізокапронат
+ L-глутамат
Вивчення активності аланінамінотрансферази (аланінової амінотрансамінази — АлАТ) та аспартатамінотрансферази (аспарагінової амінотрансамінази — АсАТ) широко застосовується в медичній практиці для діагностики ушкоджень внутрішніх органів. Унаслідок виходу цих ферментних білків через ушкоджені клітинні мембрани у кров при інфаркті міокарда відзначається значне підвищення активності в сироватці крові АсАТ, у той час як при вірусних та токсичних ушкодженнях печінки підвищується активність АлАТ.
Дезамінува́ння (від фр. des… — префікс, який означає відділення, та аміни) — процес відщеплення аміногрупи (NH2) від органічних сполук. Процес супроводиться заміщенням іншою групою (наприклад, Н, ОН, RO) або утворенням подвійного зв'язку. Відіграє важливу роль у процесах життєдіяльності всіх видів живих організмів, де є одним з основних етапів обміну азотистих сполук — амінокислот, амінів, нуклеотидів, нуклеозидів тощо. Біохімічно дезамінування відбувається за участю специфічних ферментів.
Розрізняють кілька типів дезамінування. Окисне дезамінування амінокислот є основним шляхом їх розкладу в організмі, особливо тварин. Приводить до утворення відповідних кетокислот, процес проходить за участю ферментів — оксидаз амінокислот. Окисним шляхом дезамінуються й аміни, шо утворюються в організмі при декарбоксилюванні амінокислот. Значна частина цих амінів токсична, тому дезамінування має важливе значення для їх знешкодження. Дезамінування амінів каталізується амінооксидазами. Оксидази природних амінокислот, крім глутаматдегідрогенази, що дезамінує L-глутамінову кислоту, в тваринних тканинах мало активні. Тому більшість L-амінокислот підлягає непрямому дезамінуванню шляхом попереднього перезмінування з утворенням глутамінової кислоти, яка потім підлягає окислювальному дезамінуванню або іншим перетворенням. Іншими типами дезамінування є відновне, гідролітичне та внутрішньомолекулярне. Відновне дезамінування відбувається шляхом окислювально-відновних реакцій між двома амінокислотами, внаслідок чого обидві амінокислоти дезамінуються (реакція між аланіном і гліцином). При внутрішньомолекулярному дезамінуванні утворюються ненасичені кислоти. Ці реакції мають місце при дезамінуванні ряду амінокислот (наприклад, аспарагінової кислоти у рослин і деяких бактерій; гістидину в печінці людини). При гідролітичному дезамінуванні утворюються D-оксикислоти. Цим шляхом дезамінуються також пуринові основи й піримідинові основи у плісеневих грибів, деяких бактерій і тканинах тварин.
Дезамінування грає важливу роль і в метаболізмі ДНК. Спонтанне дезамінування цитозину в результаті гідролізу перетворює його на урацил, виділяючи в процесі аміак. Це може відбуватися in vitro через використання бісульфатів, при чому перетворюється цитозин, але не 5-метилцитозин. Ця властивість дозволяє дослідникам послідовностей ДНК відрізнити неметильований цитозин (що перетворюється на урацил) і метильований цитозин (залишається незмінним). В ДНК для репарації такого пошкодження урацил видалається і замінюється цитозином відповідно до гуаніну на іншому ланцюжку ДНК. Спонтанне дезамінування 5-метилцитозину приводить до утворення тиміну і аміаку. У ДНК, цей відгук не може бути виправлений, тому що механізми репарації не визнають тимін як помилку (в протилежність урацилу), в результаті чого мутація зберігається. Ці мутації сприяють рідкісності CPG-ділянок в геномам еукаріотів.
Декарбоксилювання - реакція, що лежить в основі перетворення ряду амінокислот у біологічно активні сполуки. Декарбоксилази амінокислот каталізують відщеплення карбоксильної групи у вигляді СО2. Коферментом декарбоксилаз є піридоксальфосфат. Механізм реакції
337
включає також, як і при трансамінуванні, утворення шиффової основи між піридоксальфосфатом і амінокислотою з наступним декарбокси-люванням. Рівновага дуже зміщена праворуч, як показано нижче:
Я - СН2 - СНІЧН2 - СООН-> Я - СН2 - СН2ІЧН2 + СО2
Продуктами декарбоксилювання є аміни, які мають високу біологічну активність, тому їх називають біогенними амінами.
Так, із фенілаланіну, тирозину і триптофану під дією декарбоксилаз ароматичних амінокислот утворюються нейромедіатори і гормони норадреналін і адреналін, тканинні гормони, у рослин - тканинний гормон росту ауксин, у тканинах тварин та людини - серотонін.
Із глутамінової кислоти внаслідок дії глутаматдекарбоксилази утворюється у-аміномасляна кислота (ГАМК)

Ця реакція найактивніше протікає у гальмівних синапсах нервової системи. ГАМК у найбільшій кількості міститься в підкоркових утвореннях головного мозку, особливо у гіпоталамусі.
Із амінокислоти гістидину під впливом специфічного ферменту гістидиндекарбоксилази утворюється гістамін. Особливо багато його утворюється в тканині легень, шкірі, спинному мозку і в підкіркових утвореннях головного мозку.
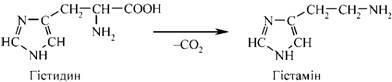
Велика кількість гістаміну утворюється і депонується у тучних клітинах сполучної тканини, де він знаходиться у вигляді білково-гепаринового комплексу. Вивільняється він з тучних клітин внаслідок дії речовин - лібераторів гістаміну.
Гістамін є потужним судинорозширюючим агентом і за високих концентрацій навіть може викликати судинний колапс. Його утворення відбувається при травматичному шоку, а також у зоні запального процесу. Гістамін стимулює секрецію у шлунку як пепсину, так і соляної кислоти.
Знешкодження біогенних амінів відбувається шляхом окислювального дезамінування за участю ферментів амінооксидаз, які бувають двох типів - моноамінооксидази (МАО) і диамінооксидази (ДАО).
338
![]()
Коферментом МАО служить ФАД, а ДАО - піридоксальфосфат (для реакцій необхідні іони Си2+). МАО зв'язаний з мітохондріями клітин, а ДАО знаходиться у цитоплазмі. Невелика кількість цих ферментів є у крові. МАО інактивує первинні, вторинні і третинні аміни, а ДАО - переважно гістамін і деякі інші аміни - похідні диаміномоно-карбонових амінокислот - орнітину (путресцин) та лізину (кадаверин).
Продукти дезамінування біогенних амінів - альдегіди - окислюються за допомогою альдегіддегідрогеназ до органічних кислот.
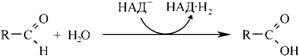
Інактивація катехоламінів адреналіну й норадреналіну здійснюється двома шляхами: за допомогою моноамінооксидази і катехол-0-метилтрансферази, тобто шляхом дезамінування і метилювання.
Отже, безазотисті залишки більшості амінокислот у разі катаболізму проходять стадію утворення піровиноградної кислоти. При цьому деякі амінокислоти перетворюються у піруват безпосередньо (аланін, цистеїн, серин). Інші амінокислоти проходять більш тривалий метаболічний шлях до пірувату: спочатку вони перетворюються у проміжні продукти цитратного циклу, а потім вуглець амінокислот залишає цитратний цикл у складі оксалоацетату, який перетворюється у фосфоєнолпіруват, а потім - у піруват. Після окислювального декарбоксилювання пірувату утворений ацетил-КоА знову потрапляє до цитратного циклу, де окислюється до СО2.
Попередниками глюкози у разі глюконеогенезу є саме піруват, оксалоацетат та фосфоєнолпіруват. Тому амінокислоти, які перетворюються у ці сполуки, можуть бути використані для синтезу глюкози (глюконеогенез з амінокислот); такі амінокислоти називають глікогенними. Глюконеогенез за участю амінокислот відбувається особливо активно при переважно білковому харчуванні, а також голодуванні. В останньому випадку використовуються амінокислоти власних білків тканин. Катаболізм лейцину й лізину не включає стадії утворення піровиноградної кислоти; вуглецева частина перетворюється безпосередньо в ацетооцтову кислоту й ацетил-КоА, з яких синтез вуглеводів неможливий: це кетогенні амінокислоти. Тирозин, фенілаланін, ізолейцин та триптофан є одночасно і глікогенними, і кетогенними. Частина вуглецевих атомів їх молекул при катаболізмі утворює ацетил-КоА, минаючи стадію пірувату.
