
- •Лабораторний практикум
- •Фізична хімія
- •Передмова
- •Оформлення результатів вимірювань
- •Складання таблиць
- •Молярна електрична провідність водних розчинів
- •Побудова графіків
- •Розділ і термохімія
- •Лабораторна робота №1 визначення теплової сталої калориметра
- •Запис вимірювання температури під час досліду
- •Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
- •Визначення теплоти нейтралізації сильної кислоти сильною основою у воді
- •Контрольні питання
- •Будова атома і молекули, електричні та оптичні властивості Рефрактометрія
- •Визначення рефракції речовини і встановлення його структури
- •Контрольні питання
- •Хімічна рівновага
- •Визначення залежності константи рівноваги від температури в гомогенній системі
- •Послідовність виконання роботи
- •Розрахунок рівноважних концентрацій речовин
- •Експерементальні данні
- •Контрольні питання
- •Розділ іv фазові рівноваги
- •Побудова та аналіз діаграм плавкості і3 простою евтектикою
- •Типи термопар
- •Визначення кристалізації речовини 3 розчину при низьких температурах
- •Послідовність виконання роботи
- •Лабораторна робота №7 кристалізація бінарних сумішей (система NaNо3 – kno3)
- •Контрольні питання
- •Розділ V розчини
- •Лабораторна робота №8 розподіл речовини між двома рідкими фазами
- •Послідовність виконання роботи
- •Визначення ступеня асоціації оцтової кислоти в бензолі (чи хлороформі)
- •Вивчення процесу екстрагування
- •Контрольні питання
- •Кріоскопія, ебуліоскопія
- •Установка термометра Бекмана для кріоскопії.
- •Лабораторна робота №11 визначення молекулярної маси речовини кріоскопічним методом
- •Послідовність виконання роботи.
- •Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
- •Послідовність виконання роботи.
- •Завдання до лабораторної роботи
- •Контрольні питання
- •Електрохімія
- •Водневий показник як кількісна характеристика кислотності-основності розчинів
- •Потенціометрія
- •Визначення рН буферних розчинів
- •Послідовність виконання роботи
- •Контрольні питання
- •Хімічна кінетика
- •Вивчення швидкості йодування ацетону
- •Послідовність виконання роботи
- •Контрольні питання
- •Вивчення швидкості інверсії цукру
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Підготовка до роботи поляриметра
- •Контрольні питання
- •Вивчення кінетики розчинення твердої кислоти у воді
- •Дифузія
- •Послідовність виконання роботи
- •Котрольні питання
- •Додатки
- •Значення деяких фундаментальних сталих
- •Знаки деяких математичних дій
- •Множники і префікси для утворення десяткових кратних і дольних одиниць
- •Густина води при різних температурах
- •Питома електрична провідність 0,01м розчину kСl при різних температурах
- •Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при температурі 18°с.
- •Йонні електричні провідності при нескінченному розведені λ∞
- •Йонні електричні провідності при нескінченному розведені при температурі 25°c
- •Література
- •Періодична система елементів д. І. Менделєєва
Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
Мета роботи: визначити молекулярну масу речовини, ебуліоскопічним методом.
Послідовність виконання роботи.
Зібрати прилад, схема якого приведена на рис. 5.3.
Трубку
з внутрішнім діаметром 4![]() 5 мм
розрізати на частини довжиною
18
5 мм
розрізати на частини довжиною
18![]() 20 см.
Кожну трубку витягнути посередині до
діаметра 2
20 см.
Кожну трубку витягнути посередині до
діаметра 2![]() 3 мм
і розрізати у вузькому місці на рівні
частини, для того, щоб одержати трубки
довжиною 6
3 мм
і розрізати у вузькому місці на рівні
частини, для того, щоб одержати трубки
довжиною 6![]() 8 см.
Витягнуті кінці цих трубок запаяти. У
трубку 4 налити приблизно 0,5 мл
досліджуваної рідини і ввести в неї
дуже тонкий капіляр 3 із запаяним кінцем,
зверненим нагору. Пробірку 4 закріпити
за допомогою гумового кільця на
термометрі 1 так, щоб досліджувана рідина
знаходилася на рівні ртутної кульки.
Термометр із пробіркою занурити в
гліцеринову баню з мішалкою 2, закріплену
на азбестовій сітці у штативі і рівномірно
нагріти доти, доки з капіляра 3 не почнуть
виділятися пухирці. Ця температура
відповідає температурі кипіння
досліджуваної рідини.
8 см.
Витягнуті кінці цих трубок запаяти. У
трубку 4 налити приблизно 0,5 мл
досліджуваної рідини і ввести в неї
дуже тонкий капіляр 3 із запаяним кінцем,
зверненим нагору. Пробірку 4 закріпити
за допомогою гумового кільця на
термометрі 1 так, щоб досліджувана рідина
знаходилася на рівні ртутної кульки.
Термометр із пробіркою занурити в
гліцеринову баню з мішалкою 2, закріплену
на азбестовій сітці у штативі і рівномірно
нагріти доти, доки з капіляра 3 не почнуть
виділятися пухирці. Ця температура
відповідає температурі кипіння
досліджуваної рідини.
Дослід проводити двічі і взяти середнє значення температури кипіння (розбіжності рівнобіжних дослідів не повинні перевищувати 0,5°С). Дослідні дані записати в таблицю 5.4.
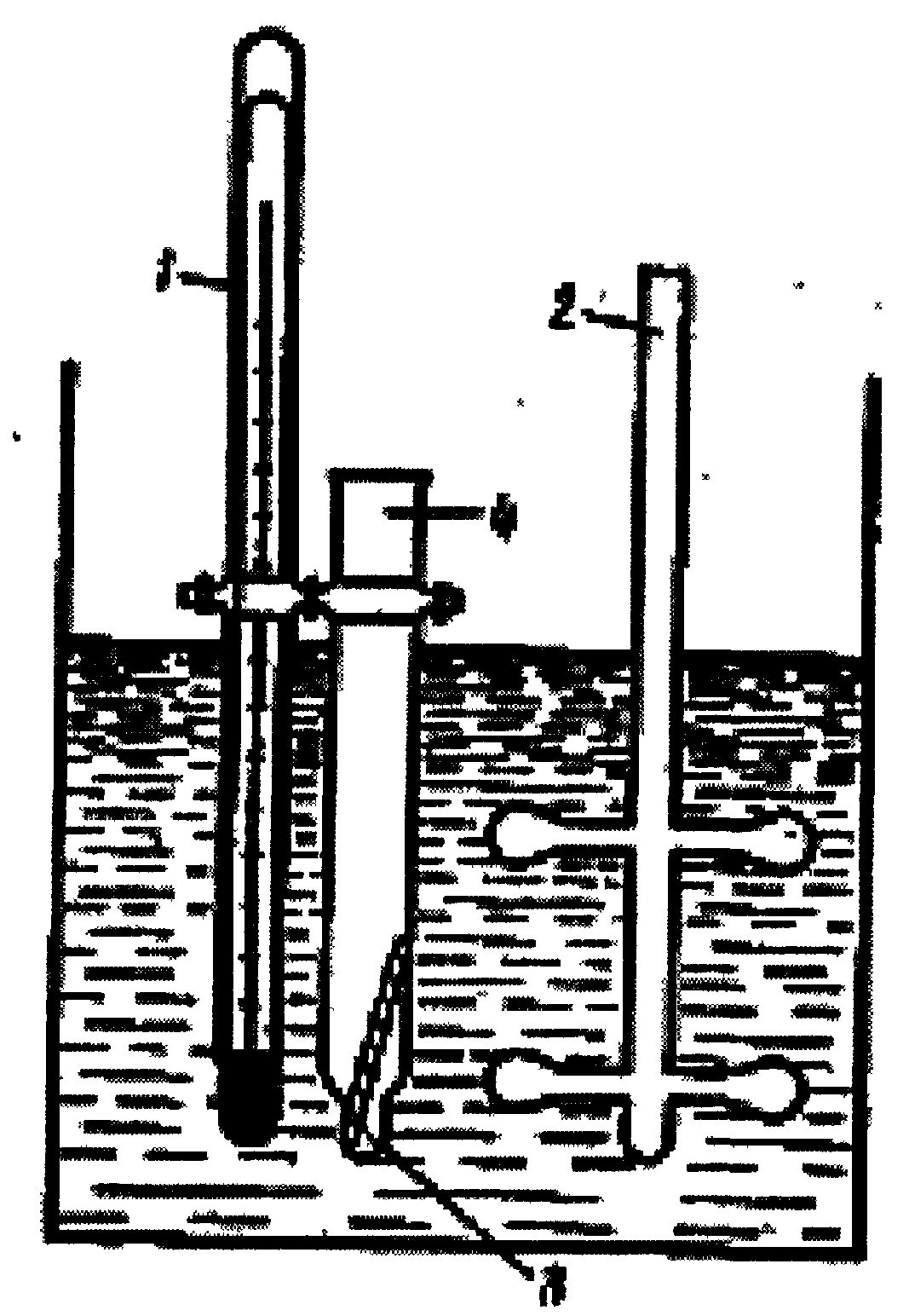
Рис.5.3. Схема приладу визначення температури кипіння по Сиволобову
Таблиця 5.4
|
Параметри |
Розчинник
|
Розчин
|
Похибка досліду
|
|
Температура кипіння, °С при даному тиску |
|
|
|
|
Температура кипіння, °С при 760мм.рт.ст. |
|
|
|
|
Середнє значення температури при нормальних умовах Тн.т.к. |
|
|
|
|
Розрахункове значення КЕ |
|
|
|
|
Довідкове значення КЕ |
|
|
|
|
Концентрація чи молекулярна маса |
|
|
|
Завдання до лабораторної роботи
1. Необхідно привести температури кипіння до нормальних умов. Перерахунки виконуються за рівнянням:
tk = 0,00012 (760 - Р) (273 + to) (5.14)
де tk і to - температури кипіння при даному і нормальному тисках, °С;
Р — атмосферний тиск у момент проведення досліду.
2. Розрахувати сховану теплоту випаровування досліджуваної рідини, застосовуючи рівняння Трутона:
|
|
(5.15) |
чи більш точне рівняння Кістяковського:
|
|
(5.16) |
3. Розрахувати ебуліоскопічну сталу і порівняти її з табличними даними.
![]() (5.17)
(5.17)
4. Розрахувати на основі отриманих даних для одного кіломоля досліджуваної речовини величини Н, U, S, Z, F випаровування при температурі кипіння.
Контрольні питання
Що називається розчином? Розчини ідеальні та істинні, їх особливості.
Як залежить тиск насиченої пари розчину від концентрації розчиненої речовини при даній температурі?
Чому дорівнює відносна зміна тиску пари над розчином при даній температурі?
Яким чином проходять криві залежності тиску пари розчину нелеткої речовини різних концентрацій від температури, якщо їх наносити на діаграму стану чистого розчинника? Показати графічно, як змінюється температура замерзання розчинів, у залежності від їхньої концентрації.
Кріоскопічна стала і її фізичний зміст. Чи залежить кріоскопічна стала від природи розчиненої речовини? Як визначається експериментально і розрахунковим шляхом кріоскопічна стала?
Чи буде відрізнятися температура замерзання 1М розчину хлориду натрію у воді від температури замерзання 1М розчину цукру у воді?
Термометр Бекмана і правила роботи з ним.
Як визначити молекулярну масу розчиненої речовини кріоскопічним методом?
Чим відрізняються залежності зниження температури замерзання розчинів від їхньої концентрації для неелектроліту й сполуки, здатного до електролітичної дисоціації або асоціації?
Чим визначається ізотонічність розчину? Яке фізіологічне значення має ця характеристика рідин для фармакологічних досліджень?
Яка фізико-хімічна сутність поняття осмотичного тиску розчину? У яких одиницях виміряється ця величина? На чому заснована пряма пропорційність між і m? Довести це графічно.
Як зв'язана між собою молярна й моляльна концентрації розчинів?
Чому для проведення кріометрических вимірів використається диференціальний термометр Бекмана, а не звичайний інтегральний термометр?
Який фізичний зміст поняття осмотична концентрації?
Розчин, що містить 0,85 мл хлориду цинку в 125 мл води, кристалізується при T3 = 272,92 К. Визначите ступінь електролітичної дисоціації цієї сполуки, якщо Т03=273,15 К. Відповідь: 74 %.
Ізотонічні або 0,6 % розчин сечовини й 0,05 М розчин хлориду натрію, якщо останній повністю дисоційован? (
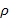 =1,00г/моль).
Відповідь:
Так.
=1,00г/моль).
Відповідь:
Так.
Розділ VI
