
- •Міністерство освіти і науки, молоді та спорту україни
- •Cтуденти повинні знати:
- •Студенти повинні вміти:
- •Рекомендована література
- •Окисно-відновні реакції Реакції, в яких відбувається зміна ступенів окиснення атомів елементів, що входять до складу реагуючих сполук, називаються окисно-відновними:
- •Розрахунок ступеня окиснення
- •Класифікація окисно-відновних реакцій
- •1. Міжмолекулярні окисно-відновні реакції. Окисник і відновник знаходяться в різних речовинах; обмін електронами в цих реакціях відбувається між різними атомами чи молекулами:
- •Складання рівнянь окисно-відновних реакцій
- •Хімічні джерела енергії
- •Акумулятори
- •Паливні елементи
- •Електроліз
- •Корозія металів. Методи захисту від корозії
- •Приклади розв’язання типових задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •0,01 Моль/л 0,02 моль/л
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Варіанти завдань для самостійної роботи
- •Контрольні індивідуальні завдання
- •Експрес-тести Тема: Окисно-відновні реакції Тест № 1
- •Тест № 2
- •Тест № 3
- •Тест № 4
- •Тест № 5
- •Тест № 6
- •Тест №7
- •Тест № 8
- •Експрес-тести Тема: Гальванічні елементи. Електроліз Тест № 1
- •Тест № 2
- •Тест № 3
- •Тест № 4
- •Тест № 5
- •Тест № 6
- •Контрольні завдання
- •Контрольне завдання № 3
- •Контрольне завдання № 4
- •Контрольне завдання № 5
- •Контрольне завдання № 6
- •Контрольне завдання № 7
- •Контрольне завдання № 8
- •Тема: Електроліз. Корозія
- •Відповіді
- •Додатки
- •1. Стандартні електродні потенціали металів у водних розчинах
- •2. Стандартні окисно-відновні потенціали деяких окисно-відновних систем у водних розчинах
- •73008, М. Херсон, Бериславське шосе, 24
Акумулятори
Гальванічні елементи оборотної та багаторазової дії називають акумуляторами. Вони здатні при розряджанні перетворювати накопичену хімічну енергію на електричну (як гальванічний елемент), а при заряджанні електричну – на хімічну (як електролізер). Найбільше застосування мають свинцевий (кислотний) та лужні акумулятори. Свинцевий акумулятор складається з свинцево-стибієвих перфорованих пластинок. Отвори пластинок заповнюють пастою PbO i 2PbO · PbO2. Електролітом служить 35 % розчин сульфатної кислоти.
Розглянемо принцип дії свинцевого акумулятора, схему якого можна записати так:
А(–)Рb/Н2SO4/PbO2(+)K.
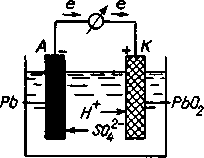
Рис.2 . Схема роботи свинцевого акумулятора
при заряджанні та розряджанні
Під час заряджання, коли через акумулятор пропускають постійний електричний струм, на електродах відбуваються такі електрохімічні процеси (рис. 2):
На катоді (–): PbSO4 + 2е → Pb + SO42–.
На аноді (+): PbSO4 + 2Н2О – 2е → РbО2 + 4Н+ + SO42–.
Під час розряджання акумулятора на електродах відбуваються протилежні процеси (рис. 2):
На аноді (–): Pb + SO42– – 2е → PbSO4. φ° = 0,36 В.
На катоді (+): РЬО2 + 4Н+ + SO42–+ 2е → PbSO4 + 2Н2О. φ°= 1,68 В.
Загальне рівняння реакції роботи свинцевого акумулятора має вигляд
розряджання
Pb + 2H2SO4 + РbO2 ⇄ 2 PbSO4 + 2H2O.
заряджання
ЕРС акумулятора E° = φ°кат – φ°ан = 1,68 – (– 0,36) = 2,04 В.
В лужних акумуляторах отвори залізних пластинок заповнені Ni2O3 H2O (або Ni(OH)3) у суміші з порошком графіту та порошком відновленого заліза. Заряджання й розряджання лужного залізо-нікелевого акумулятора відбувається за схемою
розряджання
Fe + 2Ni(OH)3 ⇄ Fe(OH)2 + 2Ni(OH)2.
заряджання
Напруга цього акумулятора при його розряджанні становить близько 1,3 В.
Паливні елементи
Паливні елементи – нові джерела електричного струму. В них електричний струм виникає в результаті хімічної взаємодії горючих речовин (водню, бензину, природного газу, коксу тощо) з окисниками (кисень, повітря, хлор), які безперервно подаються ззовні до електродів, а продукти реакції безперервно відводяться.
Прикладом може бути воднево-кисневий елемент, який складається з дрібнопористих вугільних або нікелевих електродів, занурених у лужний розчин електроліту: А(–) (Ni)H2/KOH/O2(Ni) (+)K
А: 2Н2 + 4ОН– – 4е = 4Н2О
К: О2 + 2Н2О + 4е = 4OH–
2Н2 + O2 = 2Н2O .
Водень дифундує крізь пористий електрод з каталізаторами (Pt, Pd), кисень – крізь другий електрод зі змішаними каталізаторами (Co і Аl або Fe, Mn і Ag). Воднево-кисневі елементи генерують струм 500...700 мА на 1 см2 активної поверхні електродів при напрузі близько 1 В та ККД 60...70 %.
Електроліз
Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту. Електрод, на якому при електролізі відбувається відновлення, називається катодом, на якому здійснюється процес окиснення, – анодом. На електроліз впливає матеріал електродів і склад електроліту. Тому необхідно розглядати окремо процеси електролізу розплавів і розчинів, а також процеси електролізу з інертним і розчинним анодами.
Інертні аноди виготовляють із платини, іридію або їх сплавів, а також із графіту або вугілля. У процесі електролізу вони не розчиняються. Найпростішим прикладом є електроліз розплаву натрій хлориду: NaCl ⇄ Na+ + Cl–
(–) на катоді: Na+ + ē = Na;
(+) на аноді: 2Cl– – 2ē = Cl2
Якщо система містить різні окисники, то на катоді будуть відновлюватися більш активні з них, тобто з найбільшим електродним потенціалом.
При цьому на катоді можливі три випадки:
1. Першими на катоді відновлюються окисники, у яких електродні потенціали вищі, ніж потенціал водневого електрода. Це, наприклад, йони Au+, Ag+, Cu2+, йони платинових металів. Відновлення відбувається за схемою:
Mez+ + zē = Me.
2. На катоді йде розрядка катіонів металів, потенціал яких нижчий, ніж у водневого електрода, але виший, ніж у алюмінієвого (від Mn2+ до Sn2+). Одночасно з ними можливе відновлення йонів Гідрогену (в кислому середовищі):
2Н+ + 2ē = Н2
і відновлення молекул води (в нейтральному і лужному середовищі):
2Н2О + 2ē = 2ОН– + Н2
3. Катіони металів, у яких потенціали нижчі, ніж у алюмінію (від Li+ до Al3+) із водних розчинів на катоді не відновлюються. Замість них відновлюються молекули води: 2Н2О + 2ē = 2ОН– + Н2.
Характер реакцій на аноді залежить від присутності води, pH середовища і матеріалу анода.
У водних розчинах електролітів на інертному аноді спочатку окиснюються найбільш сильні відновники, тобто речовини з найбільш негативним потенціалом, наприклад, сульфід-йон, галогенід-йони та ін. Потім у лужному середовищі окиснюються гідроксид-йони:
4ОН– = О2 + 2Н2О + 4ē φ0 = 0,401 В;
у кислому або нейтральному середовищі окиснюються молекули води, якщо в розчині є оксигенвмісні аніони SO42–, NO3–, ClO3–, PO43–:
2H2O = O2 + 4H+ + 4ē φ0 = 1,228 B.
Послідовність окиснення аніонів і молекул на інертному аноді можна показати у вигляді такого ряду:
|
S2-, I-, Br-, Cl-, OH-, H2O |
SO |
|
|
у водних розчинах не окиснюються |
При проведенні електролізу з активним анодом матеріал аноду розчиняється: Me = Mez+ + zē.
Кількісно процеси електролізу визначаються законом Фарадея: маса електроліту, що піддалася перетворенню при електролізі, а також маси речовин, що утворяться на електродах, прямо пропорційні кількості електрики, що пройшла через розчин чи розплав електроліту, і молярним масам еквівалентів відповідних речовин. Закон Фарадея виражається наступним рівнянням:
m = ME I t / F,
де m – маса речовини, що утворилась чи піддалася перетворенню, г; ME – його молярна маса еквівалентів, г/моль; I – сила струму, А; t – час, с; F – стала Фарадея (96485 Кл/моль), тобто кількість електрики (Q = I · t ), яка необхідна для здійснення електрохімічного перетворення одного моля еквівалентів речовини.
