
- •Міністерство освіти і науки, молоді та спорту україни
- •Cтуденти повинні знати:
- •Студенти повинні вміти:
- •Рекомендована література
- •Окисно-відновні реакції Реакції, в яких відбувається зміна ступенів окиснення атомів елементів, що входять до складу реагуючих сполук, називаються окисно-відновними:
- •Розрахунок ступеня окиснення
- •Класифікація окисно-відновних реакцій
- •1. Міжмолекулярні окисно-відновні реакції. Окисник і відновник знаходяться в різних речовинах; обмін електронами в цих реакціях відбувається між різними атомами чи молекулами:
- •Складання рівнянь окисно-відновних реакцій
- •Хімічні джерела енергії
- •Акумулятори
- •Паливні елементи
- •Електроліз
- •Корозія металів. Методи захисту від корозії
- •Приклади розв’язання типових задач
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •0,01 Моль/л 0,02 моль/л
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Розв'язання
- •Варіанти завдань для самостійної роботи
- •Контрольні індивідуальні завдання
- •Експрес-тести Тема: Окисно-відновні реакції Тест № 1
- •Тест № 2
- •Тест № 3
- •Тест № 4
- •Тест № 5
- •Тест № 6
- •Тест №7
- •Тест № 8
- •Експрес-тести Тема: Гальванічні елементи. Електроліз Тест № 1
- •Тест № 2
- •Тест № 3
- •Тест № 4
- •Тест № 5
- •Тест № 6
- •Контрольні завдання
- •Контрольне завдання № 3
- •Контрольне завдання № 4
- •Контрольне завдання № 5
- •Контрольне завдання № 6
- •Контрольне завдання № 7
- •Контрольне завдання № 8
- •Тема: Електроліз. Корозія
- •Відповіді
- •Додатки
- •1. Стандартні електродні потенціали металів у водних розчинах
- •2. Стандартні окисно-відновні потенціали деяких окисно-відновних систем у водних розчинах
- •73008, М. Херсон, Бериславське шосе, 24
Складання рівнянь окисно-відновних реакцій
A. Електронний баланс – метод знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, у якому розглядається обмін електронами між атомами елементів, що змінюють свій ступінь окиснення. Кількість електронів, відданих відновником, дорівнює кількості електронів, одержаних окисником.
Рівняння складається в кілька стадій:
Записують схему реакції.
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
Проставляють ступені окиснення над знаками елементів, що міняються.
K![]() O4
+ H
O4
+ H![]() ®
KCl +
®
KCl +
![]() Cl2
+
Cl2
+
![]()
+ H2O
+ H2O
Виділяють елементи, що змінюють ступені окиснення, і визначають число електронів, придбаних окисником і відданих відновником.
![]() +
5ē ®
+
5ē ®
![]()
2![]() –
2ē ®
–
2ē ®
![]()
Зрівнюють число придбаних і відданих електронів, установлюючи тим самим коефіцієнти для сполук, у яких присутні елементи, що змінюють ступінь окиснення.
|
|
2 |
|
2 |
5 |
––––––––––––––––––––––––
2![]() +
10
+
10![]() ®
2
®
2![]() +
5
+
5![]()
Підбирають коефіцієнти для всіх інших учасників реакції.
2K![]() O4
+ 16H
O4
+ 16H![]() ®
2KCl + 2
®
2KCl + 2![]() Cl2
+ 5
Cl2
+ 5![]() +
8H2O
+
8H2O
B. Електронно-йонний баланс (метод напівреакцій) – метод знаходження коефіцієнтів, у якому розглядається обмін електронами між йонами в розчині з урахуванням характеру середовища:
|
2Cl– – 2ē ® |
Cl20 |
|
5 |
|
MnO4– + 8H+ |
+ 5ē ® |
Mn2+ + 4H2O |
2 |
––––––––––––––––––––––––––––––––––––––
10Cl– + 2MnO4– + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для зрівняння йонної напівреакції використовують H+, OH– чи воду).
Хімічні джерела енергії
Гальванічний елемент – пристрій, в якому хімічна енергія окисно-відновної реакції перетворюється на електричну. Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму).
У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого менший, ніж потенціал катода. Анод має заряд “–“, катод – заряд “+”.
Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури і обчислюється за рівнянням Нернста:
φ
= φ0
+
![]()
де φ0 – стандартний електродний потенціал, В; R – універсальна газова стала, R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F – стала Фарадея, F = 96485 Кл/моль; cМеz+ – молярна концентрація йонів металу в розчині, моль/л. При Т = 298 К рівняння Нернста має вигляд:
φ
= φ0
+
![]()
Електрорушійна сила (ЕРС) процесу для гальванічного елементу визначається як різниця між потенціалами катода φк і анода φа:
ЕРС = φк – φа
Прикладом гальванічного елемента є мідно-цинковий елемент Данієля-Якобі, що складається з цинкової та мідної пластинок, занурених в розчини цинк сульфату і купрум(ІІ) сульфату з молярними концентраціями 1 моль/л (рис. 1).
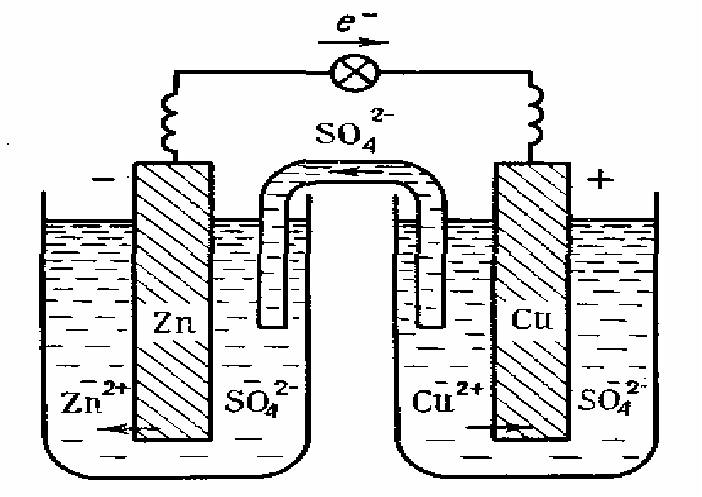
Рис. 1. Схема гальванічного елемента Данієля-Якобі
Цинковий електрод є анодом, на якому проходить окиснення цинку:
Zno = Zn2+ + 2ē.
Мідний електрод – катод, на якому проходить відновлення йонів Купруму з розчину:
Cu2+ + 2ē = Cuo
Сумарне рівняння процесу в йонному вигляді:
Zno + Cu2+ = Cuo + Zn2+,
або в молекулярній формі:
Zn + CuSO4 = Cu + ZnSO4
Схематичний запис гальванічного елемента:
Анод (–) Zn ZnSO4 CuSO4 Cu (+) Катод
За стандартних умов та при концентраціях електролітів 1 моль/л ЕРС гальванічного елемента:
![]() =
0,345 – (–0,763) = 1,108 В.
=
0,345 – (–0,763) = 1,108 В.
(![]() =
0,345 В,
=
0,345 В,![]() = –0,763 В
(додаток 1)).
= –0,763 В
(додаток 1)).
При роботі гальванічного елемента електрохімічна система з найбільшим значенням електродного потенціалу є окисником, а з найменшим – відновником. Таким чином, порівнюючи електродні потенціали відповідних систем можливо визначити напрямок протікання реакції від більшого к меньшому електродному потенціалу. Як і при інших самодовільних процесах, реакція, що протікає в гальванічному елементі, супроводжується зменьшенням енергії Гіббса.
