
- •1. Распространение микроорганизмов в среде. Понятия биоциноз. Какие они бывают.
- •2. Антитоксин, антигенные свойства. Антигенные свойства вирусов.
- •1. Классификация и морфология грибов. Классификация, строение и физиология грибов.
- •2. Токсины и эндотоксины. Классификация. Токсины бактерий, их природа, свойства, получение.
- •3. Риккетсии
- •Краткая характеристика рода Rickettsia (da Rocha-Lima, 1916)
- •1. Антибиотики, история создания, классификация. Антибиотики (природные и синтетические). Источники и способы получения. Классы антибиотиков.
- •2. Вакцинотерапия, вакцинопрофилактика. Классификация Вакцины, определение. Классификация. Требования, предъявляемые к вакцинным препаратам.
- •1. Фазы репродукции вирусов, бактерий Типы взаимодействия вируса с клеткой. Фазы репродукции вирусов.
- •2. Реакция связывания комплемента Реакция связывания комплемента. Механизм. Компоненты. Применение.
- •1. Методы физического воздействия на бактерию
- •2. Пцр Молекулярно-биологические методы, используемые в диагностике инфекционных болезней (пцр, рестрикционный анализ и др.).
- •1. Антибиотики. Классификация. Антибиотики (природные и синтетические). Источники и способы получения. Классы антибиотиков.
- •3. Онкогенные вирусы 2. Классификация и характеристика онкогенных вирусов.
- •1. Метаболизм бактерий. Ферменты. Роль биохимической активности бактерий Метаболизм микроорганизмов.
- •3. Хламидии. Род Chlamydia и род Chlamydophila.
- •1. Идентификация, инициация вирусов
- •2. Фагоцитоз Фагоцитоз и его стадии. Причины незавершенного фагоцитоза.
- •3. Вирусы геморрагических лихорадок
- •1. Питание бактерий, классификация, классификация питательных сред. Питание бактерий. Фазы роста бактерий на питательных средах.
- •3. Классификация питательных сред и основные требования к ним.
- •2. Иммунный статус, свойства. Понятие об иммунном статусе человека. Оценка иммунного статуса: основные показатели и методы их определения.
- •3. Клебсиелы, классификациия, роль в патологии человека. Род Klebsiella.
- •1. Санитарная микробиология.
- •2. Иммунный ответ, что происходит в организме при попадании антигена, влияние цитокинов
- •3. Буньявирусы
- •1. Методы культивирования бактериофагов. Роль фагов в микробиологии и медицине. Бактериофаги, их строение, классификация и пути взаимодействия с клеткой.
- •2. Живая вакцина. Методы получения. Использование. Достоинства и недостатки. Живые вакцины, получение, применение. Достоинства и недостатки.
- •3. Гепатит в, с, д, g, tt. Возбудители вирусных кровяных инфекций: гепатита в, гепатита с.
- •1. Типы окисления - про аэробы, анаэробы. Дыхание микроорганизмов.
- •2. Иммуноглобулины. Иммуноглобулины, структура и функции. Классы иммуноглобулинов.
- •3. Коронавирусы.
- •1. Методы культивирования микоплазм, риккетсий, хламидий. Среды, методика.
- •3. Филовирусы.
- •1. Понятие о химиотерапевтическом лечении вирусных инфекции. Понятие о химиотерапии. История открытия химиопрепаратов.
- •2. Роль микроба возбудителя в развитии инфекционного заболевания. Патогенность. Вирулентность. Факторы патогенности.
- •3.Бордетеллы Род Bordetella.
- •1. Микрофлора пищевода
- •2. Иммунологические препараты. Получение. Применение. Понятие об иммуномодуляторах. Принципы действия. Применение.
- •1. Гемофилы
В 28 билете нет 2 и 3 вопроса в 31 билете нет 1 и 2 в 35 билете нет 1 в 38 нет 1 и 3 40 билета нет вообще в 42 нет 3 в 43 нет 1 в 44 нет 3 в 45 нет 2 в 46 нет1 в 47 нет 1
Билет 28
Основные этапы окисления субстрата, аэробы, анаэробы
Дыхание микроорганизмов.
Путем дыхания микроорганизмы добывают энергию. Дыхание- биологический процесс переноса электронов через дыхательную цепь от доноров к акцепторам с образованием АТФ. В зависимости от того, что является конечным акцептором электронов, выделяют аэробное и анаэробное дыхание. При аэробном дыхании конечным акцептором электронов является молекулярный кислород (О2), при анаэробном- связанный кислород ( -NO3 , =SO4, =SO3).
Примеры.
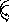 О2
О2
А эробное
дыхание донор водородаH2O
эробное
дыхание донор водородаH2O
Анаэробное дыхание
н итратное
окислениеNO3
итратное
окислениеNO3
( факультативные
анаэробы) донор водородаN2
факультативные
анаэробы) донор водородаN2
с ульфатное
окислениеSO4
ульфатное
окислениеSO4
( облигатные
анаэробы) донор водородаH2S
облигатные
анаэробы) донор водородаH2S
По типу дыхания выделяют четыре группы микроорганизмов.
1.Облигатные (строгие) аэробы. Им необходим молекулярный (атмосферный) кислород для дыхания.
2.Микроаэрофилы нуждаются в уменьшенной концентрации (низком парциальном давлении) свободного кислорода. Для создания этих условий в газовую смесь для культивирования обычно добавляют CO2, например до 10- процентной концентрации.
3.Факультативные анаэробы могут потреблять глюкозу и размножаться в аэробных и анаэробных условиях. Среди них имеются микроорганизмы, толерантные к относительно высоким (близких к атмосферным) концентрациям молекулярного кислорода - т.е. аэротолерантные, а также микроорганизмы которые способны в определенных условиях переключаться с анаэробного на аэробное дыхание.
4.Строгие анаэробы размножаются только в анаэробных условиях т.е. при очень низких концентрациях молекулярного кислорода, который в больших концентрациях для них губителен. Биохимически анаэробное дыхание протекает по типу бродильных процессов, молекулярный кислород при этом не используется.
Аэробное дыхание энергетически более эффективно (синтезируется большее количество АТФ).
В процессе аэробного дыхания образуются токсические продукты окисления (H2O2- перекись водорода, -О2 - свободные кислородные радикалы), от которых защищают специфические ферменты, прежде всего каталаза, пероксидаза, пероксиддисмутаза. У анаэробов эти ферменты отсутствуют, также как и система регуляции окислительно- восстановительного потенциала (rH2). Дыхание, или биологическое окисление, основано на окислительно-восстановительных реакциях, идущих с образованием АТФ-универсального аккумулятора химической энергии. Энергия необходима микробной клетке для ее жизнедеятельности. При дыхании происходят процессы окисления и восстановления: окисление — отдача донорами (молекулами или атомами) водорода или электронов; восстановление — присоединение водорода или электронов к акцептору. Акцептором водорода или электронов может быть молекулярный кислород (такое дыхание называется аэробным) или нитрат, сульфат, фумарат (такое дыхание называется анаэробным — нитратным, сульфатным, фумаратным). Анаэробиоз (от греч. аег — воздух + bios — жизнь) — жизнедеятельность, протекающая при отсутствии свободного кислорода. Если донорами и акцепторами водорода являются органические соединения, то такой процесс называется брожением. При брожении происходит ферментативное расщепление органических соединений, преимущественно углеводов, в анаэробных условиях. С учетом конечного продукта расщепления углеводов различают спиртовое, молочнокислое, уксуснокислое и другие виды брожения.По отношению к молекулярному кислороду бактерии можно разделить на три основные группы: облигатные, т.е. обязательные, аэробы, облигатные анаэробы и факультативные анаэробы.
Периоды и динамика инфекционных болезней
Кампилобактерии, хеликобактерии
Билет 29
Химические и физические методы действия на бактерии. Дезинфекция. Стерилизация.
Стерилизация — уничтожение различных микроорганизмов и их спорс помощью физических и химических факторов. К физическим факторам стерилизации относятся высокая температура, ультрафиолетовые лучи, ионизирующие излучения,ультразвукифильтрованиечерез бактериальные фильтры. В лабораторной практике стерилизация с помощью высокой температуры достигается прокаливанием на пламени, прогреванием сухим жаром, кипячением, обработкой текучим паром или паром под давлением.Стерилизация на пламени является простым и надежным методом для обработки различных термоустойчивых объектов: игл, бактериальных петель, микробиологических шпателей, пипеток, предметных и покровных стекол, пинцетов и т. п. Стерилизация сухим жаром производят в сушильном шкафу (печь Пастера). Этим методом стерилизуют только сухие предметы — лабораторную посуду,перевязочный материали т. п. Сушильный шкаф представляет собой небольшой железный шкаф, с двойными стенками, между которыми вложен теплоизоляционный материал (асбест, стекловата). Чисто вымытые пробирки и флаконы закупоривают ватными пробками; пипетки, вату, марлю заворачивают в бумагу и помещают на полки шкафа так, чтобы стерилизуемые предметы не касались горячих стенок прибора и нагретый воздух свободно проникал между ними. Стерилизация в сушильном шкафу продолжается 45 минут — 1 час при t° 160—170°, При температуре выше 175° бумага и вата сгорают. Кипячение в воде уничтожает неспоровые формы микробов за 1—3 мин.Шприцы, иглы, ножи, небольшие инструменты и т. п. можно кипятить в металлических стерилизаторах и даже в обычной кастрюле. Прибавление к воде небольшого количества гидрокарбоната натрия (двууглекислойсоды) повышает эффективность стерилизации. Флаконы, пробирки или ампулы с жидкостью можно стерилизовать кипячением в водяной бане (рис. 5). Однократное кипячение не уничтожает спор микробов, поэтому при необходимости применяется фракционная стерилизация, т. е. кипячение по 30—40 минут в течение трех дней подряд Стерилизация паром под давлением — наиболее надежный способ стерилизации; при однократной обработке материала уничтожаются не только вегетативные формы бактерий, но и их споры. Стерилизация паром под давлением проводят в специальных приборах — автоклавах под давлением до 1 избыточной атмосферы (am), что соответствует t° 119—120°. Таким путем в течение 15—20 мин. производят стерилизацию заразного материала, посуды, приборов, особенно имеющих резиновые части, питательных сред, не содержащих нативного белка и углеводов. Основные части автоклава: кожух, водопаровая камера, стерилизационная камера, крышка с резиновой прокладкой. Водопаровая камера из специальной высококачественной; стали предназначена для получения пара. Предназначенный для стерилизации материал помещают в стерилизационную камеру. Массивная крышка с резиновой прокладкой наглухо закрывает водопаровую камеру. Система подачи нагретого пара отделена от стерилизационной камеры. Пар подается в стерилизационную камеру через патрубок от котелка, снабженного электронагревательным элементом с регулятором степени нагрева. К автоклаву придается арматура: манометр с сифонной трубкой и трехходовым краном, водомерная стеклянная трубка для измерения уровня воды в водопаровой камере автоклава, предохранительный клапан для предупреждения чрезмерного повышения давления в автоклаве, воздушный и спускной краны для удаления воздуха в начале стерилизации и для удаления конденсата из стерилизационной камеры.Лучевая (холодная) стерилизация — метод, при котором в качестве стерилизующего агента применяются некоторые виды ионизирующих излучений, пригодных для стерилизациипищевых продуктов,перевязочных материалов, лечебных и диагностических препаратов, антибиотиков, вакцин. Для стерилизации обычно используютгамма-излучениярадиоактивных веществ иэлектронывысоких энергий, полученные на ускорителях. Для получения стерилизующего эффекта необходимы высокие дозы облучения. Так, для гибели дрожжевых клеток необходимо облучение в дозе 200 000 р, а бактерий кишечной группы — 400 000—600 000 р. Для обеспложивания материалов, содержащихспоры бактерий, необходимы еще большие дозы — 1,5— 2,5 млн. р. Стерилизация ультрафиолетовым облучением проводится с помощью любого источника ультрафиолетовых лучей, чаще всего бактерицидных ламп. Бактерицидные лампы можно применять для обеззараживания воздуха и поверхностей помещений, различных предметов и оборудования, воды и пищевых продуктов. При работе с бактерицидными лампами, когда они находятся вполе зрения, надо обязательно защитить глаза специальными очками и иметь в виду, что облучение бактерицидной лампой может вызвать ожог кожи лица и рук. Стерилизация при помощи бактериальных фильтров применяется в тех случаях, когда стерилизуемые растворы (среды) не переносят нагревания, когда необходимо удалить микробы из той или иной жидкости, существенно не нарушив ее состава и свойств. Например, фильтруют воду, загрязненную микробами, мочу, асцитическую жидкость, кровяную сыворотку, а также бульонные культуры для получения содержащихся в бульоне продуктов обмена веществ бактерий (микробные яды, антибиотики и пр.). Послефильтрованиявсе эти жидкости оказываются стерильными, так как фильтры надежно задерживают микробы. Контроль стерилизации. Эффективность стерилизации контролируют химическими индикаторами (веществами, имеющими определенную точку плавления), реже — биологической пробой. При первом способе вещество-индикатор, смешанное с каким-нибудь красителем, в запаянной стеклянной трубочке помещают в автоклав и по его расплавлению и окрашиванию определяют температуру, при которой проводили стерилизацию. Для этой цели употребляют бензонафтол (t° плавления 110°), антипирин (t° плавления 110— 112°), резорцин(t° плавления 110°),серу(t° плавления 120°), бензойную кислоту (t° плавления 121,7°). При втором способе внутрь автоклава в стерильной упаковке кладут шелковые нити, смоченные споровым материалом; после окончания стерилизации их переносят напитательные средыи выращивают в течение 2—3 суток при t° 37°. Отсутствие роста указывает на хорошее качество обработки материала.
Дезинфекция - это умерщвление на объектах или удаление с объектов патогенных микроорганизмов и их переносчиков.Дезинфекция включает работы по обеззараживанию помещений, оборудования, мебели, транспорта, посуды, белья, игрушек, изделий медицинского назначения, предметов ухода за больными, пищевых продуктов, остатков пищи, выделений, технологического оборудования по переработке сырья и продуктов, санитарно-технического оборудования, посуды из-под выделений, одежды, обуви, книг, постельных принадлежностей, питьевых и сточных вод, территории и т.д.
Дезинфекция – это комплекс мероприятий, направленных на удаление или уничтожение возбудителей заразных болезней в среде, окружающей человека, в том числе и в живых организмах (членистоногие и грызуны). Основная цель дезинфекции – не допустить распространения инфекционных болезней. Различают такие дезинфекционные мероприятия как собственно дезинфекция, дезинсекция и дератизация.В общем случае дезинфекция – это процесс удаления или уничтожения патогенных микроорганизмов на предметах окружающей среды и разнообразных объектах. Дезинфекцию можно разделить на профилактическую и очаговую. Профилактическая дезинфекция - это обеззараживание тех объектов, где лишь предполагается наличие патогенных возбудителей (к ней можно отнести хлорирование водопроводной воды). Очаговая дезинфекция (текущая и заключительная) производится непосредственно в очаге инфекционного заболевания, то есть там, где находится (или же находился) инфекционный больной, например, в квартире или инфекционной отделении. Рядом с инфекционным больным проводят текущую дезинфекцию, основной целью которой является уничтожение патогенных микроорганизмов, которые выделяются из организма больного.Объектами текущей дезинфекции являются белье и постельные принадлежности, выделения больного и предметы ухода за ним. Заключительная дезинфекция проводится в очаге после удаления из него источника инфекции с целью уничтожения возбудителей заболевания, которые, возможно, остались в помещении, где находился больной. В инфекционном отделении она может проводиться после выписки больного, либо после его смерти. Обеззараживание объектов следует проводить следующими способами: орошением дезинфицирующим раствором поверхностей помещений, оборудования, мебели, транспорта и других; направленным нанесением на поверхности аэрозолей дезинфицирующих растворов с помощью распылителей, обеспечивающих преимущественно мелкокапельное распыление жидкости; обработкой аэрозолями дезинфицирующих средств герметичных помещений (боксы, транспорт и т.д.) объемным методом; протирание ветошью, смоченной дезинфицирующим раствором, поверхностей мебели, оборудования, игрушек, изделий медицинского назначения, предметов ухода за больными, пищевых продуктов и т.д. ;погружением в дезинфицирующий раствор посуды, белья, игрушек, изделий медицинского назначения, предметов ухода за больными, пищевых продуктов и т.д. обработкой дезинфицирующими средствами в форме порошков, гранул или их концентрированными растворами выделений, остатков пищи, трупов, мусоросборников, почвы и т.д.; обработкой паровоздушной смесью, паром, пароформалиновой смесью, горячим воздухом в камерах: одежды, обуви, постельных принадлежностей, мягких игрушек и т.д.; облучением ультрафиолетовыми лучами воздуха, поверхностей. Выбор способа дезинфекции определяется особенностями обеззараживаемого объекта. В качестве дезинфицирующих средств, следует использовать: Механические (фильтрование, мытье и др.); Физические (сжигание, горячий воздух, кипячение, пар, ультрафиолетовое излучение и др.); Химические соединения из различных групп (галоидсодержащие, кислородсодержащие, альдегиды, фенолсодержащие, поверхностно-активные вещества, гуанидины, кислоты, щелочи и др.) или композиционные препараты на их основе. Дезинфицирующие средства должны обладать бактерицидным и (или) вирулицидным, фунгицидным, спороцидным действием. Не допускается применение средств, обладающих статическим действием, то есть только задерживающим рост микроорганизмов. При выборе дезинфицирущих средств необходимо учитывать: особенности обрабатываемого объекта (материал, форма, размер, наличие загрязнений органической и неорганической природы и др.); биологические свойства микроорганизма (устойчивость к физическим и химическим дезинфицирующим агентам и длительность выживания на объектах внешней среды, вид и форма существования); особенности дезинфицирующих средств (спектр антимикробного действия, действующее вещество и его концентрация, растворимость в воде, способы применения, токсичность, влияние на обрабатываемые объекты и окружающую среду и др.). Дезинфицирующие средства, предназначенные для обеззараживания изделий медицинского назначения, должны обязательно обладать вирулицидным действием. Все изделия медицинского назначения после использования необходимо обеззараживать, независимо от того, подлежат они последующей стерилизации или нет.Асептика – это комплекс мероприятий, направленных на уничтожение микроорганизмов в окружающей среде. Асептика включает стерилизацию инструментов, медицинской одежды и белья, помещений. Антисептика – это комплекс мероприятий, направленных на уничтожение микробов в ране или организме в целом, на предупреждение и ликвидацию воспалительного процесса. К антисептикам относятся: препараты йода (спиртовый раствор, раствор Люголя, йодинол), соединения тяжелых металлов (соли ртути, серебра, цинка), вещества нитрофуранового ряда (фурациллин, фуразолидон), окислители (перекись водорода, перманганат калия), кислоты и их соли (салициловая, борная), красители (метиленовый синий, бриллиантовый зеленый).
Антигенная структура бактериальной клетки
Антигенная специфичность и антигенное строение бактерий.
Для характеристики микроорганизмов выделяют родовую, видовую, групповую и типовую специфичность антигенов. Наиболее точная дифференциация осуществляется с использованием моноклональных антител (МКА), распознающих только одну антигенную детерминанту.
Обладая сложным химическим строением, бактериальная клетка представляет целый комплекс антигенов. Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана, рибосомы и другие компоненты цитоплазмы, токсины, ферменты.
Основными видами бактериальных антигенов являются:
- соматические или О- антигены (у грамотрицательных бактерий специфичность определяется дезоксисахарами полисахаридов ЛПС);
- жгутиковые или Н- антигены (белковые);
- поверхностные или капсульные К- антигены.
Выделяют протективные антигены, обеспечивающие защиту (протекцию) против соответствующих инфекций, что используется для создания вакцин.
Суперантигены (некоторые экзотоксины, например- стафилококковый) вызывают чрезмерно сильную иммунную реакцию, часто приводят к побочным реакциям, развитию иммунодефицита или аутоиммунных реакций.
Антигены гистосовместимости.
При пересадках органов возникает проблема совместимости тканей, связанная со степенью их генетического родства, реакциями отторжения чужеродных аллогенных и ксеногенных трансплантатов, т.е. проблемами трансплантационного иммунитета. Существует ряд тканевых антигенов. Трансплантационные антигены во многом определяют индивидуальную антигенную специфичность организма. Сопокупность генов, определяющих синтез трансплантационных антигенов, получила название главной системы гистосовместимости. У людей она часто называется системой HLA (Human leucocyte antigens), в связи с четким представительством на лейкоцитах трансплантационных антигенов. Гены этой системы расположены на коротком плече хромосомы С6. Система HLA- это система сильных антигенов. Спектр молекул МНС уникален для организма, что определяет его биологическую индивидуальность и позволяет различать “чужое- несовместимое”.
Семь генетических локусов системы разделены на три класса.
Гены первого класса контролизуют синтез антигенов класса 1, определяют тканевые антигены и контролируют гистосовместимость. Антигены класса 1 определяют индивидуальную антигенную специфичность, они представляют любые чужеродные антигены Т- цитотоксическим лимфоцитам. Антигены класса 1 представлены на поверхности всех ядросодержащих клеток. Молекулы МНС класса 1 взаимодействуют с молекулой CD8, экспрессируемой на мембране предшественников цитотоксических лимфоцитов (CD- claster difference).
Гены МНС класса 2 контролируют антигены класса 2. Они контролируют ответ к тимусзависимым антигенам. Антигены класса 2 экспрессированы преимущественно на мембране иммунокомпетентных клеток (прежде всего макрофагов и В- лимфоцитов, частично- активированных Т- лимфоцитов). К этой же группе генов (точнее- области HLA- D) относятся также гены Ir - силы иммунного ответа и гены Is - супрессии иммунного ответа. Антигены МНС класса 2 обеспечивают взаимодействие между макрофагами и В- лимфоцитами, участвуют во всех стадиях иммунного ответа- представлении антигена макрофагами Т- лимфоцитам, взаимодействии (кооперации) макрофагов, Т- и В- лимфоцитов, дифференцировке иммунокомпетентных клеток. Антигены класса 2 принимают участие в формировании противомикробного, противоопухолевого, трансплантационного и других видов иммунитета.
Структуры, с помощью которых белки МНС классов 1 и 2 связывают антигены (так называемые активные центры) по уровню специфичности уступают только активным центрам антител.
Гены МНС класса 3 кодируют отдельные компоненты системы комплемента.
Процессинг антигенов- это их судьба в организме. Одной из важнейших функций макрофагов является переработка антигена в иммуногенную форму (это собственно и есть процессинг антигена) и представление его иммунокомпетентным клеткам. В процессинге, наряду с макрофагами, участвуют В- лимфоциты, дендритные клетки, Т- лимфоциты. Под процессингом понимают такую переработку антигена, в результате которой пептидные фрагменты антигена (эпитопы), необходимые для передачи (представления), отбираются и связываются с белками МНС класса 2 (или класса 1). В таком комплексном виде антигенная информация передается лимфоцитам. Дендритные клетки имеют значение в фиксации и длительном хранении (депонировании) переработанного антигена.
Экзогенные антигены подвергаются эндоцитозу и расщеплению в антиген- представляющих (презентирующих) клетках. Фрагмент антигена, содержащий антигенную детерминанту, в комплексе с молекулой класса 2 МНС транспортируется к плазматической мембране антиген- представляющей клетки, встраивается в нее и представляется CD4 Т- лимфоцитам.
Эндогенные антигены - продукты собственных клеток организма. Это могут быть вирусные белки или аномальные белки опухолевых клеток. Их антигенные детерминанты представляются CD8 Т- лимфоцитам в комплексе с молекулой класса 1 МНС.
ВИЧ
Возбудители вирусных кровяных инфекций: СПИДа.
Вирус иммунодефицита человека (ВИЧ)
ВИЧ (вирус иммунодефицита человека) принадлежит к семейству Retroviridae, подсемейству Lentivirus и вызывает заболевание СПИДом ( синдромом приобретенного иммуного дефицита).
ВИЧ подразделяют:
ВИЧ-1 (открыт в 1983 году Л. Монтанье и Р. Галло);
ВИЧ-2 (открыт в 1986 году Л. Монтанье).
Оба типа ВИЧ поражают: Т- лимфоциты, другие клетки иммуной системы (макрофаги), клетки нервной системы ( в основном головного мозга).
Для ВИЧ характерна высокая степень изменчивости - в один миллион раз больше, чем у вируса гриппа, поэтому ВИЧ активно мутирует. В Международной базе данных зафиксировано более 25 тысяч вариантов ВИЧ. Этот факт играет негативную роль в процессе разработки вакцины.
ВИЧ поражает клетки иммунной системы, включаясь в ДНК человеческой клетки, и блокирует в них функцию защиты. Зараженные ВИЧ - инфекцией клетки остаются такими до конца дней своего существования. Клетка не в состоянии справиться с проникшим внутрь вирусом и разрушается под его воздействием. Генетический код вируса начинает управлять иммунитетом человека и разрушать его. К тому времени, когда у ВИЧ инфицированного начинает проявляться СПИД (синдром приобретенного иммунодефицита) – последняя стадия болезни, уже миллиарды клеток крови являются носителями вируса.
Устойчивость ВИЧ во внешней среде относительно невысокая. Внутри шприца или полой иглы жизнеспособность вируса сохраняется несколько суток. Основной путь передачи ВИЧ - половые связи.
Венерические заболевания (сифилис, генитальный герпес) симптомами, которых являются язвы на половых органах, значительно увеличивают возможность заражения ВИЧ-инфекцией. В процессе лечения ВИЧ-инфекции преследуется одна цель – максимальное продление жизни больного человека и сохранение ее качества.
Основу лечения ВИЧ больных составляют противоретровирусные препараты в комбинированной терапии, т.е. применении одновременно нескольких препаратов. Постоянно ведутся разработки по созданию новых лекарственных препаратов и вариантов комбинации их.
По последним данным, группе ученых удалось создать трехмерную модель вируса ВИЧ. Как отмечают создатели, это открытие поможет разработать более эффективные методы лечения. В отсутствии лечения у большинства людей, являющимися носителями ВИЧ, через 5 - 11 лет появляются признаки СПИДа, когда любое банальное заболевание может привести к смерти.
Билет 30
1. взаимодействие вируса и клетки. Репликация вирусов Типы взаимодействия вируса с клеткой. Стадии репродукции вирусов.
Типы взаимодействия вируса с клеткой. Различают три типа взаимодействия вируса с клеткой: продуктивный, абортивный и интегративный.
Продуктивный тип — завершается образованием нового поколения вирионов и гибелью (лизисом) зараженных клеток (цитолитическая форма). Некоторые вирусы выходят из клеток, не разрушая их (нецитолитическая форма).
Абортивный тип — не завершается образованием новых вирионов, поскольку инфекционный процесс в клетке прерывается на одном из этапов.
Интегративный тип, или вирогения — характеризуется встраиванием (интеграцией) вирусной ДНК в виде провируса в хромосому клетки и их совместным сосуществованием (совместная репликация).
Репродукция вирусов осуществляется в несколько стадий, последовательно сменяющих друг друга: адсорбция вируса на клетке; проникновение вируса в клетку; «раздевание» вируса; биосинтез вирусных компонентов в клетке; формирование вирусов; выход вирусов из клетки.
Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц.
Проникновение в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. По-видимому, оба механизма проникновения вируса в клетку не исключают, а дополняют друг друга.
«Раздевание». Процесс «раздевания» заключается в удалении защитных вирусных оболочек и освобождении внутреннего компонента вируса, способного вызвать инфекционный процесс. «Раздевание» вирусов происходит постепенно, в несколько этапов, в определенных участках цитоплазмы или ядра клетки, для чего клетка использует набор специальных ферментов. В случае проникновения вируса путем слияния вирусной оболочки с клеточной мембраной процесс проникновения вируса в клетку сочетается с первым этапом его «раздевания». Конечными продуктами «раздевания» являются сердцевина, нуклеокапсид или нуклеиновая кислота вируса.
Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства.
Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации.
Формирование (сборка) вирусов. Синтезированные вирусные нуклеиновые кислоты и белки обладают способностью специфически «узнавать» друг друга и при достаточной их концентрации самопроизвольно соединяются в результате гидрофобных, солевых и водородных связей.
Существуют следующие общие принципы сборки вирусов, имеющих разную структуру:
1. Формирование вирусов является многоступенчатым процессом с образованием промежуточных форм;
2. Сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа);
3. Формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки;
4. Сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы).
Выход вирусов из клетки. Различают два основных типа выхода вирусного потомства из клетки. Первый тип — взрывной — характеризуется одновременным выходом большого количества вирусов. При этом клетка быстро погибает. Такой способ выхода характерен для вирусов, не имеющих суперкапсидной оболочки. Второй тип — почкование. Он присущ вирусам, имеющим суперкапсидную оболочку. На заключительном этапе сборки нуклеокапсиды сложно устроенных вирусов фиксируются на клеточной плазматической мембране, модифицированной вирусными белками, и постепенно выпячивают ее. В результате выпячивания образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки. Таким образом, внешняя оболочка этих вирусов формируется в процессе их выхода из клетки. При таком механизме клетка может продолжительное время продуцировать вирус, сохраняя в той или иной мере свои основные функции.
Время, необходимое для осуществления полного цикла репродукции вирусов, варьирует от 5—6 ч (вирусы гриппа, натуральной оспы и др.) до нескольких суток (вирусы кори, аденовирусы и др.). Образовавшиеся вирусы способны инфицировать новые клетки и проходить в них указанный выше цикл репродукции.
Гуморальная неспецифическая защита. Система комплимента, активация
Неспецифические факторы защиты организма от микробов.
Неспецифические факторы защиты организма от микробов являются врожденными и действуют на любой микроорганизм.
Выделяют первичный и вторичный барьеры. К первичным барьерам относятся: 1) кожа – потовые и сальные железы вырабатывают молочную и жирные кислоты, которые обладают бактерицидным действием; 2) слизистые оболочки носоглотки, дыхательных путей, кишечника (слюна, слезы вырабатывают лизоцим, в желудке вырабатывается соляная кислота и т.д.); 3) нормальная микрофлора организма человека является антагонистом гнилостной микрофлоры. Вторичные барьеры – это система комплимента (комплекс из 26 белков в сыворотке крови) и фагоцитоз. Система комплемента- комплекс белков и гликопротеидов сыворотки крови человека и позвоночных животных (их более 20). Отдельные компоненты опосредуют процессы воспаления, опсонизацию чужеродных фрагментов для последующего фагоцитоза, участвуют наряду с макрофагами в непосредственном уничтожении микроорганизмов и других чужеродных клеток (лизис бактерий и вирусов). В условиях физиологической нормы компоненты системы комплемента находятся в неактивной форме. Известны три пути активации системы комплемента- классический, альтернативный и с использованием С1- шунта.
Классический путь- каскад протеазных реакций с компонента С1q до С9, реализуется при наличии антител к соответствующему антигену. С комплексом “антиген- антитела” взаимодействует компонент С1q, затем С4, следом- С2. Образуется комплекс “антиген- антитела-С1С4С2”, с ним соединяется С3 (центральный компонент системы) и запускается цепь активации с эффекторными функциями (опсонизация и лизис бактерий, активация системы макрофагов, воспаление).
Альтернативный путь реализуется при первичном контакте с возбудителем (когда еще нет антител). Он индуцируется ЛПС и другими микробными антигенами. С1, С4, С2 не участвуют, альтернативный и классический пути смыкаются на уровне С3. Комплемент, его структура, функции, пути активации, роль в иммунитете.
Природа и характеристика комплемента. Комплемент является одним из важных факторов гуморального иммунитета, играющим роль в защите организма от антигенов. Комплемент представляет собой сложный комплекс белков сыворотки крови, находящийся обычно в неактивном состоянии и активирующийся при соединении антигена с антителом или при агрегации антигена. В состав комплемента входят 20 взаимодействующих между собой белков, девять из которых являются основными компонентами комплемента; их обозначают цифрами: С1, С2, СЗ, С4... С9. Важную роль играют также факторы В, D и Р (пропердин). Белки комплемента относятся к глобулинам и отличаются между собой по ряду физико-химических свойств. В частности, они существенно различаются по молекулярной массе, а также имеют сложный субъединичный состав: Cl-Clq, Clr, Cls; СЗ-СЗа, СЗЬ; С5-С5а, С5b и т. д. Компоненты комплемента синтезируются в большом количестве (составляют 5—10% от всех белков крови), часть из них образуют фагоциты.
Функции комплемента многообразны: а) участвует в лизисе микробных и других клеток (цитотоксическое действие); б) обладает хемотаксической активностью; в) принимает участие в анафилаксии; г) участвует в фагоцитозе. Следовательно, комплемент является компонентом многих иммунологических реакций, направленных на освобождение организма от микробов и других чужеродных клеток и антигенов (например, опухолевых клеток, трансплантата).
Механизм активации комплемента очень сложен и представляет собой каскад ферментативных протеолитических реакций, в результате которого образуется активный цитолитический комплекс, разрушающий стенку бактерии и других клеток. Известны три пути активации комплемента: классический, альтернативный и лектиновый.
По классическому пути комплемент активируется комплексом антиген-антитело. Для этого достаточно участия в связывании антигена одной молекулы IgM или двух молекул IgG. Процесс начинается с присоединения к комплексу АГ+АТ компонента С1, который распадается на субъединицы Clq, Clr и С Is. Далее в реакции участвуют последовательно активированные «ранние» компоненты комплемента в такой последовательности: С4, С2, СЗ. Эта реакция имеет характер усиливающегося каскада, т. е. когда одна молекула предыдущего компонента активирует несколько молекул последующего. «Ранний» компонент комплемента С3 активирует компонент С5, который обладает свойством прикрепляться к мембране клетки. На компоненте С5 путем последовательного присоединения «поздних» компонентов С6, С7, С8, С9 образуется литический или мембраноатакующий комплекс который нарушает целостность мембраны (образует в ней отверстие), и клетка погибает в результате осмотического лизиса.
Альтернативный путь активации комплемента проходит без участия антител. Этот путь характерен для защиты от грамотрицательных микробов. Каскадная цепная реакция при альтернативном пути начинается с взаимодействия антигена (например, полисахарида) с протеинами В, D и пропердином (Р) с последующей активацией компонента СЗ. Далее реакция идет так же, как и при классическом пути — образуется мембраноатакующий комплекс.
Лектиновыи путь активации комплемента также происходит без участия антител. Он инициируется особым маннозосвязывающим белком сыворотки крови, который после взаимодействия с остатками маннозы на поверхности микробных клеток катализирует С4. Дальнейший каскад реакций сходен с классическим путем.
В процессе активации комплемента образуются продукты протеолиза его компонентов — субъединицы СЗа и СЗb, С5а и С5b и другие, которые обладают высокой биологической активностью. Например, СЗа и С5а принимают участие в анафилактических реакциях, являются хемоаттрактантами, СЗb — играет роль в опсонизации объектов фагоцитоза, и т. д. Сложная каскадная реакция комплемента происходит с участием ионов Са2+ и Mg2+.
Yersinia pestis
Род Yersinia.
Род включает 11 видов. Y.pestis вызывает чуму, Y.pseudotuberculesis - псевдотуберкулез, Y.enterocolitica - (кишечный) иерсиниоз, ряд видов не патогенны или условно- патогенны для человека.
Морфология.
Чаще имеют овоидную (кокко-бациллярную) форму, окрашиваются биполярно, склонны к полиморфизму. Большинство видов подвижны при температуре ниже +30 градусов Цельсия (имеют перитрихиальные жгутики), грамотрицательны, имеют капсульное вещество. Y.pestis неподвижны, имеют капсулу.
Культуральные и биохимические свойства.
Факультативные анаэробы. Температурный оптимум от +25 до + 28 градусов Цельсия, pH - близкая к нейтральной. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Иерсинии способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах (психрофильные свойства). Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие (S) формы.
При изучении колоний чумного микроба выделяют два типа колоний - молодые и зрелые. Молодые микроколонии в неровными краями (стадия “битого стекла”) в дальнейшем сливаются, образуя нежные плоские образования с фестончатыми краями (стадия “кружевных платочков”). Зрелые колонии крупные, с бурым зернистым центром и неровными краями (“ромашки”). Многие штаммы способны восстанавливать красители с обесцвечиванием сред (метиленовый синий, индиго и др.). На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопклвидный осадок. Температура +37С - селективная для образования капсулы у Y.pestis.
Культуры Y.pseudotuberculosis и Y.enterocolitica не имеют стадии “битого стекла”, вначале мелкие блестящие, выпуклые, затем может отмечаться сливной рост с образованием выпуклых бугристых колоний, схожих с колониями Y.pestis. Растут на универсальных питательных средах (среда Эндо, агар Мак Конки, среда Серова и др.) в сочетании с методами накопления в холодовых условиях.
Антигенная структура.
Все виды иерсиний имеют О - антиген (эндотоксин), схожий с О - антигенами других грамотрицательных бактерий и токсичный для человека и животных. Липополисахаридно- белковые комплексы О - антигенов иерсиний разделяют на S (гладкие) и R (шероховатые), последние - общие для Y.pestis и Y.pseudotuberculosis. Y.enterocolitica имеет поверхностный антиген, общий с другими энтеробактериями.
Возбудитель псевдотуберкулеза по О - и Н- антигенам подразделены на 13 сероваров, чаще встречаются серовар I, а также III и IV, иерсиниоза - на 34 серовара по О - антигену, чаще от человека выделяют серовары О3 и О9. При температуре от +22 до +25С Y.pseudotuberculosis и Y.enterocolitica имеют жгутиковый антиген и подвижны, при +37C теряют Н - антиген и подвижность.
Y.pestis более однородна в антигенном отношении, имея капсульный антиген (фракция I), антигены T, V - W, белки плазмокоагулазы, фибринолизина, наружной мембраны и др. Чумной микроб выделяет бактериоцины (пестицины), оказывающие бактерицидное действие на псевдотуберкулезный микроб и штаммы кишечной палочки.
Патогенные свойства.
Возбудитель чумы обладает наибольшим патогенным потенциалом среди бактерий. Он подавляет функции фагоцитарной системы, поскольку подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактеремии, генерализованной септицемии.
Возбудители псевдотуберкулеза и иерсиниоза имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности.
Чума чаще протекает в бубонной, легочной и кишечной формах. Наиболее опасны больные легочной чумой, которые выделяют с мокротой огромное количество возбудителя).
Иерсиниоз и псевдотуберкулез - кишечные инфекции. Клиника многообразна - региональная лимфоаденопатия (имитирует аппендицит), энтероколиты, реактивные артриты, анкилозирующий спондилит, скарлатиноподобная лихорадка.
Эпидемиологические особенности.
Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, песчанки, пищухи, в антропургических (городских) условиях - крысы (чума портовых городов). В передаче возбудителя, особенно в очагах, где преобладают незимноспящие животные, имеют блохи животных, способные нападать и заражать человека. В песчаночных очагах могут заражаться верблюды и представлять эпидемическую опасность.
Псевдотуберкулез и кишечный иерсиниоз в природе передаются грызунами. Способны длительно сохраняться и даже накапливаться при низких температурах, например, в овощехранилищах. Способны вызывать заболевания у сельскохозяйственных животных. Человеку передаются преимущественно с пищевыми продуктами от животных, а также растительного происхождения.
Лабораторная диагностика.
Бактериологической диагностикой чумы могут заниматься только специализированные лаборатории противочумных станций и институтов (1 группа патогенности). Методами экспресс - выявления антигена являются МФА, РПГА с эритроцитарным дагностикумом, сенсибилизированным моноклональными антителами к капсульному антигену, ИФА, РНАТ. Для серологической диагностики может использоваться ИФА, РНАГ, ИФА.
При бактериологической диагностике кишечного иерсиниоза и псевдотуберкулеза в связи с накоплением возбудителя при низких температурах ( в отличии от большинства других микроорганизмов) материал предварительно забирают в забуференный физиологический раствор и сохраняют в холодильнике с периодическими высевами на среды Эндо, Плоскирева, Серова. Подозрительные колонии пересевают для получения чистых культур, изучают их по биохимическим свойствам и идентифицируют в РА с диагностическими сыворотками.
Для серологической диагностики используют РА и РНГА ( на псевдотуберкулез - с I сероваром, на иерсиниоз - с сероварами О3 и О9) с исследованием взятых в динамике инфекционного процесса парных сывороток.
Специфическая профилактика.
Применяется в очагах чумы. Используется живая ослабленная вакцина из штамма EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
Билет 31
1. Распространение микроорганизмов в среде. Понятия биоциноз. Какие они бывают.
2. Антитоксин, антигенные свойства. Антигенные свойства вирусов.
Эшерихии. свойства. Кишечная палочка. роль в организме.
Род Escherichia.
Эшерихии - наиболее распространенные аэробные бактерии кишечника, способные при определенным условиях вызывать обширную группу заболеваний человека, как кишечной (диарея), так и внекишечной (бактеремия, инфекции мочевыводящих путей и др.) локализации. Основной вид - E.coli (кишечная палочка) - самый распространенный возбудитель инфекционных заболеваний, вызываемых энтеробактериями. Этот возбудитель является показателем фекального загрязнения, особенно воды. Коли - титр и коли - индекс часто использовали как санитарные показатели. Эшерихии входят в состав микрофлоры толстого кишечника млекопитающих, птиц, пресмыкающихся и рыб.
Культуральные свойства. На жидких средах E.coli дает диффузное помутнение, на плотных средах образует S- и R- формы колоний. На основной для эшерихий среде Эндо лактозоферментирующие кишечные палочки образуют интенсивно красные колонии с металлическим блеском, не ферментирующие - бледно- розовые или бесцветные колонии с более темным центром, на среде Плоскирева - красные с желтоватым оттенком, на среде Левина - темно- синие с металлическим блеском.
Биохимические свойства. Кишечная палочка в большинстве случаев ферментирует углеводы (глюкозу, лактозу, маннит, арабинозу, галактозу и др.) с образованием кислоты и газа, образует индол, но не образует сероводород, не разжижает желатин.
Антигенная структура. Какие - либо существенные морфологические различия между патогенными и непатогенными кишечными палочками не обнаружены. Их дифференциация основана на изучении антигенных свойств. Среди поверхностных антигенов выделяют полисахаридные О- антигены, жгутиковые Н- антигены и капсульные полисахаридные К- антигены. Известно более 170 вариантов О- антигенов (это соответствует принадлежности возбудителя к определенной серогруппе) и 57 - Н- антигенов (принадлежность к серовару). В состав диареегенных (вызывающих диарею) кишечных палочек входят 43 О- группы и 57 ОН- вариантов.
Основные факторы патогенности диареегенных E.coli.
1. Факторы адгезии, колонизации и инвазии, связанные с пилями, фимбриальными структурами, белками наружной мембраны. Они кодируются плазмидными генами и способствуют колонизации нижних отделов тонкой кишки.
2. Экзотоксины: цитотонины (стимулируют гиперсекрецию клетками кишечника жидкости, нарушают водно - солевой обмен и способствуют развитию диареи) и энтероцитотоксины (действуют на клетки стенки кишечника и эндотелия капилляров).
3. Эндотоксин (липополисахарид).
В зависимости от наличия различных факторов патогенности диареегенные кишечные палочки разделены на пять основных типов: энтеротоксигенные, энтероинвазивные, энтеропатогенные, энтерогеморрагические, энтероадгезивные.
4. Для патогенных кишечных палочек характерна выработка бактериоцинов (колицинов).
Энтеротоксигенные E.coli имеют высокомолекулярный термолабильный токсин, схожий по действию с холерным, вызывают холероподобную диарею (гастроэнтериты у детей младшего возраста, диарею путешественников и др.).
Энтероинвазивные кишечные палочки способны проникать и размножаться в клетках эпителия кишечника. Вызывают профузную диарею с примесью крови и большим количеством лейкоцитов (показатель инвазивного процесса) в испражнениях. Клинически напоминает дизентерию. Штаммы имеют некоторое сходство с шигеллами (неподвижные, не ферментируют лактозу, обладают высокими энтероинвазивными свойствами).
Энтеропатогенные E.coli - основные возбудители диареи у детей. В основе поражений - адгезия бактерий к эпителию кишечника с повреждением микроворсинок. Характерна водянистая диарея и выраженное обезвоживание.
Энтерогеморрагические кишечные палочки вызывают диарею с примесью крови (геморрагический колит), гемолитико - уремический синдром (гемолитическая анемия в сочетании с почечной недостаточностью). Наиболее частый серотип энтерогеморрагических кишечных палочек - О157: Н7.
Энтероадгезивные E.coli не образуют цитотоксины, слабо изучены.
Эпидемиология. Основной механизм распространения диареегенных кишечных палочек - фекально - оральный. Заражение может происходить через пищу, воду, при уходе за животными. Поскольку эшерихии обитают в кишечниках многих видов животных, конкретный источник заражения установить сложно. Контактный путь заражения может быть в закрытых заведениях. Энтеропатогенные и энтероинвазивные E.coli - наиболее частые причины внутрибольничных вспышек эшерихиозов.
Лабораторная диагностика. Основным подходом является выделение чистой культуры на дифференциально - диагностических средах и ее идентификация по антигенным свойствам. Ставят РА с набором поливалентных ОК (к О- и К- антигенам) сывороток, затем - адсорбированных О- сывороток и прогретыми при 100 градусах Цельсия (для разрушения К- антигенов) культурами.
Биохимическая дифференциация имеет дополнительное значение. Идентификация диареегенных типов возможна при выявлении специфических маркеров (энтерогеморрагические кишечные палочки не ферментируют сорбит, а серовар О157: Н7 не проявляет бета - глюкуронидазной активности).
Билет 32
