
1.5. Нейродегенерация и нейротрофические факторы – подходы к терапии.
В основе многих нейродегенеративных процессов лежит нарушение метаболизма и функций ряда белков, обладающих повышенной склонностью к агрегации. Процесс неконтролируемой агрегации этих белков и пептидов с последующим формированием характерных внутриклеточных или внеклеточных отложений является ключевым звеном патогенеза нейродегенеративных заболеваний. Белковые агрегаты образуют сенильные бляшки, тельца Леви, прионовые бляшки, нейрофибриллярные клубки и другие амилоидныe отложения в различных отделах нервной системы.
Центральная нервная система (ЦНС) чрезвычайно сложна как на молекулярном и клеточном, так и на структурно-функциональном уровне организации. В число задач, решаемых ЦНС, входит управление движениями, сенсорными и гомеостатическими процессами, многогранными проявлениями высшей нервной деятельности. Успехи современной нейробиологии позволили накопить значительное количество информации о таких важнейших функциях ЦНС, как обучение и память. Основные функции памяти - это запоминание (регистрация, приобретение информации, кодирование), хранение, закрепление и извлечение (воспроизведение, декодирование) информации. Запоминание и извлечение - сознательные процессы. В опытах на животных показано, что для долговременной памяти необходим синтез белка de novo и что в ходе закрепления, вероятно, происходят изменения на уровне синапсов (Берд, 2002).
Однако их молекулярные основы остаются в значительной мере неясными. Основным свойством нервной системы, обеспечивающим эти процессы, является ее пластичность, изучение которой позволит лучше понять механизмы интеграции высших функций мозга. Современные достижения нейрофизиологических, нейрохимических, молекулярно-генетических методов исследования и нейровизуализационных технологий позволили выявить структурные и функциональные изменения головного мозга при всей аффективной патологии, опираясь на феномены нейрональной пластичности (Изнак, 2004).
Все процессы нервной системы направляются на молекулярном уровне целым комплексом веществ-регуляторов, взаимосвязанных сложными механизмами. Один из таких путей регуляции – выработка нейротрофических факторов (НТФ).
НТФ - регуляторные белки нервной ткани, которые синтезируются в ее клетках (нейронах и глии). Они оказывают наиболее сильное трофическое влияние на все основные процессы жизнедеятельности нейронов, обусловливают пластичность нейрональной ткани и участвуют в восстановлении нарушенных функций.
Своим открытием нейротрофические факторы обязаны итальянскому нейробиологу Рите Леви-Монтальчини и американскому биохимику Стэнли Коэну. В 1952 году Рита Леви-Монтальчини села на самолет в Бразилию с двумя образцами опухолей мыши, скрытыми в ее сумочке. Приехав в Рио-де-Жанейро, она обнаружила, что в течение 10-часового полета рядом с фрагментом мышиной саркомы, но не в непосредственном контакте с изолированной тканью появилось разрастание нервных клеток. Уже по возвращении в Сент-Луис к разработке этого открытия присоединился талантливый молодой биохимик по имени Стэнли Коэн. В течение года их команда преуспела в выделении искомого вещества. Осталось только одно – определить, белком или нуклеиновой кислотой является этот фактор. Артур Корнберг, биохимик университета Вашингтона, предложил использовать змеиный яд, как известно, богатый источник фосфодиэстеразы, фермента, который разрушает нуклеиновые кислоты. К их удивлению, змеиный яд не только не разрушил, но, наоборот, оказал стимулирующее действие (рис. 8).
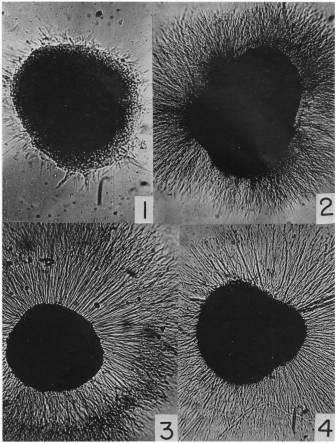
Рис. 8. Нервная ткань куриного эмбриона: 1 - контрольная среда; 2 – среда, культивированная со змеиным ядом; 3 - частично очищенная белковая фракция из змеиного яда; 4 – белок, очищенный от саркомы (по: Nicholette Zeliadt, 2013).
После кропотливого тестирования через постепенно очищенные фракции белков Коэном была определена фракция, содержащая белок с активностью роста нервов, который они назвали фактор роста нервов NGF (NGF – Nerve Growth Factor). NGF явился первым известным нейротрофным фактором и родоначальником особой и наиболее специфической по своей биологической активности группы факторов, получившей название подсемейства нейротрофинов.
Это подсемейство объединяет белки, сходные по структуре с NGF, - небольшие положительно заряженные молекулы членов этого семейства имеют высокогомологичные аминокислотные последовательности и способны образовывать гомодимеры. Димеризация является непременным условием для осуществления биологических функций нейротрофинов.
По сходству с этим первым фактором роста нервов (NGF) объединяется не только одна группа нейротрофинов, но и строится современная классификация всех нейротрофических факторов, включающая группы (подсемейства) структурно гомологичных пептидов:
1. Подсемейство нейротрофинов.
1.1. Фактор роста нервов (Nerve Growth Factor, NGF).
1.2. Нейротрофический фактор мозга (Brain-derived Neurotrophic Factor, BDNF).
1.3. Нейротрофин-3 (Neurotrophin-3, NT-3).
1.4. Нейротрофин-4 (Neurotrophin-4, NT-4).
2. Подсемейство глиального фактора.
2.1. Глиальный нейротрофический фактор (Glial Cell-derived Neurotrophic Factor, GDNF).
2.2. Нейртурин (Neurturin, NTR).
2.3. Артемин (Artemin, ART).
2.4. Персефин (Persephin, PSP).
3. Подсемейство цилиарного (реснитчатого) фактора).
3.1. Цилиарный нейротрофический фактор (Ciliary Neurotrophic Factor, CNTF).
3.2. Ингибирующий фактор лейкемии (Leukemia Inhibitory Factor, LIF).
3.3. Интерлейкин-6 (Interleukin-6, IL-6).
4. Другие нейротрофические факторы.
4.1. Мидкин (Midkine, MK) (Гомазков, 2011).
Открытие фактора роста нервов (NGF), впоследствии отмеченное присуждением Нобелевской премии, повлекло бурное развитие данного направления и открытие многих других нейротрофических и ростовых факторов. Все они играют важную роль в процессах развития и функционирования нервной системы, а также, что особо важно для практической медицины, в регенерации поврежденных нейрональных структур (Ebadi et al., 1997).
Нейротрофические и ростовые факторы представляют собой крупные полипептиды с размером от 100 до 150 аминокислотных остатков.
Но поскольку ни по химическим признакам, ни по характеру биологической активности нет четкого деления между нейротрофическими и ростовыми факторами, то считается, что наряду с нейротрофинами почти все известные классические и вновь открываемые факторы роста в определенных условиях могут оказывать трофическую поддержку определенных групп нейронов (Valenzuela et al., 1997). По всей вероятности, это связано с тем, что в нервной системе присутствуют рецепторы большинства трофических факторов, а внутриклеточные системы передачи сигналов в ядро, используемые различными рецепторами, взаимно перекрываются (Marte et al., 1997).
В 1986 году Р. Леви-Монтальчини, получая Нобелевскую премию по физиологии и медицине, в своей лекции описала дальнейший путь изучения НТФ. Она предвидела идею нейротрофической терапии: «…поскольку гибель клеток нейрональной популяции может быть связана со сниженным уровнем нейротрофических факторов, таких как NGF, их экзогенная поддержка или стимуляция эндогенного продуцирования фармакологическими средствами может открыть обещающие подходы терапии…» (Levi-Montalcini, 1987). Одним из таких подходов, предсказанных в нобелевской лекции Р. Леви-Монтальчини, стала нейропротекция.
Нейропротекция - естественная или терапевтическая стимуляция физиолого-биохимических механизмов, способствующих структурной и функциональной устойчивости мозга. В понятиях современной медицины нейропротекция, особенно в приложении к возрастным, ишемическим и нейродегенеративным заболеваниям, должна начинаться до развития клинической картины (идеология превентивной терапии).
Конкретизация этого понятия применительно к НТФ включает:
1. предотвращение дегенерации нейронов;
2. стабилизацию цитоскелета;
3. защиту клеток мозга от окислительного стресса и апоптоза;
4. ослабление депозиции амилоидных образований;
5. предотвращение медиаторного дефицита или дисбаланса нейротрансмиттерных процессов;
6. стимуляцию нейрогенеза (Гомазков, 2011).
Факторы роста, представляющие собой эндогенные полипептиды, являются идеальными претендентами для лечения ишемического инсульта, так как обладают нейропротективными, репаративными и пролиферативными свойствами. При острой церебральной ишемии в микрососудах мозга нарушается проницаемость и стабильная функция гемато-энцефалического барьера. Через несколько дней после ишемического инсульта выявляются пролиферативные явления в эндотелиальных клетках, стимулируется ангиогенез. Исследования подтверждают, что ключевую роль в этих процессах занимает группа сосудистых эндотелиальных ростовых факторов VEGF (VEGF - Vascular Endothelial Growth Factor) и основной фактор роста фибробластов bFGF (bFGF - basic Fibroblast Growth Factor). bFGF способен действовать внутриклеточно как активатор пролиферации(Bouche et al., 1987). Спустя 10 мин после индукции глобальной церебральной ишемии зафиксирован синтез bFGF и рецепторов к нему, причем основным источником трофического фактора являются глиальные клетки. При этом каждый из компонентов семейства VEGF обнаруживает при церебральной ишемии свою уникальную функцию, как в начальный период сосудистой дестабилизации, так и на последующих этапах ангиогенеза (Croll et al., 2001; Zhang, Chopp, 2002). Терапевтическое использование рекомбинантных препаратов VEGF направлено на стимуляцию коллатеральной микроциркуляции и, соответственно, церебральной реваскуляризации (Гомазков, 2011). Нейротрофические факторы наряду с аутокринной стимуляцией собственных рецепторов индуцируют дальнейшие сигнальные каскады, приводящие к синтезу регуляторных протеинов, которые предотвращают индукцию апоптоза и способствуют клеточному жизнеобеспечению, однако при массивном ишемическом поражении мозга, сопровождающемся грубым энергетическим дефицитом, усиление трофического обеспечения и тканевой пластичности оказывается недостаточным для спасения поврежденных клеток.
Помимо восстановления поврежденных нейронов считается возможным участие НТФ в реакциях обучения у животных, поскольку нейротрофический фактор мозга BDNF участвует в поддержании функций холинергических нейронов переднего мозга, организации процессов памяти, когнитивных функций. Нарушение холинергической иннервации побуждает экспрессию генов, участвующих в синтезе нейротрофических факторов выживания нейронов, ассоциируемых также со структурным ремоделированием нейрональной сети. BDNF, предполагаемый модулятор синаптической передачи, стимулятор высвобождения нейротрансмиттеров, влиял на реакции пассивного избегания у 1-суточных цыплят. Icv что это инъекции антител к нейротрофину приводили к временной амнезии. Дальнейшие эксперименты позволили определить регионарные особенности влияния ростовых факторов на биохимические процессы, связанные с формированием памяти (Johnston et al., 1999). Фактор роста нервов (NGF) участвует в стимуляции навыков обучения у гетерозиготных мышей. Выявлены различия в трансфекции NGF в клетках гиппокампа, и эти особенности оказываются существенными для коррекции полипептидом дефицита пространственного обучения (Brooks et al., 2000). Облегчение реакций запоминания стимулировалось препаратом PG-9, влияющим на рилизинг ацетилхолина, который потенцировал эндогенный синтез NGF. Возможно, данные исследования позволят улучшить процессы обучения и памяти путем применения НТФ стимулирующего эффекта.
Способность ростовых факторов контролировать пролиферацию, дифференцировку и направленное движение нервных клеток лежит в основе нормального протекания этих процессов, обеспечении правильного развития и защитных реакций организма. Утрата или ослабление контроля могут быть причиной тяжелых заболеваний, включая рак и атеросклероз, поскольку нарушение контроля пролиферации лежит в основе раковых заболеваний. Факторы роста не только промотируют клеточное деление, но и наоборот некоторые из них ингибируют этот процесс. Роль ингибитора, в частности, выполняет ростовой фактор - трансформирующий ростовой фактор TGF (TGF - transforming growth factors). Процессы пролиферации клеток и постепенного приобретения ими специализированного характера происходят в организме высокоупорядоченно и согласованно. Эта упорядоченность основана на том, что в результате межклеточных взаимодействий включаются различные внутриклеточные программы, определяющие поведение клетки в зависимости от поведения ее соседей и от потребностей организма. Ключевую роль в межклеточной сигнализации играют ростовые факторы.
Нейротрофические факторы играют определенную роль в регуляции функций сенсорных нейронов. Среди факторов, имеющих отношение к ноцицептивным реакциям, называют NGF и глиальный фактор GDNF (GDNF - Glial Derived Neurotrophic Factor). По-видимому, эти два фактора «оркеструют» периферические ноцицептивные процессы, тогда как BDNF является центральным болевым модулятором (Bennet, 2001). Результаты подобных исследований доказывают значение рилизинга BDNF из сенсорных нейронов для модуляции спинального болевого ответа, и как вариант, в будущем могут быть использованы для создания новых анальгезирующих препаратов.
НТФ относятся к физиологически значимым пептидам, которые на клеточном уровне регулируют большой спектр процессов в здоровом, больном и стареющем мозге. В этот перечень входит контроль роста и дифференцировки нейронов в развивающихся и переживающих системах, функциональная стабильность и пластичность нейрональных процессов, стимулирование нейрогенеза. В зрелом мозге эти факторы защищают чувствительные нейрональные структуры от повреждения. Среди многих химических регуляторов нейротрофинам принадлежит особая роль в защите и репарации мозга при ишемических, нейродегенеративных и травматических повреждениях. Это положение базируется на информации об особом регионарном синтезе нейротрофинов в мозге, доставкой по аксонам в соседние регионы и колокализации сопряженных с их эффектами рецепторов.
Фармакологический эффект нейротрофинов лимитируется их прохождением через гематоэнцефалический барьер. Крупные полипептидные молекулы подвергаются также быстрому гидролизу ферментами, присутствующими в крови. Попытки в экспериментальных работах использовать эффекты нейротрофинов и ростовых факторов путем непосредственного введения в желудочки мозга не получило развития в клинике. Концепция «нейротрофической терапии» в значительной мере остается декларативным постулатом (Гомазков, 2011). Однако уже в настоящее время используются препараты, представляющие наборы коротких естественных пептидных фрагментов (семакс, церебролизин, кортексин, ноопепт), что свидетельствует о перспективности данного терапевтического подхода.
