91)Трансметилирование
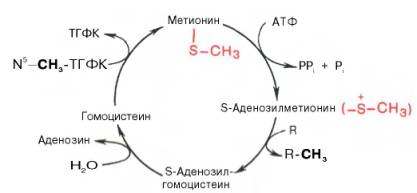
Метаболические пути превращения метионина в тканях значительно разнообразнее, чем пути превращения других серосодержащих аминокислот; тем не менее катаболизм метионина осуществляется через цистеин. Это превращение метионина в цистеин оказалось необратимым процессом. Выяснилось также, что углеродный скелет цистеина происходит из другой аминокислоты, а именно серина. Фактическим донором метильных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин – S-аденозилметионин, который образуется в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой.
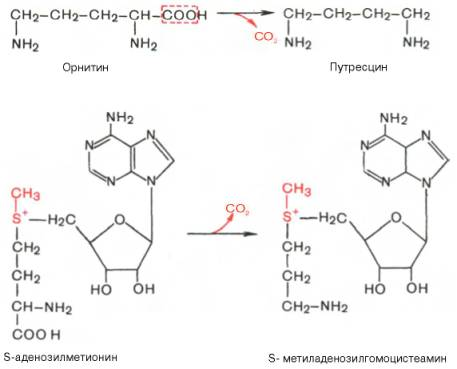
Своеобразие данной реакции заключается в том, что СН3-группа метионина активируется под действием положительного заряда соседнего атома серы. S-аденозилметионин участвует во всех реакциях, где метильная группа используется в биосинтетических реакциях: например, в синтезе адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Образовавшийся после отщепления метильной группы S-аденозилгомоцистеин подвергается гидролизу на аденозин и гомоцистеин; последний используется в синтезе серина (это основной путь превращения) или служит акцептором метильной группы от N5—СН3—ТГФК в синтезе метионина (эту реакцию катализирует гомоцистеинметилтрансфераза), завершая, таким образом, своеобразный цикл активирования метильной группы.
В качестве примера приводим схему биосинтеза креатина, в котором принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуани-динацетата – осуществляется в почках при участии глицин-амидинотранс-феразы (КФ 2.1.4.1):
Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы (КФ 2.1.1.2):
Креатин подвергается фосфорилированию с образованием креатин-фосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Гомоцистеин может вновь превращаться в метионин путем метилирования. Однако основной путь дальнейшего превращения гомоцис-теина связан с его использованием в синтезе цистеина, который может быть представлен в виде двух последовательных ферментативных реакций.
Ферменты, катализирующие синтез и распад цистатионина (циста-тионин-β-синтаза и цистатионаза), содержат ПФ. Цистеин далее подвергается окислению по описанному ранее пути, а гомосерин после транс-аминирования с α-кетоглутаратом превращается в α-кетомасляную кислоту; последняя может также образоваться из цистатионина непосредственно, минуя стадию гомосерина.

1 2
2
92-93)Обмен фен. и тир.

Основные метаболические превращения ф.и т.
Цифры в кружках - участки блокирования реакций при фенилкетонурии (1), тирозинозе (2), альбинизме (3) и алкаптонурии (4).
Фенилкетонурия (phenylketonuria) - Наследственное заболевание человека, характеризующееся нарушением миелинизации нервных волокон, снижением количества меланоцитов, экземами, судорогами, умственной отсталостью и др. Обусловлено нарушением обмена фенилаланина вследствие дефицита. Из всех наследственных заболеваний, связанных с нарушением обмена аминокислот, фенилкетонурия встречается наиболее часто (1/11000). Наследуется по аутосомно-рецессивному типу, ген фенилаланингидроксилазы (PAH) локализован на участке q22-q24.1 хромосомы 12. В ряде случаев фенилкетонурия поддается лечению путем назначения специальной диеты, что приводит к коррекции обмена веществ и нормализации состояния пациента.
Фенилкетонурия (фенилпировиноградная олигофрения) развивается как результат потери способности организма синтезировать фенилаланин-4-монооксигеназу, катализирующую превращение фенилаланина в тирозин. Характерные особенности болезни – резкое замедление умственного развития ребенка, а также экскреция с мочой больших количеств фенил-пировиноградной кислоты (до 1–2 г/сут) и фенилацетилглутамина (до 2–3 г/сут). Решающим доказательством метаболического блока при фенил-кетонурии являются данные о накоплении фенилаланина в тканях. Так, количество его в крови может достигать 600 мг/л (в норме 15 мг/л), в цереброспинальной жидкости – 80 мг/л (в норме 1,5 мг/л). Развитие болезни можно предотвратить, если значительно снизить прием фенилала-нина с пищей с самого рождения ребенка.
Алкаптонурия характеризуется экскрецией с мочой больших количеств (до 0,5 г/сут) гомогентизиновой кислоты, окисление которой кислородом воздуха придает моче темную окраску. В далеко зашедших случаях развиваются охроноз, наблюдаются отложение пигмента в тканях и потемнение носа, ушей и склеры. Эта болезнь известна с девнейших времен, однако только в 1962 г. были получены доказательства, что метаболический дефект при алкаптонурии связан с врожденным отсутствием в печени и почках оксидазы гомогентизиновой кислоты.
Альбинизм – врожденное отсутствие пигментов в коже, волосах и сетчатке. Метаболический дефект связан с потерей меланоцитами способности синтезировать тирозиназу – фермент, катализирующий окисление тирозина в диоксифенилаланин и диоксифенилаланинхинон, являющихся предшественниками меланина. Предположение о блокировании процесса полимеризации меланина при альбинизме не подтвердилось.
Фенилаланин относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. В то же время тирозин полностью заменим при достаточном поступлении фенилаланина с пищей. Объясняется это тем, что основной путь превращения фенилаланина начинается с его окисления (точнее, гидрокси-лирования) в тирозин (рис. 12.6). Реакция гидроксилирования катализируется специфической фенилаланин-4-монооксигеназой, которая в качестве кофермента содержит, как все другие гидроксилазы, тетрагидро-биоптерин. Блокирование этой реакции, наблюдаемое при нарушении синтеза фенилаланин-4-монооксигеназы в печени, приводит к развитию тяжелой наследственной болезни – фенилкетонурии (фенилпировиноградная олигофрения). В процессе трансаминирования тирозин превращается в n-оксифенилпировиноградную кислоту, которая под действием специфической оксидазы подвергается окислению, декарбоксилированию, гидро-ксилированию и внутримолекулярному перемещению боковой цепи с образованием гомогентизиновой кислоты; эта реакция требует присутствия аскорбиновой кислоты, роль которой пока не выяснена. Дальнейшее превращение гомогентизиновой кислоты в малеилацетоуксусную кислоту катализируется оксидазой гомогентизиновой кислоты. Малеилацетоуксус-ная кислота под действием специфической изомеразы в присутствии глу-татиона превращается в фумарилацетоуксусную кислоту, подвергающуюся гидролизу с образованием фумаровой и ацетоуксусной кислот, дальнейшие превращения которых уже известны.
Участие молекулы тирозина в биосинтезе гормонов щитовидной железы и катехоламинов подробно представлено в главе 8. Фенилаланин и тирозин являются также предшественниками меланинов. В этом важном биологическом процессе, обеспечивающем пигментацию кожи, глаз, волос, активное участие принимает фермент тирозиназа.
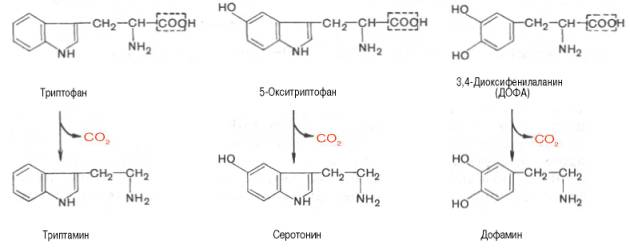
94)Декарбоксилирование амк.
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
3. Декарбоксилирование, связанное с реакцией трансаминирования:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот (см. главу 10) как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа сводится к образованию ПФ-субстратного комплекса, представленного, как и в реакциях трансаминирования, шиффовым основанием ПФ и аминокислоты:
Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы фермента сопровождается лабилизацией одной из трех связей при α-углеродном атоме, благодаря чему аминокислота способна вступать в реакции трансаминирования (а), декарбоксилирования (b) и альдольного расщепления (с).
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. масса 112000), кофермент – ПФ. В больших количествах она содержится в надпочечниках и ЦНС, играет важную роль в регуляции содержания биогенных аминов. Образующийся из 5-окситриптофана серо-тонин оказался высокоактивным биогенным амином сосудосуживающего действия. Серотонин регулирует артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременных, карциноидного синдрома и геморрагических диатезов.
В животных тканях с высокой скоростью протекает декарбоксилиро-вание гистидина под действием специфической декарбоксилазы.
Гистамин оказывает широкий спектр биологического действия. По механизму действия на кровеносные сосуды он резко отличается от других биогенных аминов, так как обладает сосудорасширяющим свойством. Большое количество гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. Кроме того, гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации. При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают также роль медиатора боли. Болевой синдром – сложный процесс, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбокси-лаза), является высокоспецифичным.
Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов.
![]()
![]()