
- •Учебное пособие
- •Раздел 1. Структура и свойства ферментов
- •Инженерная энзимология. Иммобилизованные ферменты. Новые пути практического использования ферментов. Применение ферментов в промышленности, сельском хозяйстве, медицине
- •Принцип классификации ферментов. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Основные положения систематической и тривиальной номенклатуры ферментов
- •Способы количественного выражения активности ферментов. Единицы активности. Удельная и молекулярная активность
- •Методы определения активности ферментов: колориметрический, спектрофотометрический, флуориметрический, манометрический, биолюминесцентный и др.
- •Прямой и непрямой оптический тест Варбурга. Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
- •Лекция 1.2 выделение и очистка ферментов
- •Разрушение клеток и экстракция белков
- •Тепловая денатурация
- •Осаждение белков
- •Гель-фильтрация
- •Разделение белков путем адсорбции
- •Выбор ионообменника
- •Элюция адсорбированного белка
- •Аффинная хроматография
- •Гидрофобная хроматография
- •Металлохелатная аффинная хроматография
- •Высокоэффективная жидкостная хроматография
- •Электрофорез
- •Изоэлектрическое фокусирование
- •Капиллярный электрофорез
- •Двумерные системы электрофореза
- •Кристаллизация белков
- •Лекция 1.3 уровни структурной организации ферментов
- •Многостадийный процесс образования пространственной структуры белка
- •Механизмы регуляции процесса сворачивания полипептидной цепи внутри клетки
- •Ферменты, участвующие в фолдинге белка
- •Специальные белки, увеличивающие эффективность сворачивания полипептидной цепи в нативную конформацию
- •Посттрансляционная модификация белка
- •Роль доменов в пространственной организации молекул ферментов
- •Увеличение числа доменов в ферменте и усложнение взаимодействий между ними
- •Роль доменов в формирование активного центра фермента
- •Роль доменов в регуляции ферментативной активности
- •Роль доменов в связывание ферментов с мембранами
- •Полифункциональные ферменты
- •Бифункциональные ферменты, катализирующие реакции одного метаболического пути
- •Бифункциональные ферменты, катализирующие противоположно направленные реакции
- •Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
- •Классификация кофакторов
- •Функции кофакторов
- •Кофакторы окислительно-восстановительных процессов Никотинамидные кофакторы
- •Кофакторы переноса групп Коферменты – производные пиридоксина
- •Кофакторы процессов синтеза, изомеризации и расщепления с-с связей Биотин
- •Роль металлов в функционировании ферментов
- •Лекция 1.5. Топография активных центров простых и сложных ферментов
- •Методы изучения активных центров ферментов
- •Раздел 2. Кинетика и термодинамика
- •Ферментативных реакций
- •Лекция 2.1.
- •Кинетика химических реакций
- •Скорость химической реакции
- •Основной постулат химической кинетики ‒ закон действия масс
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Уравнения односторонних реакций 0-го, 1-го и 2-ого порядка
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Молекулярность элементарных реакций
- •Методы определения порядка реакции
- •Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
- •Катализ
- •Лекция 2.2. Стационарная кинетика ферментативный реакций
- •Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Лекция 2.3. Ингибиторы ферментов.
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Бесконкурентное ингибирование
- •Смешанный тип ингибирования
- •Субстратное ингибирование
- •Методы определения константы ингибирования. Метод Диксона
- •Лекция 2.4 Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •Методы определения коэффициента Хилла
- •Раздел 3.Механизмы ферментативного катализа
- •Сущность явления катализа
- •Стадии образования фермент-субстратного комплекса
- •Природа сил, стабилизирующих различные конформационные состояния ферментсубстратного комплекса
- •Электростатические взаимодействия
- •Водородные связи
- •Вандерваальсовы взаимодействия
- •Гидрофобные взаимодействия
- •Факторы, определяющие эффективность и специфичность ферментативного катализа
- •Физико-химические механизмы ферментативного катализа
- •Лекция 3.2
- •Механизм действия гидролаз на примере карбоксипептидазы а
- •Связывание субстрата карбоксипептидазой а
- •Работы Липскомба с сотрудниками по установлению молекулярного механизма действия кпа
- •Методы для изучения механизма действия ферментов
- •Лекция 3.3 Специфичность – уникальное свойство ферментов
- •Относительная или групповая специфичность действия
- •Абсолютная специфичность действия
- •Стереоспецифичность ферментов
- •Концепция стерического соответствия «ключ-замок»
- •Концепция индуцированного соответствия
- •Раздел 4. Контроль активности ферментов лекция 4.1. Ферменты в клетке и организованных системах
- •Распределение ферментов в клетке
- •Ферменты, присутствующие в ядре
- •Ферменты митохондрий
- •Лизосомальные ферменты
- •Ферменты эндоплазматического ретикулума
- •Ферменты, локализованные в цитозоле
- •Мембранные ферменты
- •Уровни структурной организации ферментов в клетке
- •Мультиферментные комплексы
- •Пируватдегидрогеназный комплекс
- •Мультиферментные конъюгаты
- •Метаболоны
- •Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
- •Изостерическая регуляция
- •Изоферменты
- •Лекция 4.3 ковалентная модификация ферментов и ее типы
- •Лекция 4.4
- •Регуляция количества ферментов в клетке
- •Контроль количества ферментов в клетке – процесс, зависящий от соотношения скоростей их биосинтеза и деградации.
- •Время полужизни различных ферментов
- •Фермент
- •Аминокислоты
- •Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
- •Убиквитин-протеосомный путь деградации белков у эукариот. Убиквитин – белок, маркирующий белки для деградации. Строение 26s протеосомы
- •Раздел 5. Прикладное значение ферментов лекция 5.1. Генетическая инженерия ферментов
- •Использование рекомбинантных ферментов
- •Лекция 5.2 Ферменты в медицине (часть I)
- •Энзимодиагностика Органная специфичность в распределении ферментов
- •Ферменты сыворотки крови
- •Факторы, влияющие на уровень ферментов во внеклеточной жидкости
- •Диагностическое значение снижения ферментативной активности
- •Неспецифическое повышение ферментативной активности
- •Применение ферментов в качестве аналитических реагентов
- •Лактатдегидрогеназа
- •Лекция 5.3 Ферменты в медицине (часть II) Энзимопатии
- •Врождённые (наследственные) энзимопатии
- •Механизм возникновения наследственных энзимопатий
- •Блок обмена веществ
- •Примеры наследственных энзимопатий
- •Приобретённые энзимопатии
- •Энзимотерапия Использование ферментов в качестве лекарственных препаратов
- •Использование ингибиторов ферментов в качестве лекарственных препаратов
- •Библиографический список
Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
Регуляция активности ферментов в клетке, прежде всего, осуществляется внутриклеточными компонентами – субстратами, интермедиатами и продуктами различных метаболических путей.
Изостерическая регуляция
В роли изостерических регуляторов активности ферментов выступают субстраты, кофакторы, структурные аналоги и продукты реакции. Все перечисленные соединения являются соединениями, взаимодействующими с активными центрами ферментом, и поэтому их относят к изостерическим регуляторам.
Концентрация субстрата. Скорость любой энзиматической реакции определяется, в первую очередь, концентрацией субстрата. У ферментов, подчиняющихся закону Михаэлиса-Ментен, скорость реакции растет с увеличением концентрации субстрата, но достигает Vmax, когда фермент насыщен субстратом.
Vmax·[S]
v = --------------
Кm + [S]
Скорость энзиматической реакции наиболее чувствительна к изменению концентрации субстрата, когда она ниже Кm. При концентрации субстрата меньше, чем 1/10Кm, удвоение субстрата дает примерно удвоение скорости; при концентрации субстрата, равной 10Кm, удвоение концентрации субстрата оказывает малый эффект на скорость реакции. Если фермент имеет высокую Кm, то для достижения ½ Vmax ему требуются более высокие концентрации субстрата.
Например, гексокиназа I – изозим в эритроцитах имеет Кm для глюкозы ≈ 0,01 мМ, Кm для глюкозы глюкокиназы (изозим IV, печень) ≈ 10 мМ.
Эритроциты полностью зависят от метаболизма глюкозы, которую используют для образования АТР. При низких значениях Кm гексокиназы эритроцитов, даже если концентрация глюкозы в крови драматически снизится, эритроциты будут фосфорилировать глюкозу со скоростью, близкой к максимальной.
Печень же сохраняет излишек глюкозы в виде гликогена или превращает в жиры. Так как ее Кm ≈ 5 мМ, скорость фосфорилирования глюкозы будет увеличиваться с увеличением концентрации глюкозы в крови и уменьшаться, когда уровень глюкозы в крови падает. Высокая Кm гексокиназы печени поэтому способствует сохранению в печени гликогена или жиров, но только в случае избытка глюкозы.
Концентрация ингибиторов. Ферменты достаточно часто обратимо ингибируются структурными аналогами и продуктами реакции. Ингибиторы, похожие по структуре на субстрат конкурирует с ним за активный центр фермента, поэтому конкурентные ингибиторы увеличивают кажущуюся Кm фермента, но не влияют на Vmax. Они увеличивают концентрацию субстрата, необходимую для насыщения фермента, т.е. для достижения максимальной активности.
Классическим примером изостерического ингибирования является действие малоната на активность сукцинатдегидрогеназв (СДГ). Для 50 % ‒ го угнетения СДГ соотношение сукцинат/малонат должно составить 1:50. Изостерическим ингибитором СДГ является так же оксалоацетат, который регулирует, таким образом, заключительные этапы цикла Кребса по типу обратной связи.
Изостерические ингибиторы известны и для ферментов, метаболизирующих витамины. Примером может служить тиаминкиназа, фермент, осуществляющий фосфорилирование витамина В1, тиамина. При этом образуется активная форма тиамина ‒ тиаминдифосфат, участвующий в качестве простетической группы в функционировании пируватдегидрогеназы – первого фермента в составе пируватдегидрогеназного комплекса. Синтетический аналог тиамина, у которого атом серы заменен, на винильную группу – С=СН- , назван пиритиамином. Пиритиамин является одним из сильнейших изостерических ингибиторов. В присутствии тиамина пиритиамин ингибирует тиаминкиназу на 50% в соотношении 1:1. Следовательно, пиритиамин обладает таким же сродством к активному центру тиаминкиназы, как и тиамин, однако комплекс тиаминкиназа-пиритиамин катилитически не активен.
Все продукты являются обратимыми ингибиторами ферментов. Они могут быть конкурентными, неконкурентными, смешанными в отношении субстрата. Простейшее ингибирование продуктом, уменьшение скорости энзима, вызванное накоплением его собственного продукта, играет важную роль в метаболических путях. Это ингибирование не позволяет ферменту в последовательности реакций образовывать большее количество продукта, чем он может быть использован следующим ферментом в последовательности данного метаболического пути.
Регуляция активности аллостерических ферментов
Аллостерическая регуляция основана на изменениях конформации фермента, ведущей к изменению его активности. Аллостерическая регуляция является одним из самых быстродействующих и гибких типов модуляции активности ключевых метаболических ферментов. Она осуществляется с помощью молекул-эффекторов, взаимодействующих с аллостерическим центром фермента. Обычно аллостерический фермент построен из субъединиц, которые могут существовать в активной и неактивной конформации, и аллостерический эффектор промотирует превращение одной конформации в другую.
Аллостерическими эффекторами могут выступать самые различные вещества: субстраты и конечные продукты метаболических путей, иногда – промежуточные метаболиты; в катаболических процессах ‒ нуклеозиддифосфаты и нуклеозидтрифосфаты, а также переносчики восстановительных эквивалентов; в каскадных реакциях сАМР и сGMP, которые регулируют активность ферментов (например, протеинкиназ), участвующих в ковалентной модификации белков; ионы металлов и множество иных соединений.
Рассмотрим регуляцию аллостерических ферментов на примере фосфофруктокиназы и аспартаткартамоил-трансферазы (АКТФ).
Фосфофруктокиназа (ФФК) – один из наиболее хорошо изученных аллостерических ферментов. Это тетрамер, каждая субъединица которого содержит активный центр. Аллостерические центры располагаются на поверхности контакта двух субъединиц (рис. 4.2.1).

Рис. 4.2.1. Строение фосфофруктокиназы
Фосфофруктокиназа – поливалентный аллостерический фермент, активность которого регулируется разными внутриклеточными соединениями. Ингибиторами ФФК являются АТР, цитрат и концентрация протонов водорода. АТР является одновременно субстратом и аллостерическим ингибитором этого фермента.
Высокие уровни АТР изменяют кинетическое поведение ФФК, превращая гиперболическую зависимость (область низких концентраций АТР) в сигмоидную (рис. 4.2.2).

Рис. 4.2.2. Зависимость скорости фосфофруктокиназной реакции от концентрации фруктозо-6-фосфата в области низких и высоких концентраций АТР
Аллостерическими активаторами ФФК являются АМР и фруктозо-2,6-дифосфат, которые могут снимать ингибирующий эффект АТР. На рис. 4.2.3 показано влияние фруктозо-2.6-дифосфата на зависимость скорости реакции, катализируемой фосфофруктокиназой, от концентрации субстратов – фруктозо-6-фосфата и АТР.
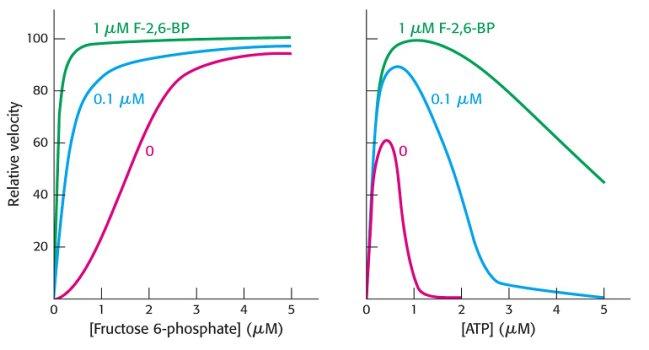
Рис. 4.2.3. Влияние различных концентраций фруктозо-2,6-дифосфата на зависимость скорости фосфофруктокиназной реакции от концентрации фуктозо-6-фосфата и АТР
Аспартаткарбамоилтрансфераза (АКТФ) – фермент, катализирующий скорость-лимитирующую реакцию в анаболическом пути синтеза пиримидиновых нуклеотидов. Она катализирует перенос карбамоильного остатка с карбамоилфосфата на аминогруппу L-аспартата. Образующийся N-карбамоил-L-аспартат содержит уже все атомы будущего пиримидинового кольца. Бактериальная АКТФ E. coli состоит из 12 субъединиц, шесть из которых являются каталитическими, другие шесть – регуляторными. На рис. 4.2.4 приведена субъединичная структура АКТФ (каталитические субъединицы окрашены в голубой и зеленый цвет, регуляторные – оттенки желтого).
Последние связывают аллостерические эффекторы CTP и АТР. Как и гемоглобин АКТФ может существовать в двух конформациях: менее активном Т-состоянии (от англ. tense — напряженное) и более активном R-состоянии (от англ. relaxed — расслабленное). Субстрат и эффекторы влияют на равновесие между обоими состояниями и тем самым на сигмоидность кривой. С возрастанием концентрации аспартата равновесие смещается к R-форме. АТР стабилизирует R-состояние путем связывания с регуляторной субъединицей. Напротив, присоединение СТР содействует переходу в Т-состояние. Структурные перестройки между R- и Т-состояниями особенно драматичны в случае АКТФ, поскольку при Т→R-переходе каталитические субъединицы удаляются друг от друга на 1,2 нм; кроме того, субъединицы поворачиваются вокруг оси симметрии. При этом сами конформации субъединиц меняются незначительно.

Рис. 4.2.4. Структура аспартаткарбамоилтрансферазы
Аллостерические эффекторы в зависимости от природы фермента могут влияять на максимальную скорость реакции – Vmax, на [S]0,5 и коэффициент Хилла – h. Если изменяется преимущественно Vmax, то фермент относится к так называемому V-типу ферментов. Ферменты, у которых у которых аллостерические эффекты отражаются только на [S] 0,5 и h, относятся к так называемому, К-типу аллостерических ферментов. АКТФ, наряду с гемоглобином, относится к К-типу аллостерических ферментов.
АКТФ имеют сигмоидную (S-образную) кривую насыщения субстратом – аспартатом. Активность фермента ингибируется цитидинтрифосфатом CTP — конечным продуктом анаболического пути обмена пиримидинов и активируется начальным участником — АТР. Ингибитор СТР вызывает смещение кривой зависимости скорости реакции от концентрации аспартата вправо с возрастанием [S]0,5 и h (рис. 4.2.5, кривая II). Активатор АТР, напротив, вызывает смещение влево; он уменьшает как [S] 0,5, так и h (рис. 4.2.5, кривая III).

Рис. 4.2.5. Зависимость скорости реакции, катализируемой аспартаткарбамоилтрансферазой (I – нативный фермент; II – фермент в присутствии СТР; III – фермент в присутствии АТР)
При регуляции мультиферментных комплексов таких, как, например, пируватдегидрогеназный комплекс, аллостерические механизмы осуществляются как участниками процесса окислительного декарбоксилирования пирувата (рис. 4.2.6 А), так и внешними по отношению к данному процессу, метаболитами (рис. 4.2.6 Б).

Рис. 4.2.6. Регуляция активности пируватдегидрогеназы (А – аллостерическая регуляция пируватдегидрогеназы; Б – аллостерическая регуляция киназы пируватдегидрогеназы; ковалентная модификация пируватдегидрогеназы ( + –положительный эффект, - отрицательный)
Регуляция метаболических путей
Большинство метаболических путей регулируется на уровне скорость-лимитирующих ферментов через различные механизмы, связанные с изменениями конформации фермента, действующими на каталитический участок. Эти регуляторные механизмы включают: 1)аллостерическую активацию, либо ингибирование; 2) ковалентную модификацию; 3) белок-белковые взаимодействия между регуляторными и каталитическими субъединицами или между двумя белками; 4) протеолитическое расщепление.
Эти типы регуляции могут быстро осуществлять переход фермента от неактивной к полностью активной конформации. В этой лекции мы остановимся на регуляции метаболических путей с помощью аллостерического механизма. Остальные из вышеперечисленных типов регуляции рассматриваются в лекции 4.3.
Регуляторные механизмы для скорость-лимитирующего фермента пути всегда отражают функцию метаболического пути в соответствующей ткани. Регуляция по типу обратной связи (feedback regulation) – конечный продукт пути прямо или опосредованно контролирует скорость своего собственного синтеза. Примером метаболического пути, в котором конечный продукт – пиримидиновый нуклеотид (СТР) регулирует свое собственное образование, является биосинтез пиримидинов, а аспартаткарбамоилтрансфераза является регуляторным ферментом этого пути.
Опережающая регуляция (feedforward regulation) – контроль скорости пути субстратом. Примером ее является процесс гликолиза, к котором фруктозо-1,6-дифосфат, образующийся в ходе ФФК реакции, является аллостерическим активатором пируваткиназа, способствуя более интенсивному превращению пирувата.
Регуляция по типу обратной связи характерна для анаболических процессов, тогда как опережающая регуляция характерна для катаболических процессов.
Метаболические пути также регулируются через компартментализацию ферментов.
