
- •Учебное пособие
- •Раздел 1. Структура и свойства ферментов
- •Инженерная энзимология. Иммобилизованные ферменты. Новые пути практического использования ферментов. Применение ферментов в промышленности, сельском хозяйстве, медицине
- •Принцип классификации ферментов. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Основные положения систематической и тривиальной номенклатуры ферментов
- •Способы количественного выражения активности ферментов. Единицы активности. Удельная и молекулярная активность
- •Методы определения активности ферментов: колориметрический, спектрофотометрический, флуориметрический, манометрический, биолюминесцентный и др.
- •Прямой и непрямой оптический тест Варбурга. Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
- •Лекция 1.2 выделение и очистка ферментов
- •Разрушение клеток и экстракция белков
- •Тепловая денатурация
- •Осаждение белков
- •Гель-фильтрация
- •Разделение белков путем адсорбции
- •Выбор ионообменника
- •Элюция адсорбированного белка
- •Аффинная хроматография
- •Гидрофобная хроматография
- •Металлохелатная аффинная хроматография
- •Высокоэффективная жидкостная хроматография
- •Электрофорез
- •Изоэлектрическое фокусирование
- •Капиллярный электрофорез
- •Двумерные системы электрофореза
- •Кристаллизация белков
- •Лекция 1.3 уровни структурной организации ферментов
- •Многостадийный процесс образования пространственной структуры белка
- •Механизмы регуляции процесса сворачивания полипептидной цепи внутри клетки
- •Ферменты, участвующие в фолдинге белка
- •Специальные белки, увеличивающие эффективность сворачивания полипептидной цепи в нативную конформацию
- •Посттрансляционная модификация белка
- •Роль доменов в пространственной организации молекул ферментов
- •Увеличение числа доменов в ферменте и усложнение взаимодействий между ними
- •Роль доменов в формирование активного центра фермента
- •Роль доменов в регуляции ферментативной активности
- •Роль доменов в связывание ферментов с мембранами
- •Полифункциональные ферменты
- •Бифункциональные ферменты, катализирующие реакции одного метаболического пути
- •Бифункциональные ферменты, катализирующие противоположно направленные реакции
- •Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
- •Классификация кофакторов
- •Функции кофакторов
- •Кофакторы окислительно-восстановительных процессов Никотинамидные кофакторы
- •Кофакторы переноса групп Коферменты – производные пиридоксина
- •Кофакторы процессов синтеза, изомеризации и расщепления с-с связей Биотин
- •Роль металлов в функционировании ферментов
- •Лекция 1.5. Топография активных центров простых и сложных ферментов
- •Методы изучения активных центров ферментов
- •Раздел 2. Кинетика и термодинамика
- •Ферментативных реакций
- •Лекция 2.1.
- •Кинетика химических реакций
- •Скорость химической реакции
- •Основной постулат химической кинетики ‒ закон действия масс
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Уравнения односторонних реакций 0-го, 1-го и 2-ого порядка
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Молекулярность элементарных реакций
- •Методы определения порядка реакции
- •Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
- •Катализ
- •Лекция 2.2. Стационарная кинетика ферментативный реакций
- •Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Лекция 2.3. Ингибиторы ферментов.
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Бесконкурентное ингибирование
- •Смешанный тип ингибирования
- •Субстратное ингибирование
- •Методы определения константы ингибирования. Метод Диксона
- •Лекция 2.4 Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •Методы определения коэффициента Хилла
- •Раздел 3.Механизмы ферментативного катализа
- •Сущность явления катализа
- •Стадии образования фермент-субстратного комплекса
- •Природа сил, стабилизирующих различные конформационные состояния ферментсубстратного комплекса
- •Электростатические взаимодействия
- •Водородные связи
- •Вандерваальсовы взаимодействия
- •Гидрофобные взаимодействия
- •Факторы, определяющие эффективность и специфичность ферментативного катализа
- •Физико-химические механизмы ферментативного катализа
- •Лекция 3.2
- •Механизм действия гидролаз на примере карбоксипептидазы а
- •Связывание субстрата карбоксипептидазой а
- •Работы Липскомба с сотрудниками по установлению молекулярного механизма действия кпа
- •Методы для изучения механизма действия ферментов
- •Лекция 3.3 Специфичность – уникальное свойство ферментов
- •Относительная или групповая специфичность действия
- •Абсолютная специфичность действия
- •Стереоспецифичность ферментов
- •Концепция стерического соответствия «ключ-замок»
- •Концепция индуцированного соответствия
- •Раздел 4. Контроль активности ферментов лекция 4.1. Ферменты в клетке и организованных системах
- •Распределение ферментов в клетке
- •Ферменты, присутствующие в ядре
- •Ферменты митохондрий
- •Лизосомальные ферменты
- •Ферменты эндоплазматического ретикулума
- •Ферменты, локализованные в цитозоле
- •Мембранные ферменты
- •Уровни структурной организации ферментов в клетке
- •Мультиферментные комплексы
- •Пируватдегидрогеназный комплекс
- •Мультиферментные конъюгаты
- •Метаболоны
- •Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
- •Изостерическая регуляция
- •Изоферменты
- •Лекция 4.3 ковалентная модификация ферментов и ее типы
- •Лекция 4.4
- •Регуляция количества ферментов в клетке
- •Контроль количества ферментов в клетке – процесс, зависящий от соотношения скоростей их биосинтеза и деградации.
- •Время полужизни различных ферментов
- •Фермент
- •Аминокислоты
- •Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
- •Убиквитин-протеосомный путь деградации белков у эукариот. Убиквитин – белок, маркирующий белки для деградации. Строение 26s протеосомы
- •Раздел 5. Прикладное значение ферментов лекция 5.1. Генетическая инженерия ферментов
- •Использование рекомбинантных ферментов
- •Лекция 5.2 Ферменты в медицине (часть I)
- •Энзимодиагностика Органная специфичность в распределении ферментов
- •Ферменты сыворотки крови
- •Факторы, влияющие на уровень ферментов во внеклеточной жидкости
- •Диагностическое значение снижения ферментативной активности
- •Неспецифическое повышение ферментативной активности
- •Применение ферментов в качестве аналитических реагентов
- •Лактатдегидрогеназа
- •Лекция 5.3 Ферменты в медицине (часть II) Энзимопатии
- •Врождённые (наследственные) энзимопатии
- •Механизм возникновения наследственных энзимопатий
- •Блок обмена веществ
- •Примеры наследственных энзимопатий
- •Приобретённые энзимопатии
- •Энзимотерапия Использование ферментов в качестве лекарственных препаратов
- •Использование ингибиторов ферментов в качестве лекарственных препаратов
- •Библиографический список
Лекция 2.2. Стационарная кинетика ферментативный реакций
В изучении свойств ферментов, а также решении ряда научно-исследовательских и практических задач биохимии, биофизики, микробиологии и биотехнологии ведущая роль отводится ферментативной кинетике. Опираясь на знания таких параметров ферментативной кинетики, как константа Михаэлиса (Км) и максимальная скорость реакции (Vmax), исследователи получают важную информацию не только о сродстве изучаемого фермента к субстрату, но и о возможности использования его в практических целях.
В ферментативной кинетике концепция стационарности применима к к концентрациям связанных с ферментом интермедиатов. Когда фермент смешивается с избытком субстрата наблюдается начальный период, известный как предстационарное состояние, в течение которого концентрации этих интермедиатов достигают стационарного уровня. По достижении интермедиатами стационарных концентраций скорость реакции относительно медленно изменяется со временем и именно в данный период традиционно измеряют скорости энзиматических реакций. Стационарное состояние является аппроксимацией, поскольку субстрат постепенно превращается в ходе эксперимента. Но, принимая во внимание, что измерения осущесвляются за короткий промежуток времени, когда концентрация субстрата изменяется незначительно, стационарное состояние является хорошей аппроксимацией. Хотя изучение предстационарной кинетики позволяет анализировать механизмы ферментативного катализа, стационарная кинетика более важна для измерения каталитической активности фермента при стационарных состояниях в клетке.
Уравнение Михаэлиса-Ментен
Впервые А. Браун (Brown A.J.) и затем В.Анри (Henri V.) в начале ХХ века высказали предположение о том, что в основе ферментативной реакции лежит обратимое взаимодействис субстрата с ферментом с образованием комплекса, который далее распадается с образованием продуктов реакции и регенерацией исходного фермента. Эта гипотеза была далее развита в работах Михаэлиса (L. Michaelis) и Ментен (M.L. Menten) (1913 г.) и позднее – Бригсом (G.E. Briggs) и Холденом (J.B.S. Haldane) (1925 г.).
Кинетическую схему простейшей односторонней ферментативной реакции превращения одного субстрата в продукт можно представить следующим образом:
 (1)
(1)
Ферментативная реакция протекает в два этапа. На первом этапе фермент и субстрат образуют фермент-субстратный комплекс ES. Этот этап является быстрым и обратимым, он не сопровождается какими-либо химическими изменениями субстрата. Константы скорости реакции образования фермент-субстратного комплекса и обратного его распада равны соответственно k+1 и k-1. В образовании фермент-субстратного комплекса (ФСК, комплекс Михаэлиса) принимают участие нековалентные взаимодействия.
Каталитический процесс осуществляется на втором этапе реакции с константой первого порядка k+2 (kcat, число оборотов фермента). Комплекс Михаэлиса распадается с образованием конечного продукта реакции Р и регенерацией исходного фермента. Распад фермент-субстратного комплекса может происходить по-разному: в данной кинетической схеме он распадается в одну стадию, но в других случаях этих стадий может быть несколько.
Исходя из уравнения (1), можно расписать уравнения для скоростей отдельных стадий реакции.
Скорость образования фермент-субстратного комплекса:
![]() .
.
Скорость обратной реакции (диссоциации комплекса на исходные вещества):
![]() .
.
Скорость распада комплекса ES с образованием продуктов реакции и регенерацией фермента:
![]() .
.
Стационарное течение процесса возможно тогда, когда концентрация субстрата существенно превосходит концентрацию фермента ([S]>> [E]). В этом случае распад комплекса ES по реакциям (+2) и (-1) уравновешивается его образованием по реакции (+1). Поэтому для условия стационарности можно записать:
![]()
или
![]() .
.
Обозначив общую концентрацию фермента через [E]0, при условии, что [E]0 = [E] + [ES], преобразуем предыдущее уравнение
![]() .
.
Откуда концентрация фермент-субстратного комплекса будет равна
![]() .
.
Обозначив
![]() ,
,
Получим
![]() .
.
Скорость ферментативной реакции, измеряемая согласно схеме (1) по образованию продукта реакции Р из комплекса ES, может быть выражена следующим образом
![]() .
.
Подставляя в это выражение найденное значение [ES], получим
(2)![]()
Данное уравнение отражает зависимость скорости ферментативной реакции от концентрации фермента и субстрата. Константа Км носит название константы Михаэлиса и имеет размерность концентрации субстрата. Уравнение (2) свидетельствует, что зависимость скорости ферментативной реакции от концентрации субстрата при [E]0=const является гиперболической функцией (рис. 2.2.1).
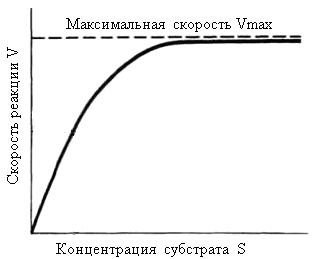
Рис.2.2.1. Зависимость скорости ферментативной реакции от концентрации субстрата
Кривая представляет собой равнобочную гиперболу. При достаточно малых концентрациях субстрата, когда [S] << Км, можно принять, что Км + [S] ≈ Км и тогда
V = k+2[E]0, [S]/ Км,
поэтому реакция имеет первый порядок по отношению к субстрату и является линейной функцией концентрации субстрата.
Когда [S] = Км, скорость реакции является полумаксимальной, т.е. v= 1/2 Vmax. В области высоких значений концентрации субстрата, когда [S] >> Км, можно принять, что Км + [S] ≈ [S], и тогда
v ≈ k+2[E]0 = Vmax,
а реакция имеет нулевой порядок по отношению к субстрату. Следовательно, при достижении определенной концентрации субстрата скорость ферментативной реакции достигает максимального значения Vmax и при дальнейшем увеличении концентрации субстрата не изменяется.
Смысл такого рода зависимости очевиден: скорость ферментативной реакции определяется в целом концентрацией фермент-субстратного комплекса и при малых концентрациях субстрата концентрация комплекса Михаэлиса пропорциональна [S], тогда как при избытке субстрата фактически весь фермент находится в форме ES. Дальнейшее повышение концентрации субстрата не приводит к увеличению [ES].
С учетом приведенного выше выражения, окончательное уравнение зависимости скорости ферментативной реакции от концентрации фермента и субстрата приобретает вид
(3)
![]() .
.
Уравнение (3) является фундаментальным уравнением ферментативной кинетики и обычно называется уравнением Михаэлиса-Ментен.
Скорость реакции приближается к максимальной достаточно медленно, и даже при [S]= 10Км, величина скорости достигает только 0,91 Vmax. В связи с этим значение максимальной скорости очень часто трудно измерить и его приходится рассчитывать из скоростей, наблюдаемых при концентрациях субстрата ниже насыщающих.
Согласно уравнения (3), скорость реакции при данной концентрации субстрата линейно зависит от концентрации фермента. В случае значительного числа ферментативных реакций это наблюдается в действительности. На рис. 2.2.2 приведен пример зависимости скорости ферментативной реакции от концентрации фермента.

Рис. 2.2.2. Зависимость скорости от концентрации фермента
Линейный характер этой зависимости, наблюдающийся в достаточно широком интервале [E]0, не будет меняться до тех пор, пока соблюдаются условие существенного превышения концентрации субстрата над концентрацией фермента. При значительном повышении концентрации фермента будет наблюдаться отклонение от линейной зависимости и при некоторой концентрации фермента дальнейшего повышения скорости реакции происходить не будет, что обусловлено отсутствием достаточного количества свободного субстрата. В связи с этим при изучении влияния различных концентраций фермента необходимо, как и всегда, определять начальную скорость ферментативной реакции, когда глубина превращения субстрата незначительна и его концентрация остается достаточно высокой (соблюдается условие [S]>> [E]0).
В тех же случаях когда при соблюдении условия [S]>> [E]0 не наблюдается линейной зависимости между скоростью реакции и общей концентрацией фермента, для описания кинетики фермента нельзя применять уравнение Михаэлиса-Ментен.
