
- •Учебное пособие
- •Раздел 1. Структура и свойства ферментов
- •Инженерная энзимология. Иммобилизованные ферменты. Новые пути практического использования ферментов. Применение ферментов в промышленности, сельском хозяйстве, медицине
- •Принцип классификации ферментов. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Основные положения систематической и тривиальной номенклатуры ферментов
- •Способы количественного выражения активности ферментов. Единицы активности. Удельная и молекулярная активность
- •Методы определения активности ферментов: колориметрический, спектрофотометрический, флуориметрический, манометрический, биолюминесцентный и др.
- •Прямой и непрямой оптический тест Варбурга. Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
- •Лекция 1.2 выделение и очистка ферментов
- •Разрушение клеток и экстракция белков
- •Тепловая денатурация
- •Осаждение белков
- •Гель-фильтрация
- •Разделение белков путем адсорбции
- •Выбор ионообменника
- •Элюция адсорбированного белка
- •Аффинная хроматография
- •Гидрофобная хроматография
- •Металлохелатная аффинная хроматография
- •Высокоэффективная жидкостная хроматография
- •Электрофорез
- •Изоэлектрическое фокусирование
- •Капиллярный электрофорез
- •Двумерные системы электрофореза
- •Кристаллизация белков
- •Лекция 1.3 уровни структурной организации ферментов
- •Многостадийный процесс образования пространственной структуры белка
- •Механизмы регуляции процесса сворачивания полипептидной цепи внутри клетки
- •Ферменты, участвующие в фолдинге белка
- •Специальные белки, увеличивающие эффективность сворачивания полипептидной цепи в нативную конформацию
- •Посттрансляционная модификация белка
- •Роль доменов в пространственной организации молекул ферментов
- •Увеличение числа доменов в ферменте и усложнение взаимодействий между ними
- •Роль доменов в формирование активного центра фермента
- •Роль доменов в регуляции ферментативной активности
- •Роль доменов в связывание ферментов с мембранами
- •Полифункциональные ферменты
- •Бифункциональные ферменты, катализирующие реакции одного метаболического пути
- •Бифункциональные ферменты, катализирующие противоположно направленные реакции
- •Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
- •Классификация кофакторов
- •Функции кофакторов
- •Кофакторы окислительно-восстановительных процессов Никотинамидные кофакторы
- •Кофакторы переноса групп Коферменты – производные пиридоксина
- •Кофакторы процессов синтеза, изомеризации и расщепления с-с связей Биотин
- •Роль металлов в функционировании ферментов
- •Лекция 1.5. Топография активных центров простых и сложных ферментов
- •Методы изучения активных центров ферментов
- •Раздел 2. Кинетика и термодинамика
- •Ферментативных реакций
- •Лекция 2.1.
- •Кинетика химических реакций
- •Скорость химической реакции
- •Основной постулат химической кинетики ‒ закон действия масс
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Уравнения односторонних реакций 0-го, 1-го и 2-ого порядка
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Молекулярность элементарных реакций
- •Методы определения порядка реакции
- •Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
- •Катализ
- •Лекция 2.2. Стационарная кинетика ферментативный реакций
- •Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Лекция 2.3. Ингибиторы ферментов.
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Бесконкурентное ингибирование
- •Смешанный тип ингибирования
- •Субстратное ингибирование
- •Методы определения константы ингибирования. Метод Диксона
- •Лекция 2.4 Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •Методы определения коэффициента Хилла
- •Раздел 3.Механизмы ферментативного катализа
- •Сущность явления катализа
- •Стадии образования фермент-субстратного комплекса
- •Природа сил, стабилизирующих различные конформационные состояния ферментсубстратного комплекса
- •Электростатические взаимодействия
- •Водородные связи
- •Вандерваальсовы взаимодействия
- •Гидрофобные взаимодействия
- •Факторы, определяющие эффективность и специфичность ферментативного катализа
- •Физико-химические механизмы ферментативного катализа
- •Лекция 3.2
- •Механизм действия гидролаз на примере карбоксипептидазы а
- •Связывание субстрата карбоксипептидазой а
- •Работы Липскомба с сотрудниками по установлению молекулярного механизма действия кпа
- •Методы для изучения механизма действия ферментов
- •Лекция 3.3 Специфичность – уникальное свойство ферментов
- •Относительная или групповая специфичность действия
- •Абсолютная специфичность действия
- •Стереоспецифичность ферментов
- •Концепция стерического соответствия «ключ-замок»
- •Концепция индуцированного соответствия
- •Раздел 4. Контроль активности ферментов лекция 4.1. Ферменты в клетке и организованных системах
- •Распределение ферментов в клетке
- •Ферменты, присутствующие в ядре
- •Ферменты митохондрий
- •Лизосомальные ферменты
- •Ферменты эндоплазматического ретикулума
- •Ферменты, локализованные в цитозоле
- •Мембранные ферменты
- •Уровни структурной организации ферментов в клетке
- •Мультиферментные комплексы
- •Пируватдегидрогеназный комплекс
- •Мультиферментные конъюгаты
- •Метаболоны
- •Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
- •Изостерическая регуляция
- •Изоферменты
- •Лекция 4.3 ковалентная модификация ферментов и ее типы
- •Лекция 4.4
- •Регуляция количества ферментов в клетке
- •Контроль количества ферментов в клетке – процесс, зависящий от соотношения скоростей их биосинтеза и деградации.
- •Время полужизни различных ферментов
- •Фермент
- •Аминокислоты
- •Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
- •Убиквитин-протеосомный путь деградации белков у эукариот. Убиквитин – белок, маркирующий белки для деградации. Строение 26s протеосомы
- •Раздел 5. Прикладное значение ферментов лекция 5.1. Генетическая инженерия ферментов
- •Использование рекомбинантных ферментов
- •Лекция 5.2 Ферменты в медицине (часть I)
- •Энзимодиагностика Органная специфичность в распределении ферментов
- •Ферменты сыворотки крови
- •Факторы, влияющие на уровень ферментов во внеклеточной жидкости
- •Диагностическое значение снижения ферментативной активности
- •Неспецифическое повышение ферментативной активности
- •Применение ферментов в качестве аналитических реагентов
- •Лактатдегидрогеназа
- •Лекция 5.3 Ферменты в медицине (часть II) Энзимопатии
- •Врождённые (наследственные) энзимопатии
- •Механизм возникновения наследственных энзимопатий
- •Блок обмена веществ
- •Примеры наследственных энзимопатий
- •Приобретённые энзимопатии
- •Энзимотерапия Использование ферментов в качестве лекарственных препаратов
- •Использование ингибиторов ферментов в качестве лекарственных препаратов
- •Библиографический список
Смешанный тип ингибирования
Типы ингибирования, рассмотренные выше, являются предельными случаями в широком спектре возможных эффектов. В случае двусубстратных реакций, при определенной концентрации ингибитора, часто можно наблюдать ингибирование смешанного типа.
Общая схема ингибирования смешанного типа.

При этом Ki1 ≠ Ki2. Изменяются как константа Михаэлиса, так и максимальная скорость, но не в одинаковой степени:
![]() (8)
(8)
Смешанное конкурентное-неконкурентное ингибирование. В этом варианте ингибирования Ki2˃ Ki1. Сродство фермента к субстрату в присутствии ингибитора данного типа увеличивается, а максимальная скорость ферментативной реакции снижается (2.3.14).
 ,
,
 (9)
(9)
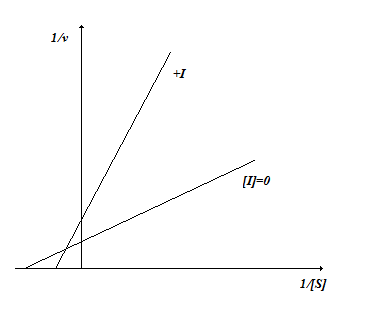
Рис. 2.3.14. Смешанное конкурентное-неконкурентное
Смешанное неконкурентное-бесконкурентное ингибирование. В этом случае Ki1 ˃ Ki2. Этот ингибитор снижает и константу Михаэлиса и максимальную скорость реакции (рис. 2.3.15).
 ,
,
 (10)
(10)

Рис. 2.3.15. Смешанное неконкурентное-бесконкуоентное.
Примером смешанного ингибирования является воздействие ртутьорганического соединения мертиолата на сахаразу грибов. Это вещество широко используется в промышленности для подавления роста микромицетов.
Субстратное ингибирование
Для многих ферментативных реакций при увеличении концентрации субстрата начальная скорость ферментативной реакции проходит через максимум, а затем уменьшается. Подобного рода зависимость можно описать, исходя из предположения об образовании в процессе реакции непродуктивного тройного комплекса ЕS2. В этом случае кинетическая схема ферментативной реакции выглядит следующим образом:

Зависимость скорости реакции от концентрации субстрата после математической обработки этой схемы имеет вид:
![]() (11)
(11)
Где К′s – субстратная константа, учитывающая сродство фермента ко второй молекуле субстрата. Анализ этого уравнения, как и уравнения Михаэлиса-Ментен, целесообразно проводить раздельно в области низких ([S] < Кs´) и высоких ([S] ˃ Кm ) концентрациях субстрата.
При низких значениях концентрации субстрата уравнение упрощается до классического уравнения Михаэлиса-Ментен (рис. 2.3.16а), при линеаризации которого можно определить Кm, Vmax, kcat (k+2 ).
![]()
В области высоких концентраций субстрата уравнение принимает вид:
![]() (12)
(12)
Линеаризация этого уравнения в координатах (1/v, [S]) позволяет определить Vmax и Кs´ (рис.2.3.16б).
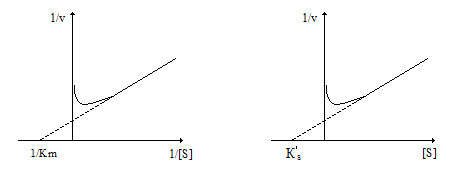
а) б)
Рис. 2.3.16. Линеаризация уравнения (12) в координатах (1/v 1/[S]) –а) и (1/v ; [S]) – б)
Зная величины Кm и Кs´, можно рассчитать оптимальную концентрацию субстрата по формуле:
![]() (13)
(13)
Методы определения константы ингибирования. Метод Диксона
Величины Кi можно измерить различными методами, как экспериментально, так и при помощи расчетов.
Если известна только одна концентрация ингибитора, то константу ингибирования можно определить, используя графики в координатах Лайнуивера-Берка. Найдя кажущиеся и истинные значения константы Михаэлиса и максимальной скорости для двух графиков (в отсутствии и в присутствии ингибитора) и подставив эти значения в формулы (2), (4), (7), (9), (10).
Наиболее удобен для определения константы ингибирования метод Диксона. Этот простой графический метод позволяет определять Кi непосредственно. Если определять скорость реакции в условиях постоянной концентрации субстрата и различных концентраций ингибитора, то график зависимости 1/v от [I] будет представлять собой прямую (рис. 2.3.17).

Рис. 2.3.17. Графическое определение ингибиторных констант (метод Диксона). Во всех случаях S1˃S2
В этом случае для определения ингибиторной константы достаточно определить скорость реакции всего для двух концентраций субстрата.
