
- •Учебное пособие
- •Раздел 1. Структура и свойства ферментов
- •Инженерная энзимология. Иммобилизованные ферменты. Новые пути практического использования ферментов. Применение ферментов в промышленности, сельском хозяйстве, медицине
- •Принцип классификации ферментов. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Основные положения систематической и тривиальной номенклатуры ферментов
- •Способы количественного выражения активности ферментов. Единицы активности. Удельная и молекулярная активность
- •Методы определения активности ферментов: колориметрический, спектрофотометрический, флуориметрический, манометрический, биолюминесцентный и др.
- •Прямой и непрямой оптический тест Варбурга. Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
- •Лекция 1.2 выделение и очистка ферментов
- •Разрушение клеток и экстракция белков
- •Тепловая денатурация
- •Осаждение белков
- •Гель-фильтрация
- •Разделение белков путем адсорбции
- •Выбор ионообменника
- •Элюция адсорбированного белка
- •Аффинная хроматография
- •Гидрофобная хроматография
- •Металлохелатная аффинная хроматография
- •Высокоэффективная жидкостная хроматография
- •Электрофорез
- •Изоэлектрическое фокусирование
- •Капиллярный электрофорез
- •Двумерные системы электрофореза
- •Кристаллизация белков
- •Лекция 1.3 уровни структурной организации ферментов
- •Многостадийный процесс образования пространственной структуры белка
- •Механизмы регуляции процесса сворачивания полипептидной цепи внутри клетки
- •Ферменты, участвующие в фолдинге белка
- •Специальные белки, увеличивающие эффективность сворачивания полипептидной цепи в нативную конформацию
- •Посттрансляционная модификация белка
- •Роль доменов в пространственной организации молекул ферментов
- •Увеличение числа доменов в ферменте и усложнение взаимодействий между ними
- •Роль доменов в формирование активного центра фермента
- •Роль доменов в регуляции ферментативной активности
- •Роль доменов в связывание ферментов с мембранами
- •Полифункциональные ферменты
- •Бифункциональные ферменты, катализирующие реакции одного метаболического пути
- •Бифункциональные ферменты, катализирующие противоположно направленные реакции
- •Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
- •Классификация кофакторов
- •Функции кофакторов
- •Кофакторы окислительно-восстановительных процессов Никотинамидные кофакторы
- •Кофакторы переноса групп Коферменты – производные пиридоксина
- •Кофакторы процессов синтеза, изомеризации и расщепления с-с связей Биотин
- •Роль металлов в функционировании ферментов
- •Лекция 1.5. Топография активных центров простых и сложных ферментов
- •Методы изучения активных центров ферментов
- •Раздел 2. Кинетика и термодинамика
- •Ферментативных реакций
- •Лекция 2.1.
- •Кинетика химических реакций
- •Скорость химической реакции
- •Основной постулат химической кинетики ‒ закон действия масс
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Уравнения односторонних реакций 0-го, 1-го и 2-ого порядка
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Молекулярность элементарных реакций
- •Методы определения порядка реакции
- •Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
- •Катализ
- •Лекция 2.2. Стационарная кинетика ферментативный реакций
- •Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Лекция 2.3. Ингибиторы ферментов.
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Бесконкурентное ингибирование
- •Смешанный тип ингибирования
- •Субстратное ингибирование
- •Методы определения константы ингибирования. Метод Диксона
- •Лекция 2.4 Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •Методы определения коэффициента Хилла
- •Раздел 3.Механизмы ферментативного катализа
- •Сущность явления катализа
- •Стадии образования фермент-субстратного комплекса
- •Природа сил, стабилизирующих различные конформационные состояния ферментсубстратного комплекса
- •Электростатические взаимодействия
- •Водородные связи
- •Вандерваальсовы взаимодействия
- •Гидрофобные взаимодействия
- •Факторы, определяющие эффективность и специфичность ферментативного катализа
- •Физико-химические механизмы ферментативного катализа
- •Лекция 3.2
- •Механизм действия гидролаз на примере карбоксипептидазы а
- •Связывание субстрата карбоксипептидазой а
- •Работы Липскомба с сотрудниками по установлению молекулярного механизма действия кпа
- •Методы для изучения механизма действия ферментов
- •Лекция 3.3 Специфичность – уникальное свойство ферментов
- •Относительная или групповая специфичность действия
- •Абсолютная специфичность действия
- •Стереоспецифичность ферментов
- •Концепция стерического соответствия «ключ-замок»
- •Концепция индуцированного соответствия
- •Раздел 4. Контроль активности ферментов лекция 4.1. Ферменты в клетке и организованных системах
- •Распределение ферментов в клетке
- •Ферменты, присутствующие в ядре
- •Ферменты митохондрий
- •Лизосомальные ферменты
- •Ферменты эндоплазматического ретикулума
- •Ферменты, локализованные в цитозоле
- •Мембранные ферменты
- •Уровни структурной организации ферментов в клетке
- •Мультиферментные комплексы
- •Пируватдегидрогеназный комплекс
- •Мультиферментные конъюгаты
- •Метаболоны
- •Лекция 4.2 Изостерические и аллостерические механизмы регуляции активности ферментов
- •Изостерическая регуляция
- •Изоферменты
- •Лекция 4.3 ковалентная модификация ферментов и ее типы
- •Лекция 4.4
- •Регуляция количества ферментов в клетке
- •Контроль количества ферментов в клетке – процесс, зависящий от соотношения скоростей их биосинтеза и деградации.
- •Время полужизни различных ферментов
- •Фермент
- •Аминокислоты
- •Биосинтез ферментов и его регуляция на генетическом уровне. Конститутивные и индуцибельные (адаптивные) ферменты. Репрессия и индукция биосинтеза ферментов
- •Убиквитин-протеосомный путь деградации белков у эукариот. Убиквитин – белок, маркирующий белки для деградации. Строение 26s протеосомы
- •Раздел 5. Прикладное значение ферментов лекция 5.1. Генетическая инженерия ферментов
- •Использование рекомбинантных ферментов
- •Лекция 5.2 Ферменты в медицине (часть I)
- •Энзимодиагностика Органная специфичность в распределении ферментов
- •Ферменты сыворотки крови
- •Факторы, влияющие на уровень ферментов во внеклеточной жидкости
- •Диагностическое значение снижения ферментативной активности
- •Неспецифическое повышение ферментативной активности
- •Применение ферментов в качестве аналитических реагентов
- •Лактатдегидрогеназа
- •Лекция 5.3 Ферменты в медицине (часть II) Энзимопатии
- •Врождённые (наследственные) энзимопатии
- •Механизм возникновения наследственных энзимопатий
- •Блок обмена веществ
- •Примеры наследственных энзимопатий
- •Приобретённые энзимопатии
- •Энзимотерапия Использование ферментов в качестве лекарственных препаратов
- •Использование ингибиторов ферментов в качестве лекарственных препаратов
- •Библиографический список
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
КАФЕДРА ФИЗИКО-ХИМИЧЕСКОЙ БИОЛОГИИ
Учебное пособие
по курсу ОСНОВЫ ЭНЗИМОЛОГИИ
(тексты лекций)
Направление 020200.62 «Биология»
КРАСНОЯРСК, 2008
ОГЛАВЛЕНИЕ
|
Раздел 1. Структура и свойства ферментов |
3 |
|
Лекция 1.1. Методы регистрации ферментативной активности |
3 |
|
Лекция 1.2. Выделение и очистка ферментов |
20 |
|
Лекция 1.3. Уровни структурной организации ферментов |
31 |
|
Лекция 1.4. Кофакторы ферментов и их роль в катализе |
43 |
|
Лекция 1.5. Топография активных центров простых и сложных ферментов |
59 |
|
Раздел 2. Кинетика и термодинамика ферментативных реакций |
70 |
|
Лекция 2.1. Кинетика химических реакций |
70 |
|
Лекция 2.2. Стационарная кинетика ферментативных реакций |
86 |
|
Лекция 2.3. Ингибиторы ферментов |
94 |
|
Лекция 2.4. Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен |
109 |
|
Раздел 3. Механизмы ферментативного катализа |
117 |
|
Лекция 3.1. Факторы, определяющие эффективность действия ферментов |
117 |
|
Лекция 3.2. Механизм действия гидролаз на примере карбоксипептидазы А и лизоцима |
128 |
|
Лекция 3.3. Специфичность – уникальное свойство ферментов |
137 |
|
Раздел 4. Контроль активности ферментов |
142 |
|
Лекция 4.1. Ферменты в клетке и в организованных системах |
142 |
|
Лекция 4.2. Изостерические и аллостерические механизмы регуляции активности ферментов |
154 |
|
Лекция 4.3. Ковалентная модификация ферментов и ее типы |
162 |
|
Лекция 4.4. Регуляция количества ферментов в клетке |
174 |
|
Раздел 5. Прикладное значение ферментов |
189 |
|
Лекция 5.1. Генетическая инженерия ферментов |
189 |
|
Лекция 5.2. Ферменты в медицине (Часть I) |
204 |
|
Лекция 5.3. Ферменты в медицине (часть II) |
215 |
|
Библиографический список |
226 |
Раздел 1. Структура и свойства ферментов
ЛЕКЦИЯ 1.1
МЕТОДЫ РЕГИСТРАЦИИ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
Катализ и катализаторы.
Ферменты как особые представители катализаторов
Каждая химическая реакция характеризуется энергией активации (AG), т. е. свободной энергией, которую нужно придать реагирующим молекулам, чтобы произошло химическое превращение. Если осуществляется столкновение молекул с недостаточной свободной молекулой – химическая реакция не происходит. Таким образом, энергия активации – это энергетический барьер, который нужно преодолеть, чтобы произошла реакция.
В процессе химических реакций молекулы вступают в так называемое переходное состояние, характеризующееся менее устойчивой структурой и наибольшей свободной энергией. Катализаторы снижают свободную энергию переходного состояния и, стабилизируя его, облегчают протекание реакции.
Следует учитывать, что в энергии активации присутствует не только энтальпийная (H, тепловая) составляющая, но и энтропийная (S, мера упорядоченности системы). Высокая энтальпийная составляющая свидетельствует о том, что для формирования переходного состояния необходимо существенное ослабление химических связей. Для многих химических реакций механизм активации молекул, по-видимому, сходен, так как H для них практически совпадает и составляет около 50 кДж моль-1. Высокая энтропийная составляющая встречается реже и означает, что в процессе формирования переходного состояния молекулы должны принять строго определенную конформацию.
Таким образом, катализатором называется вещество, ускоряющее химическую реакцию, но само в этой реакции не расходующееся. Функция катализатора состоит в том, что он реагирует с исходными веществами, образуя промежуточное соединение (новое переходное состояние), которое подвергается дальнейшему превращению с пониженной энергией активации. В результате образуются продукты реакции и регенерируется катализатор.
Следует напомнить, что катализатор только ускоряет достижение равновесия в химической реакции, но не изменяет его положения (т.е. соотношения субстрата и продуктов). Присутствие катализатора не вызывает термодинамически невозможной реакции и не влияет на выход продуктов, поскольку катализатор не взаимодействует с продуктами реакции:
Н
 екатализируемая А⇄
В Кр=
екатализируемая А⇄
В Кр=
реакция
К
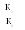
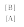 атализируемая А
+Cat
⇄
X
⇄
В + Cat Кр=
атализируемая А
+Cat
⇄
X
⇄
В + Cat Кр=
реакция
Из этих уравнений следует, что константа равновесия реакции (К) не зависит от присутствия катализатора, а следовательно, изменению константы скорости прямой реакции в присутствии катализатора всегда сопутствует соответствующее изменение константы скорости обратной реакции.
Ферменты являются белковыми катализаторами биохимических реакций, большая часть которых в отсутствие ферментов протекала бы крайне медленно. В отличие от небелковых катализаторов (Н+, ОН-, ионы металлов) каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну. Таким образом, ферменты представляют собой реакционно специфические катализаторы.
Механизмы химического и ферментативного катализа принципиально не различаются. Однако при нормальных «физиологических» условиях (рН и температуре) в водных растворах ферменты значительно более эффективны (сильнее снижают свободную энергию переходного состояния), чем химические катализаторы. Кроме того, ферменты, как правило, катализируют только один из возможных путей превращения субстратов, тогда как в ходе обычных химических реакций образуется смесь продуктов.
Еще более существенным моментом является то, что ферменты обладают чрезвычайно высокой стереоспецифичностью, различая, например, оптические изомеры и даже изотопы одного и того же элемента. Это связано с особенностями структуры активных центров ферментов и конформационной «гибкостью» их молекул. Д. Кошланд сформулировал концепцию индуцированного соответствия, согласно которой при связывании специфического субстрата происходит такое изменение конформации фермента, которое перемещает каталитические группы в положение, обеспечивающее эффективное протекание реакции.
Доказательства конформационных изменений в молекуле фермента при взаимодействии с субстратом получены методами ядерного магнитного резонанса (ЯМР) и рентгеноструктурного анализа (РСА). Например, при взаимодействии карбоксипептидазы А с «плохими» (отличающимися по химической структуре) субстратами происходит перемещение остатков двух аминокислот: тирозина и глутаминовой кислоты, которые предположительно участвуют в каталитическом процессе, на 15 и 2 Å соответственно. Этих перемещений достаточно для проявления макрофизических изменений. Такие конформационные изменения могут быть имитированы веществом, не являющимся субстратом данного фермента. Отсюда становятся понятными факты стимулирующего/ингибирующего влияния молекул, не участвующих непосредственно в ферментативной реакции.
