
- •Л.В. Кольцов, м.А. Лосева
- •Глава 1.1 Предмет курса. Основные понятия. Классификация дисперсных систем. Методы получения дисперсных систем
- •Классификация по агрегатному состоянию фаз
- •Глава 1.2 Молекулярно-кинетические свойства дисперсных систем
- •Тема 1.2.1.Броуновское движение
- •Тема 1.2.2. Диффузия
- •Тема 1.2.3. Осмотическое давление
- •Глава 1.3 Оптические свойства и методы исследования дисперсных систем
- •Вопросы для самоконтроля
- •Тема 2.1.1. Термодинамическая характеристика дисперсных систем. Термодинамический метод избыточных величин Гиббса и метод «слоя конечной толщины
- •Тема 2.1.2. Поверхностное натяжение. Методы измерения поверхностного натяжения. Зависимость поверхностного натяжения от температуры и концентрации. Уравнение Шишковского
- •Тема 2.1.3. Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
- •Глава 2.2 Адсорбция
- •Тема 2.2.2. Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции.
- •Тема 2.2.3. Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. Пав. Эффект Ребиндера. Правило Дюкло-Траубе
- •Глава 2.3 Адсорбционные равновесия
- •Тема 2.3.3. Адсорбция на границе «твердое тело – жидкость». Молекулярная адсорбция. Правило выравнивания полярностей Ребиндера
- •Глава 2.4 Адгезия. Когезия. Смачивание и растекание жидкости
- •Тема 2.4.1. Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
- •Тема 2.4.2. Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
- •Глава 2.5 Адсорбция ионов на кристалле. Электрокинетические явления
- •Тема 2.5.1. Образование и строение дэс. Электрокинетический потенциал. Правила написания мицелл
- •Тема 2.5.2. Обменная адсорбция. Иониты. Уравнение Никольского
- •Тема 2.5.3. Электрокинетические явления. Электрофорез. Электроосмос. Расчет -потенциала по скорости электрофореза и электроосмоса. Понятие поверхностной проводимости
- •Электроосмос - направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов (рис. 2.5.3.6).
- •Глава 3.1 Стабилизация и коагуляция дисперсных систем
- •Тема 3.1.1. Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
- •Правила коагуляции:
- •Тема 3.1.3. Теория длфо
- •Тема 3.1.4. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
- •При коагуляции смесью электролитов различают два типа процессов:
- •Тема 3.1.5. Седиментация и диффузия. Гипсометрический закон. Седиментационно-диффузионное равновесие. Скорость седиментации
- •Глава 4.1 Теория структурообразования Управление структурно-механическими свойствами материалов
- •Тема 4.1.2. Классификация дисперсных систем по структурно-механическим свойствам. Возникновение объемных структур в различных дисперсных системах
- •Глава 5.1 Свойства растворов высокомолекулярных соединений
- •Тема 5.1.1. Свойства вмс. Мембранное равновесие Доннана. Набухание вмс. Их растворение. Давление набухания. Степень набухания. Пластификаторы. Уравнение Хаггинса
- •Тема 5.1.2. Белки как полиэлектролиты
- •Тема 5.1.3. Вязкость дисперсных систем и растворов вмс. Уравнение Бингама. Удельная, характеристическая, относительная вязкости. Методы измерения вязкости. Тиксотропия
- •Рассмотрим три наиболее распространенных метода измерения вязкости:
- •Тема 5.1.3. Коллоидные пав
- •Свойства водных растворов пав
- •Глава 6.1 суспензии
- •Глава 6.2 пасты
- •Глава 6.3 эмульсии
- •Глава 6.4 пены
- •Глава 6.5 аэрозоли
- •Классификация аэрозолей
- •Вопросы для самоконтроля
- •Глава 6.6 порошки
- •Поверхностные явления в дисперсных системах
- •443100. Г. Самара, ул. Молодогвардейская, 244. Главный корпус.
- •4 43100. Г. Самара, ул. Молодогвардейская, 244. Корпус №8.
Свойства водных растворов пав
Способность снижать s на границе раздела фаз;
Способность к самопроизвольному мицеллообразованию;
Солюбилизация.
1.
Обусловлена высокой поверхностной
активностью ПАВ:
![]() ,
которая возрастает с увеличением длины
углеводородного радикала – правило
Дюкло-Траубе:увеличение
длины углеводородного радикала на одну
группу –СН2–
приводит к возрастанию поверхностной
активности в 3 – 3,5 раза. При
большой длине углеводородных радикалов
(заметно взаимодействие между молекулами
ПАВ на поверхности) g
увеличивается медленнее, чем по правилу
Дюкло-Траубе. Поверхностную активность
коллоидных ПАВ приближенно оценивают
так:
,
которая возрастает с увеличением длины
углеводородного радикала – правило
Дюкло-Траубе:увеличение
длины углеводородного радикала на одну
группу –СН2–
приводит к возрастанию поверхностной
активности в 3 – 3,5 раза. При
большой длине углеводородных радикалов
(заметно взаимодействие между молекулами
ПАВ на поверхности) g
увеличивается медленнее, чем по правилу
Дюкло-Траубе. Поверхностную активность
коллоидных ПАВ приближенно оценивают
так:
Для
неионогенных ПАВ:
![]() ;
;
Для
ионогенных ПАВ:
![]() ,
гдеs0
– поверхностное натяжение воды, sККМ
- поверхностное натяжение р-ра ПАВ при
ККМ, ККМ – критическая концентрация
мицеллообразования ПАВ, n
- число ионов, образующихся при диссоциации
одной молекулы ПАВ.
,
гдеs0
– поверхностное натяжение воды, sККМ
- поверхностное натяжение р-ра ПАВ при
ККМ, ККМ – критическая концентрация
мицеллообразования ПАВ, n
- число ионов, образующихся при диссоциации
одной молекулы ПАВ.
Адсорбционная способность ПАВ тем выше, чем больше g. Адсорбируясь на частицах дисперсной фазы, молекулы ПАВ создают на их поверхности защитные адсорбционно-сольватные оболочки, препятствующие слипанию частиц дисперсной фазы:
Важная количественная характеристика ПАВ – гидрофильно-липофильный баланс (ГЛБ), характеризующий соотношение между гидрофильными и липофильными свойствами: чем выше число ГЛБ, тем более баланс сдвинут в сторону полярных (гидрофильных свойств). Определяется экспериментально. Числа ГЛБ рассчитываются по уравнению:
ГЛБПАВ = 7 + S(ГЛБ)Г - S(ГЛБ)Л
|
Сумма чисел ГЛБ всех гидрофильных групп |
Сумма чисел ГЛБ всех липофильных групп |
Физический смысл чисел ГЛБ – отношение работы адсорбции молекул ПАВ на границе раздела фазы «масло» к работе адсорбции на той же границе с фазой «вода».
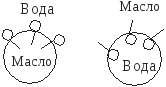
2. По достижении в растворе ККМ самопроизвольно образуются сферические мицеллы (мицеллы Гартли), система становится гетерогенной. Мицелла коллоидного ПАВ – ассоциат дифильных молекул, лиофильные группы которого обращены к растворителю (вода), а лиофобные соединяются друг с другом, образуя ядро.
В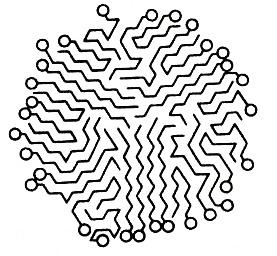 опрос
– почему мицеллообразование происходит
самопроизвольно, если известно, что
образование новой фазы требует затраты
энергии? Так какs
на границе раздела фаз минимально,
энергия, затрачиваемая на образование
мицеллы, невелика, и она с избытком
компенсируется выигрышем энергии за
счет выведения углеводородных хвостов
молекул ПАВ в ядро мицеллы (жидкий
углеводород в результате плотной
упаковки углеводородных цепей), т.е. в
итоге мицеллообразование сопровождается
уменьшением свободной энергии системы.
опрос
– почему мицеллообразование происходит
самопроизвольно, если известно, что
образование новой фазы требует затраты
энергии? Так какs
на границе раздела фаз минимально,
энергия, затрачиваемая на образование
мицеллы, невелика, и она с избытком
компенсируется выигрышем энергии за
счет выведения углеводородных хвостов
молекул ПАВ в ядро мицеллы (жидкий
углеводород в результате плотной
упаковки углеводородных цепей), т.е. в
итоге мицеллообразование сопровождается
уменьшением свободной энергии системы.
Число молекул ПАВ, составляющих мицеллу, называется числом ассоциации n. Для ионогенных ПАВ n увеличивается при понижении температуры и добавлении электролитов.
Для неионогенных ПАВ повышение температуры приводит к увеличению n, а введение электролитов на число ассоциации не влияет.
Сумма молекулярных масс всех молекул в мицелле называется мицеллярной массой. По достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что приводит к их деформации. Этапы изменения форм мицелл можно представить так:
М олекулярный
р-р↔
Мицеллы Гартли ↔
Цилиндрические ↔
Дискообразные ↔
Пластинчатые
олекулярный
р-р↔
Мицеллы Гартли ↔
Цилиндрические ↔
Дискообразные ↔
Пластинчатые
Мицеллы Мак-Бена
↔ Жидкокристаллическая структура ↔ Гелеобразная структура ↔ Твердое кристаллическое ПАВ
Солюбилизация – явление растворения веществ в мицеллах ПАВ, это процесс самопроизвольный и обратимый.
В водных мицеллярных растворах солюбилизируются вещества, нерастворимые в воде – бензол, жиры, органические красители, т.к. ядро мицеллы проявляет свойства неполярной жидкости.
Солюбилизат – вещество, солюбилизированное раствором ПАВ.
Солюбилизатор – ПАВ, солюбилизирующее неполярное вещество.
Способ включения молекул солюбилизата в мицеллы зависит от природы вещества: неполярные углеводороды располагаются в ядрах мицелл, полярные органические вещества (спирты, амины, кислоты) встраиваются в мицеллу так, чтобы их полярные группы были обращены к воде, а липофильные части молекул ориентированы параллельно углеводородным радикалам ПАВ.
Для неионогенных ПАВ характерен еще один способ включения солюбилизата в мицеллы: молекулы солюбилизата не проникают внутрь мицеллы, а закрепляются на их поверхности, располагаясь между полиоксиэтиленовыми цепями.
При солюбилизации неполярных углеводородов в ядрах мицелл размер мицелл увеличивается. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата.
Явление солюбилизации очень широко используется в различных процессах с использованием ПАВ:
Эмульсионная коагуляция;
Получение эмульсионных смазочных жидкостей:
Изготовление фармпрепаратов;
Изготовление пищевых продуктов.
На величину ККМ влияют:
Строение и длина углеводородной цепи;
Характер полярной группы;
Наличие в растворе индифферентных электролитов и неэлектролитов;
Температура.
1-2. Влияние первых двух факторов отражает формула
![]() ,
,
где а – постоянная, характеризующая энергию растворения полярной группы;
b– постоянная, характеризующая удельную энергию растворения, приходящуюся на группу –СН2-;
n- число групп –СН2-,
Т.е., чем больше энергия растворения гидрофобной группы, чем больше их число, тем меньше ККМ, тем легче образуется мицелла. Чем больше энергия растворения полярной группы, роль которой в удержании образующихся ассоциатов в воде, тем больше ККМ.
Гидратация противоионов, окружающих мицеллу, способствует отталкиванию, а менее гидратированные ионы легче адсорбируются на поверхности мицелл, в связи с чем наблюдается уменьшение ККМ и увеличение мицеллярной массы для катионных ПАВ в ряду Cl- < Br- < I- и анионных в ряду Na+ < K+ < Cs+. Мицеллообразование затрудняется с увеличением заряда ионогенной группы.
Величина ККМ ионогенных ПАВ значительно больше, чем неионогенных при одинаковой гидрофобности молекул.
Введение электролитов в водные растворы неионогенных ПАВ мало влияет на величину ККМ и размеры мицеллы.
Введение электролитов в водные растворы ионогенных ПАВ оказывает значительное влияние, которое оценивается уравнением:
![]() ,
,
где а’ и b’ – постоянные, имеющие тот же физический смысл, что и а иb,
k– константа; с – концентрация индифферентного электролита.
Т.е. увеличение концентрации индифферентного электролита уменьшает ККМ – следует из уравнения.
Введение неэлектролитов (органических растворителей) в водные растворы ПАВ тоже приводит к изменению ККМ. При наличии солюбилизации устойчивость мицелл повышается, т.е. уменьшается ККМ. При отсутствии солюбилизации (молекулы неэлектролита внутрь мицеллы не входят), как правило, ККМ увеличивается.
В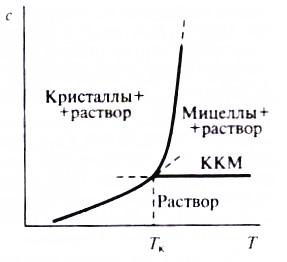 лияние
температуры на ККМ ионогенных ПАВ и
неионогенных различно. Повышение
температуры приводит к увеличению ККМ
ионогенного ПАВ из-за дезагрегирующего
действия теплового движения. Повышение
температуры приводит к уменьшению ККМ
неионогенного ПАВ за счет дегидратации
оксиэтиленовых цепочек.
лияние
температуры на ККМ ионогенных ПАВ и
неионогенных различно. Повышение
температуры приводит к увеличению ККМ
ионогенного ПАВ из-за дезагрегирующего
действия теплового движения. Повышение
температуры приводит к уменьшению ККМ
неионогенного ПАВ за счет дегидратации
оксиэтиленовых цепочек.
Температура начала коллоидной растворимости ПАВ была названа точкой Крафта (ТКр). На фазовой диаграмме раствора ПАВ в районе точки Крафта кривая растворимости ПАВ, которая разграничивает область существования кристаллогидратов ПАВ (а) с мицеллярной областью (в) и областью истинного раствора (с) (ПАВ находится в молекулярно-дисперсном, ионизированном состоянии). Точка Крафта интерпретируется как тройная точка на диаграмме состояния ПАВ, в которой сосуществуют в равновесии мицеллы, ионы и кристаллы ПАВ.
Величина точки Крафта зависит от молекулярного строения ПАВ, природы и концентрации добавок. Изменения структуры ПАВ, приводящие к усилению межмолекулярного притяжения в углеводородных областях, вызывают ее повышение. Так, величина ТКр повышается в гомологических рядах ПАВ по мере роста длины углеводородного радикала.
Вопросы для самоконтроля
Какие вещества называют поверхностно-активными (ПАВ)?
Как классифицируют ПАВ?
Чем отличаются коллоидные ПАВ от истинно растворимых? Что называется критической концентрацией мицеллообразования (ККМ)?
Что такое поверхностная активность коллоидных ПАВ?
Как зависит форма мицелл от концентрации ПАВ в растворе? Каким образом ориентируются молекулы ПАВ в мицеллах в полярной и неполярной средах?
Какое явление называют солюбилизацией? Чем обусловлено это явление? Каково практическое значение этого явления?
Факторы, влияющие на ККМ в растворах ПАВ:
влияние длины углеводородного радикала на ККМ в разных по полярности растворителях;
влияние природы полярной группы молекулы ПАВ;
влияние добавок индифферентного электролита на ККМ ионогенных и неионогенных ПАВ;
зависимость мицеллообразования от температуры, точка Крафта.
Условия образования мицеллярных растворов ПАВ.
Методы определения ККМ. Почему при концентрации выше ККМ поверхностное натяжение растворов ПАВ не изменяется?
Как влияет явление мицеллообразования на подвижность ионов?
|
Раздел 6 |
СТАБИЛИЗАЦИЯ И РАЗРУШЕНИЕ ДИСПЕРСНЫХ СИСТЕМ С РАЗЛИЧНЫМ АГРЕГАТНЫМ СОСТОЯНИЕМ ФАЗ |
