
Лекции / organic_2011_2
.pdf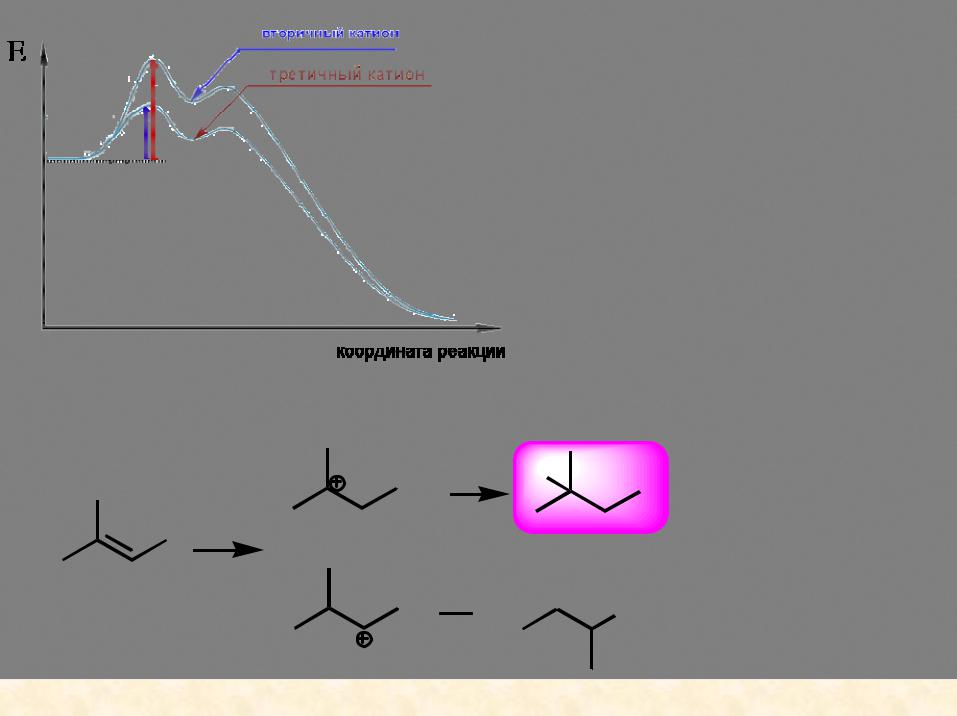
21
Правило Марковникова!
более устойчивый катион  образуется быстрее!
образуется быстрее!
X- |
X |
основной продукт |
|
|
реакции |
HX или
X-
 X
X
22
Первая стадия – присоединение протона, является лимитирующей, поэтому реакционная способность изменяется в следующем ряду:
HBr > HCl > HF
HI к алкенам не присоединяется вследствие обратимости реакции (равновесие смещено в сторону исходных соединений)
|
CH3 |
|
|
Cl |
|
|
H |
Cl |
CH3 HCl |
|
|
Сl- |
CH3 |
|
Cl |
|
Cl |
HCl |
CH3 |
H |
|
||
|
Cl |
|
H |
H |
|
CH3 |
более устойчивый |
|
катион |
|
|
Cl |
|
|
Более замещенная кратная связь (большее число донорных алкильных заместителей) более реакционноспособна по отношению к электрофилу, поскольку, к тому же, образует более устойчивый (более замещенный) катион.
< |
|
|
|
< |
|
|
|
|
< |
|
|
< |
|
|
|
< |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
||||||||||||||
|
|
|
|
|
вторичный |
третичный |
|
|
|
|
||||||
|
|
|
|
|
катион |
|
катион |
|
|
|
|
|||||
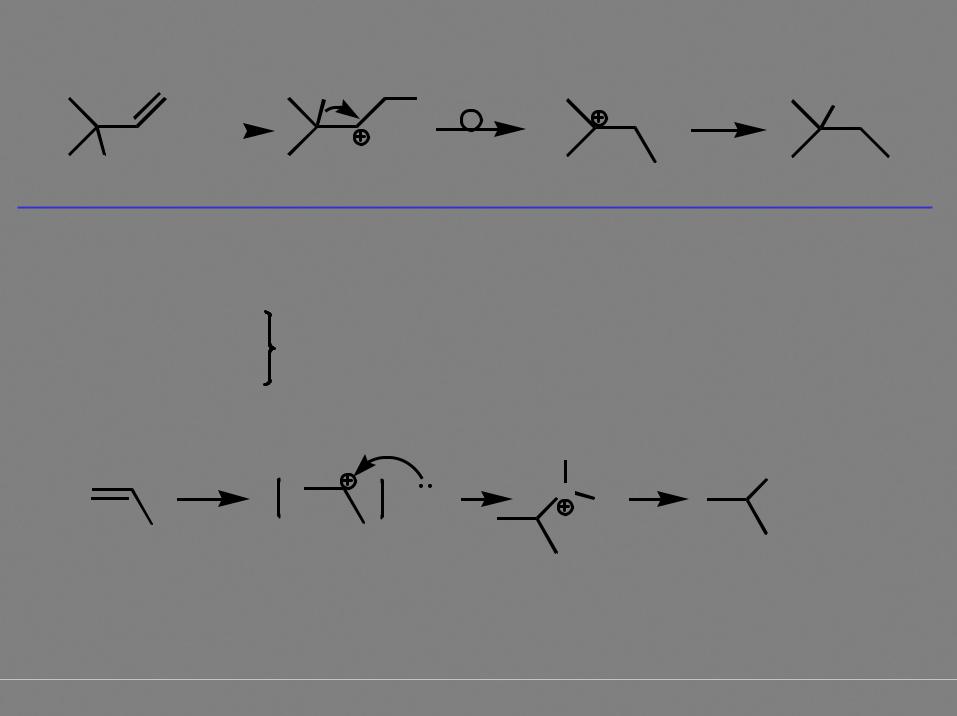
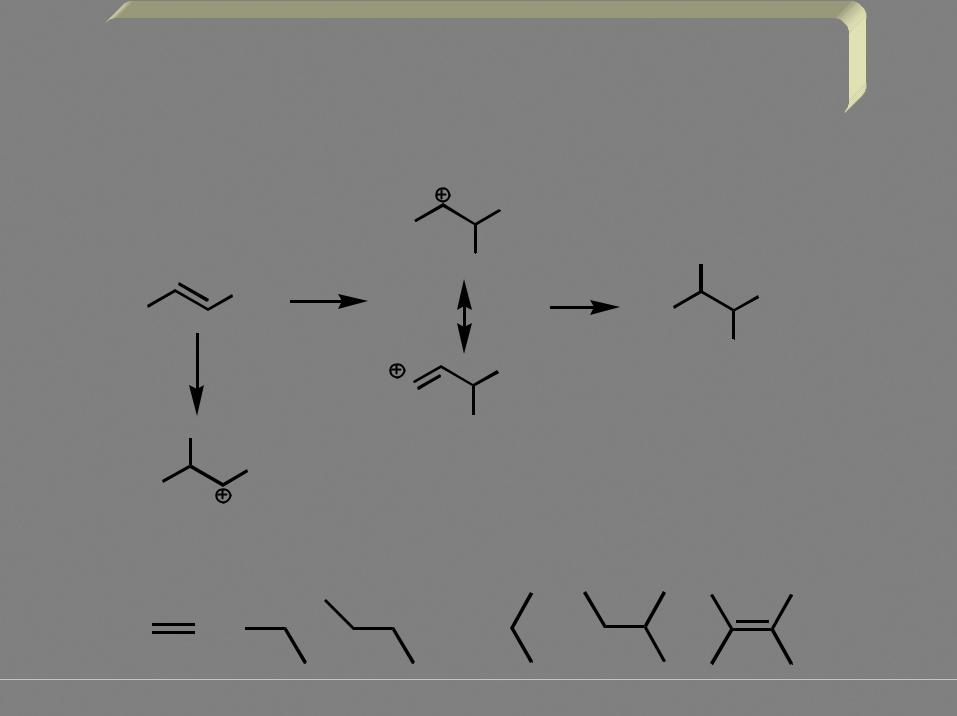
23
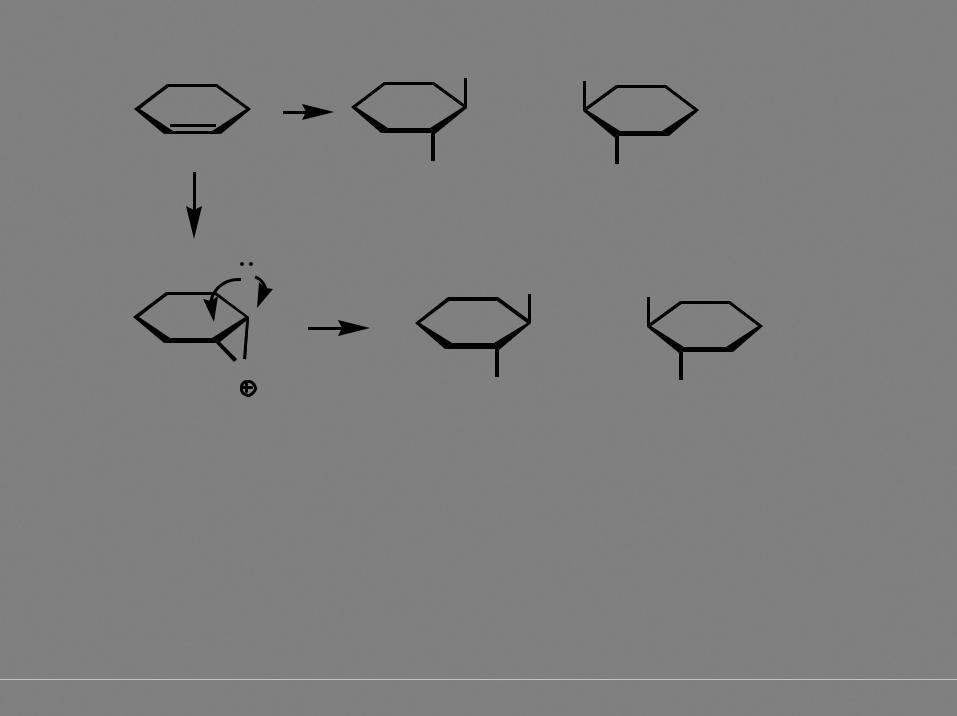
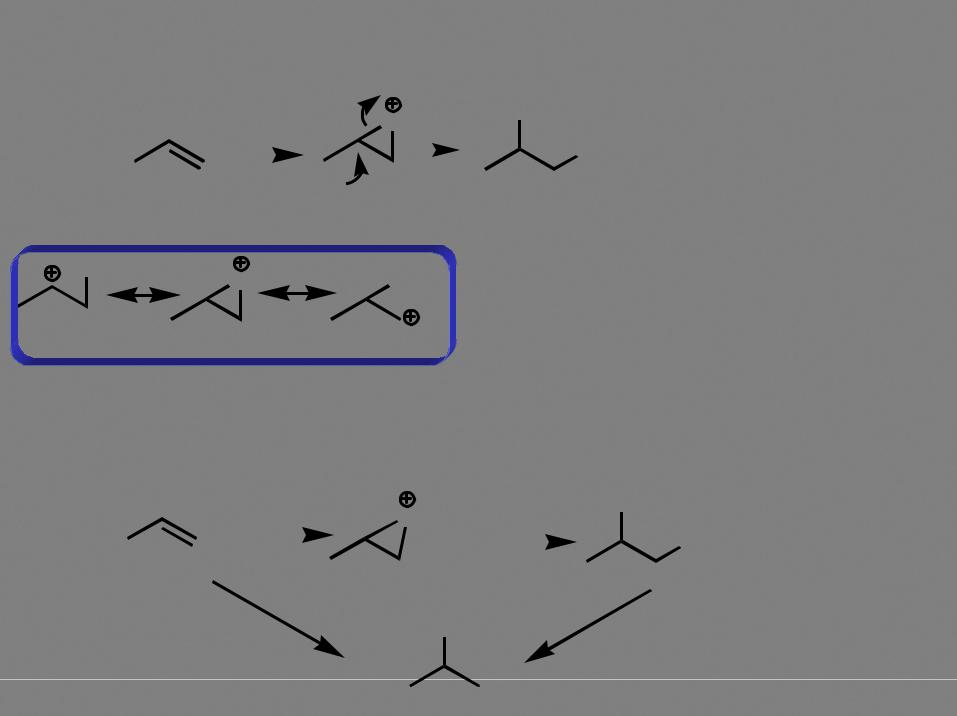
Образование карбокатиона означает возможность протекания перегруппировок!
H |
H |
Br |
HBr |
|
Br- |
H |
гидридный |
|
|
сдвиг |
|
Вода, спирты
вода |
δ+ δ- |
|
|
|
|
H OH |
с алкенами не реагируют (нет свободных протонов) |
||||
|
ROδ-Hδ+ |
||||
спирты |
Реакция происходит в присутствии сильных кислот, |
||||
|
|
например, серной |
|
|
|
|
ROH |
|
R |
|
OR |
|
ROH |
O H |
|
||
|
H+ |
- H |
+ |
||
|
|
|
|||
|
|
|
|
|
|
R = Н, алкил
Н+ - катализатор (не расходуется!)

Серная кислота |
|
|
|
|
|
|
24 |
||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
H2SO4 |
|
|
|
|
|
|
HSO4- |
|
OSO3H |
||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислый
алкилсульфат
Галогены (Cl2, Br2)
Фторирование алкенов только с разрывом связей С-С (образование CF4), реакция с иодом не происходит.
Br2
H |
H Br2 H |
H |
π-комплекс
H |
B |
H |
H |
Br |
H |
r |
|
бромониевый
катион
Br |
|
|
|
Br |
|
Br |
|
|
H |
H |
|
|
|
||
|
-Br- |
|
|
поляризация |
бромониевый |
||
связи Br-Br |
|
катион |
|
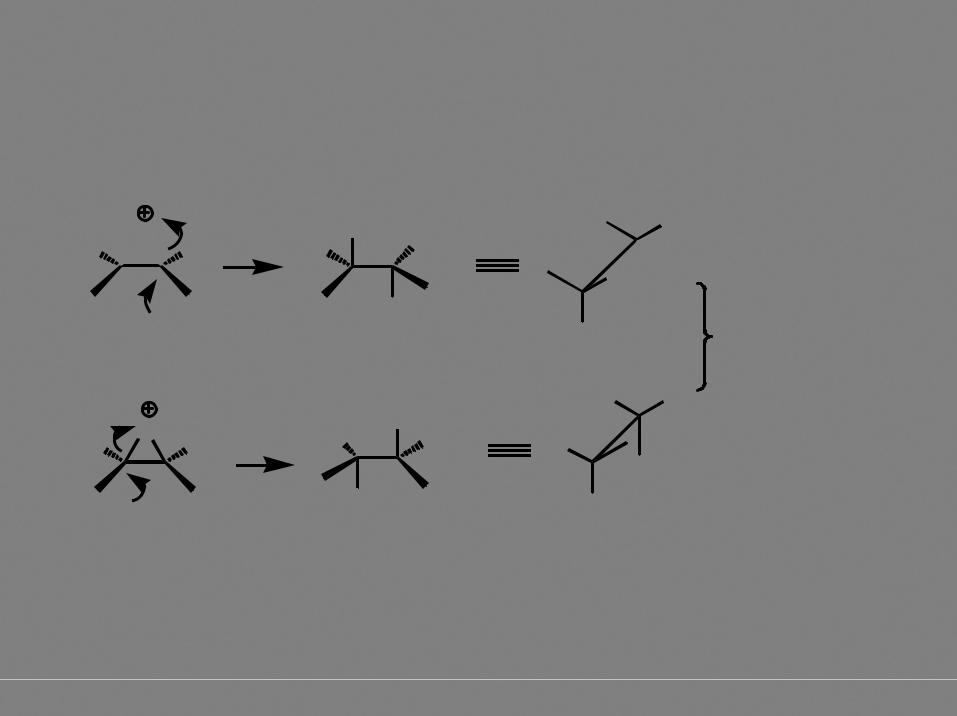
Br большой размер атома брома H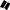

 H позволяет ему эффективно
H позволяет ему эффективно
координироваться с обоими атомами углерода
25
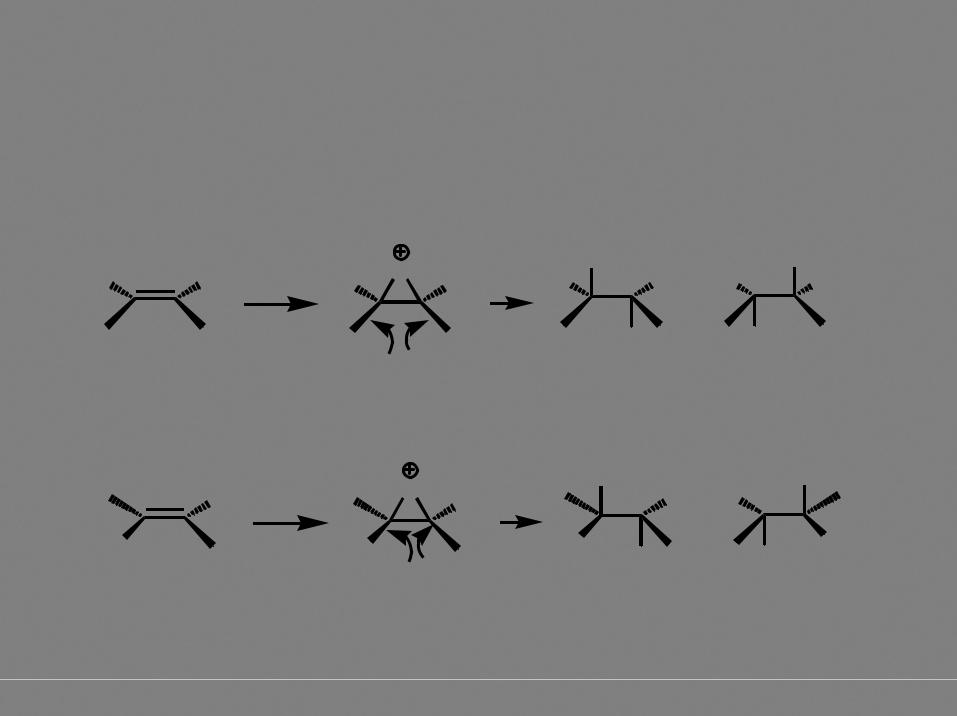
Стереоспецифическое электрофильное транс-присоединение брома к алкену (цис-бутену-2)
Br
H


 H
H
Br-
Br
H
 H
H
Br-
нуклеофильная атака равновероятна по двум направлениям
H Br H
Br
H Br H
Br H
Br
Br H
H 
Br
H Br
H
Br
d,l-форма
энантиомеры, образуются в равных количествах (рацемат)
Br2 |
Br |
H |
|
||
|
H |
|
|
Br- |
|
Br
 H
H
H
Br-
нуклеофильная атака равновероятна по двум направлениям
Br H
H Br
Br
 H
H
H
Br
26
Br
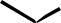
 H H
H H
Br
H
H Br
Br
Br
мезоформа
27
|
|
Br |
Br |
|
|
|
Br2 |
|
|
|
|
+ |
|
|
Br2 |
H2O |
Br |
Br |
|
d,l-форма (рацемат) |
||||
|
|
|||
|
H2O |
|
|
|
|
|
OH |
OH |
|
|
|
- H+ |
+ |
|
|
Br |
|
||
|
Br |
Br |
||
|
|
|||
d,l-форма (рацемат), трео-форма
Аналогично происходит реакция с хлором. С иодом алкены не реагируют, реакция с фтором происходит со взрывом, продукт электрофильного присоединения выделить невозможно
28
в. Другие электрофилы типа А+Б-
+ |
- |
δ- δ+ |
+ |
δ- |
δ |
+ |
- |
Hg(OCOCH ) |
δ |
δ |
δ |
|
|
δ |
|||
NO Cl |
|
HO Br |
Br CN |
I N3 |
3 2 |
|||
H |
H |
+ |
- |
A |
H |
AδBδ |
H |
|
|||
|
|
-B- |
|
|
|
|
|
|
|
B- |
|
H |
+ |
- |
A |
H |
AδBδ |
|
|
||
H |
-B- |
|
H |
|
|
|
|
B- |
|
A A
H
 H H
H H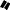
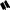 H
H
+
B B
рацемат (трео-форма)
|
A |
H |
A |
|
|
H |
|
||
H |
|
+ |
H |
|
B |
B |
|||
|
|
рацемат (эритро-форма)
29
В случае несимметричных алкенов присоединение происходит по правилу Марковникова
+ |
|
|
- |
A |
|
B |
||
δ |
δ |
|
|
|
|
|||
A B |
|
|
|
|
|
A |
||
|
|
|
|
|
|
|
|
|
-B- |
|
|
|
|||||
|
B- |
|
|
|
||||
|
|
|
|
|
|
|
||
A |
A |
A |
Структура 1 более значима,чем 2 - |
|
|
|
положительный заряд на вторичном атоме |
1 |
|
|
углерода. Поэтому присоединение |
|
2 |
нуклеофила идет по этому положению. |
|
|
|
|
Ацетоксимеркурирование
CH3CO2H = AcOH |
|
|
|
|
|
|
|
||
|
Hg(OAc)2 |
HgOAc |
AcOH |
OAc |
|
||||
|
|
|
HgOAc |
||||||
|
AcOH |
|
|
|
|
|
|
|
|
|
|
|
- H+ |
|
|
||||
|
|
|
|
|
|
||||
|
H3O+ |
OH |
1.NaBH4 |
|
|||||
|
|
|
|
|
2. HO- |
|
|||
|
|
|
|
|
|
|
|
||

30
|
OCH3 |
|
NaBH4 |
OCH |
|||
Hg(OAc)2 |
|
HgOAc |
|
3 |
|||
|
|
|
|
|
|
|
|
CH3OH |
|
|
|
|
|||
|
|
|
|
|
|||
CH3OH
H+
Преимущества ацетоксимеркурирования по сравнению с кислотно-катализирумым  присоединением воды (спиртов) – реакция происходит по тому же направлению, но без образования карбокатионов, способных, в частности, перегруппировываться, и вступать в другие реакции. Реакция происходит стереоселективно.
присоединением воды (спиртов) – реакция происходит по тому же направлению, но без образования карбокатионов, способных, в частности, перегруппировываться, и вступать в другие реакции. Реакция происходит стереоселективно.
|
|
H O+ |
|
1. Hg(OAc) , AcOH |
|
|
|
|
|
3 |
|
|
2 |
|
|
OH |
|
2. NaBH4 |
|
OH |
|||
|
3. HO-, H O |
|
|||||
|
|
|
|
2 |
|
|
|
