
kvant_mech
.pdf
электронов Точное решение этого уравнения невозможно и мы при-
бегнем к теории возмущений. Выберем в качестве исходного состояния такое, при котором ядро а находится на большом расстоянии от ядра b. Тогда вблизи ядра а или b возмущением будет являться:
|
ˆ |
|
2 |
|
1 |
|
|
1 |
|
|
1 |
|
|
1 |
|
|
||||
|
H1 |
= e |
|
|
|
|
|
|
+ |
|
|
|
− |
|
|
− |
|
|
|
|
|
|
|
|
R |
r12 |
ra2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
rb1 |
||||||||
или: |
ˆ |
= e |
2 |
|
|
1 |
|
|
|
1 |
|
|
|
1 |
|
|
1 |
|
. |
|
|
H2 |
|
|
|
R |
+ |
|
r12 |
|
− |
|
ra1 |
− |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rb2 |
||||||
Волноваяфункциянулевогоприближениябудетиметьвидлибо
ψ1 =ψ0(ra1)ψ0(rb2), либо ψ2 =ψ0(ra2)ψ0(rb1), где ψ0(r) –
волновая функция электрона в основном состоянии атома во-
|
|
|
2 |
|
− |
r |
|
r1 = |
2 |
me |
2 |
|
дорода: ψ |
|
(r) = |
e |
r |
, |
– радиус первой бо- |
||||||
0 |
|
1 |
|
|
||||||||
r3/2 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
ровской орбиты. Энергия в этом приближении равняется двум энергиям основного состояния E0 = 2E1 = −me4 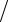 2 .
2 .
Следует, однако, учесть требование антисимметрии волновой функции. Как мы видели, существует три симметричных волновых функции, соответствующих S=1 (триплетные состояния) и одна антисимметричная (синглетное состояние). Если пренебречь спин-орбитальной связью (атом легкий), то волновая функция есть произведение спиновой на координатную.
Для электронов, как и для любых фермионов, полная волновая функция должна быть антисимметричной. Поэтому синглетному состоянию соответствует симметричная волновая
181

функция координат, составленная из ψ1 и ψ2:
ψ+ = A+ (ψ1 +ψ2) = A+[ψ0(ra1)ψ0(rb2)+ψ0(ra2)ψ0(rb1)],
атриплетному состоянию – антисимметричная:
ψ− = A− (ψ1 −ψ2) = A−[ψ0(ra1)ψ0(rb2)−ψ0(ra2)ψ0(rb1)].
Коэффициенты А могут быть найдены из условия норми-
ровки:
∫∫ψ± 2dV1dV2 =1.
Подставляя функции ψ , имеем:
∫∫ψ± 2dV1dV2 = A±2[∫∫ψ02 (ra1)ψ02 (rb2)dV1dV2 ±
±∫∫ψ02 (ra2)ψ02 (rb1)dV1dV2 ±
±2∫∫ψ0(ra1)ψ0(rb2)ψ0(ra2)ψ0(rb1)dV1dV2]=1.
Первые два интеграла равны единице, поскольку ψ0(r) нормированы и ∫ψ02 (ra1)dV1 =1, следует лишь при вычислении выбирать начало координат в ядре так, что dV1 = 4πra21dra1 и т.д. Обозначая положительный третий интеграл через G, полу-
чаем: A±2 = 2(11±G). Интеграл называют интегралом перекры-
тия.
Действительно,например,сомножитель ∫ψ0(ra1)ψ0(rb1)dV1 тем больше, чем меньше расстояние между ядрами R, т.к. при этом сильнее перекрываются функции ψ0(ra1) и ψ0(rb1). При R=0, G=1, при этом А-= , что указывает на полную непри-
182
годность теории возмущений при R 0. Наоборот, при R , G 0 Нам нужно вычислить поправки к энергии E±(1) . Обычная форма теории возмущений здесь нас не спасает, поскольку функции нулевого приближения
ψ+ = A+ (ψ1 +ψ2) и ψ− = A− (ψ1 −ψ2) не ортогональны друг другу, интеграл перекрытия G как раз и является мерой их
неортогональности. Только при R , когда G 0 эти функции становятся ортогональными. Поэтому ограничимся здесь нестрогим рассуждением, обладающим некоторой долей наглядности и приводящим к правильным результатам.
Будем вычислять поправки первого порядка к энергии как среднее значение энергии в состояниях ψ+ и ψ− :
E±(1) = A±2 ∫∫[ψ0(ra1)ψ0(rb2)±ψ0(ra2)ψ0(rb1)]2 H (1)dV1dV2 .
Мы переставили волновые функции, т.к. возмущение представляет собой оператор умножения на функцию координат. Что считать возмущением? Квадрат первого члена под интегралом [ψ0(ra1)ψ0(rb2)]2 соответствует состоянию, в котором первый электрон связан с атомом «а», а второй с атомом «b”. В этом случае возмущением будем считать взаимодействие между ядрами, электронами, между первым электроном и атомом “b” и между вторым электроном и атомом “а»:
ˆ |
= e |
2 |
|
1 |
+ |
1 |
− |
1 |
− |
1 |
. |
H1 |
|
|
R |
r12 |
ra2 |
|
|
||||
|
|
|
|
|
|
|
rb1 |
||||
Квадрат второго члена «соответствует» исходному состоянию, в котором первый электрон связан с атомом «b», а второй – с
183
атомом «а». Поэтому возмущением будет:
ˆ |
= e |
2 |
|
1 |
+ |
1 |
− |
1 |
− |
1 |
. |
|
H2 |
|
|
R |
r12 |
ra1 |
|
|
|
||||
|
|
|
|
|
|
|
rb2 |
|
||||
Легко видеть, |
что |
|
|
интегралы |
|
от |
произведений |
|||||
H1[ψ0(ra1)ψ0(rb2)]2 и H2[ψ0(ra2)ψ0(rb1)]2 |
одинаковы, т.к. |
|||||||||||
от преобразования r1 r2 они переходят друг в друга. Наконец, интеграл, содержащий произведение
ψ0(ra1)ψ0(rb2)ψ0(ra2)ψ0(rb1), не зависит от того взято в качестве возмущения Н1 или Н2, т.к. в результате такого же переобозначения получается одно и то же выражение. Подставляя
интегралы в формулу для среднего значения энергии возмущения получим:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) |
|
|
C ± A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E± |
= |
|
|
, |
|
|||
где величина |
|
|
|
|
|
|
|
1±G |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
2 |
|
|
1 |
1 |
|
1 |
1 |
|
2 |
2 |
|||||||||||
|
C = e |
|
|
∫∫ |
|
|
|
+ |
|
|
|
− |
|
|
− |
|
ψ0 |
(ra1)ψ0 (rb2)dV1dV2 |
|||||||
|
|
|
|
R |
r |
|
r |
|
r |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
12 |
|
|
a2 |
|
|
b1 |
|
|
|
||||||
называется кулоновским интегралом, а величина |
|||||||||||||||||||||||||
|
2 |
|
1 |
|
|
1 |
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|||||
A = e |
|
∫∫ |
|
+ |
|
|
− |
|
|
− |
|
ψ0(ra1)ψ0(rb2)ψ0(ra2)ψ0(rb1)dV1dV2 |
|||||||||||||
|
R |
|
r |
|
r |
r |
|||||||||||||||||||
|
|
|
|
|
|
12 |
|
|
|
a2 |
|
|
b1 |
|
|
|
|
|
|
|
|||||
– обменным интегралом.
Кулоновский интеграл допускает простую, хотя и совершенно нестрогую «интерпретацию». Если рассматривать ρa (1)= eψ02 (ra1) и ρb (2)=eψ02 (rb2) как средние плотности
184

электрона«1»вокрестностиядра«а»иэлектрона«2»вокрестностиядра«b»,тоC представляетсобойсреднююэнергиювзаимодействия ядер атомов (е2/R), электронов друг с другом
(е2/r12) и электронов с «чужими» ядрами –(е2/rа2+е2/rb1). «Интерпретация»обменногоинтегралаАзначительноменее
наглядна. Его структура позволяет ввести «обменные» плотности зарядов:
ρab (1)= eψ0(ra1)ψ0(rb1) и ρab (2)=eψ0(rb2)ψ0(ra2),
которые наглядно, но совершенно нестрого, можно описывать, как результат «частичного пребывания» электронов в полях ядра «а» и «b». Различные слагаемые А интерпретируются как энергии взаимодействия «обменного заряда» с самим собой и с ядрами «а» и «b» и ядер «а» и «b»друг с другом.
Следует, однако, еще раз подчеркнуть, что все эти “интерпретации” кулоновского (С) и обменного (А) интегралов абсолютно нестроги! Фактически физический смысл поправки к
энергии имеет только величина E±(1) = C1±±GA.
С точки зрения квантовой механики вообще не имеют смысла индивидуальные состояния каждого из двух электронов, и слова«1-йэлектронвблизиядра«а»(или«b»)»неимеютфизи- ческого смысла – существует только общее электронное облако молекулы. Только при больших, по сравнению с боровским радиусом, расстояниях между ядрами обретают смысл индивидуальные “облака” 1-го и 2-го электронов.
В интегралы (С), (А) и (G) входит в качестве параметра расстояние между ядрами R, поэтому E±(1) является функцией R и играет роль потенциальной энергии взаимодействия атомов.
185
Сила этого взаимодействия
F = −∂E±(1) .
∂R
Величины (С), (А) и (G) могут быть вычислены точно, однако, и вычисления и окончательные выражения для этих величин весьма громоздки, и мы ограничимся приведением здесь гра-
фиков зависимости E±(1) от R. Кривая E−(1) монотонно падает,
поэтому при любых R между атомами с параллельными спинами действуют силы отталкивания. Это значит, образование молекулы Н2 с S=1 невозможно.
Для E+(1) криваяимеетминимумпри R=R0=1,6r1,вэтойточкесилыотталкиванияипритяженияуравновешиваются,возникаетпотенциальнаяяма,и,следовательно,образуетсямолекула
Н2 с S=0 и энергией диссоциации Едисс= E+(1) (R0)=3,2 эВ. Расчеты по этой модели дают не очень хорошее совпадение с экс-
периментом (R0=1,4r1; Едисс=4,5 эВ). Существуют более точные методы, приводящие к лучшему согласию с опытом, но эти
методы значительно более громоздки и менее наглядны, чем приведенный метод Гайтлера-Лондона.
Тотфакт,чтоН2 имеет S=0подтверждаетсяэкспериментальными данными и, в частности тем, что эта молекула не обладает магнитным моментом, молекулярный водород диамагнитен. Можно понять это и «на пальцах». Согласно принципу Паули электроны с одинаковым спином не могут находиться в одной и той же точке пространства, между ними возникает своеобразное Пауливское отталкивание, При разных спинах принцип Паулине«запрещает»имприближатьсядругкдругускольугодно
186

«близко», нужно только принимать во внимание еще и Кулоновское отталкивание.
Еще раз отметим, что названия «обменный» интеграл, «обменное» облако обменная плотность не имеют никакого реального физического смысла. никакого обмена электронами не происходит (электроны неразличимы!). Расщепление поправки
к энергии на две части E±(1) = C1±±GA возникает вследствие не-
различимости частиц и вытекающего из него требования симметрии или антисимметрии волновых функций. Такое приближенное разделение не является специфическим свойством кулоновского взаимодействия 0, а относится к любым взаимодействиям. В частности оно приводит к возможности объяснения многих других явлений, необъяснимых в рамках классической физики (ферромагнетизм, антиферромагнетизм, ряд свойств взаимодействий нуклонов в ядрах и т.п.).
187

Химическая связь
ЛЕКЦИЯ 26
§66 Валентность
Отметим,чтообъяснениесвязимеждунейтральнымиатомами может быть только квантово-механическим. Дело в том, что силы взаимодействия, между нейтральными частицами известные в физике это гравитационные, силы взаимодействия магнитных моментов и мультипольных электрических моментов. Силы эти ничтожно малы по сравнению с кулоновскими и не могут дать объяснения важнейшего свойства химических взаимодействий – «насыщения».
Опыт показывает, что молекула Н2 отталкивает третий атом водорода и молекулы Н3 не возникает. Аналогично СН4 отталкивает Ни СН5 несуществуетвприроде.Вхимииэтосвойство описывается валентностью – числом, показывающим, сколько атомов (например, водорода) рассматриваемый атом может связать с собой. В противоположность этому в классической физике любая частица может притягивать к себе любое число других частиц.
Квантовая механика дает простое объяснение: связываться между собой могут только атомы у которых спины «антипараллельны», и полный спин S=0.Отсюда следует, что приближающийся к Н2 атом Н должен отталкиваться, поскольку его спин будет «параллелен» одному из электронов, входящих в моле-
188
кулу. Таким образом валентность атома определяется числом электронов с нескомпенсированными спинами и равна 2S (во внешней части его оболочки), при этом электронный спин молекулы компенсации спинов электронов, входящих в атомы, в невозбужденном основном состоянии молекулы как правило становится равным нулю. Атомы могут вступать в связь и из возбужденного состояния. Дело в том, что при образовании молекулы из двух или большего числа атомов потенциальная энергия уменьшается, и, если это уменьшение больше, чем затраты энергии при переходе в возбужденное состояние, может происходить образование молекул и из возбужденного состояния атомов. При этом атом обладает иным спином S и иной валентностью, чем в нормальном состоянии.
I. Все элементы первой группы имеют один s-электрон во внешней оболочке, S=1/2 и валентность V=1.
II. Элементы второй группы имеют 2 s-электрона, S=0 и валентность должна была бы быть нулевой, однако один из s-электронов переходит легко в р-состояние и поэтому конфигурация становится ns1p1, S=1, V=2.
III. Электроны третьей группы в основном состоянии имеют конфигурацию ns2p и, соответственно, S=1/2. Однако энергия перехода в nsp2 со спином S=3/2 не велика (особенно у легких элементом этой группы) и поэтому бериллий и алюминий имеют V=3 и только в более тяжелых элементах она конкурирует с V=1.
IV-я группа – в нее входит углерод, являющийся основой всегоживого,представляетособыйинтерес.Восновномсостоянии конфигурация ns2p2, которой соответствует S=1 и V=2, однако близко к нему находится возбужденное состояние nsp3 со спином S=2 и поэтому V=4. Самые легкие элементы этой
189
группы углерод и кремний, как правило, проявляют валентность 4 (исключение СО).
V. Для V группы основное состояние ns2p3 соответствует S=3/2 и (NH3), валентность V=5 (HNO3) проявляется при вступлении в связь их близлежащего состояния ns1p3(n+1)s1.
VI. Сходные рассуждения приводят к выводу, что элементы VI группы в основном состоянии ns2p4 (S=1), однако недалеко от основного состояния лежат ns2p3(n+1)s1 и ns1p3(n+1)s1p1 с четырьмя (S=2) и шестью (S=3) неспаренными спинами могут иметь валентность 2, 4 и 6. Самый легкий из элементов этой группы кислород проявляет только валентность V=2, а уже сера имеет и более высокие V=4 (SО2) и V=6 (SО3).
VII. Аналогично, элементы седьмой группы одновалентны в основном состоянии (ns2p5, S=½) и 3, 5, и 7 валентны (кроме фтора) в возбужденных ns2p4(n+1)s1 (S=3/2), ns2p3 n+1)s1p1
(S=5/2) и ns1p3(n+1)s1p2 (S=7/2).
VIII. Элементы восьмой группы имеют конфигурацию ns2p6 (S=0) и довольно далеко отстоящие возбужденные состояния. Поэтому для них характерна химическая инертность, соединения их крайне редки (только ксенон и криптон, и то в присутствии фтора) и неустойчивы.
Элементы промежуточных групп обладают во многом похожими свойствами, т.к. d и f-электроны, появляющиеся в этих группах “лежат глубоко” и мало влияют на химические свойства, и лишь конкуренция с s-электронами в некоторых (редких) из этих элементов может изменить валентность.
Присоединенииатомоввмолекулыраспределениезарядаво внешних частях электронных оболочек может довольно сильно изменяться.
Элементы первых групп являются электроположительны-
190
