
- •1)Основные классы неорганических соединений. Номенклатура. Диссоциация. Степень окисления и валентность. Графические формулы.
- •3) Строение атома. Элементарные частицы и ядро. Квантово-механическое объяснение строения атома.
- •6) Химическая связь. Типы и характеристики химических связей.
- •7) Метод валентных связей. Основные положения метода. Свойства ковалентной связи в рамках метода вс.
- •8) Сигма и пи связи. Особенности перекрытия электронных облаков при этих видах связи. Гибридизация атомных орбиталей, типы гибридизации.
- •9) Межмолекулярное взаимодействие и как разновидность его – водородная связь. Примеры.
- •11) Химическая кинетика. Скорость химической реакции и влияющие на нее факторы. Закон действующих масс. Константа химического равновесия. Принцип Ле Шателье.
- •13) Растворы. Способы выражения концентрации растворов.
- •14) Растворы неэлектролитов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •15) Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень и константа диссоциации. Диссоциация слабых и сильных электролитов.
- •16) Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей. Различные случаи гидролиза солей. Степень и константа гидролиза.
- •17) Произведение растворимости. Пр для двух-, трех-, четырех-, пяти-ионных электролитов.
- •18) Коллоидные растворы. Классификация.
- •19) Гидрофобные и гидрофильные коллоиды. Строение мицеллы гидрофобного коллоида. Правила избирательной адсорбции Фаянса-Пескова.
- •20) Коагуляция золей. Правила коагуляции Шуляце-Гарди. Способы получения золей. Значение коллоидных растворов. Оптические явления в коллоидах.
13) Растворы. Способы выражения концентрации растворов.
Растворы – это однородные гомогенные системы состоящие из растворителя и растворенного вещества и продуктов их взаимодействия.
Моляльная концентрация – число моль растворенного вещества приходящегося на100гр. растворителя.
Молярная концентрация – показывает число моль растворенного вещества в 1 литре раствора.
Процентная концентрация – показывает число грамм растворенного вещества в 100гр. раствора.
Эквивалентная – число эквивалентов растворенного вещества в 1 литре раствора.
Титр – число грамм вещества в 1мл. раствора.
Молярная доля – это отношение числа моль растворенного вещества к сумме моль вещества и растворителя.
14) Растворы неэлектролитов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
Неэлектролиты − это вещества, которые в растворе не распадаются на ионы и их растворы не проводят электрический ток.
Осмос - Явление односторонней диффузии молекул растворителя в раствор через полупроницаемую перегородку называют
Осмотическое давление - это то давление, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Изучение осмотического давления разбавленных растворов показало, что оно не зависит от природы компонентов раствора и возрастает пропорционально молярной концентрации растворенных веществ (СМ) и абсолютной температуре раствора – закон Вант – Гоффа.
15) Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень и константа диссоциации. Диссоциация слабых и сильных электролитов.
Электролиты – это вещества, растворы которых проводят электрический ток.
Теория электролитической диссоциации Аррениуса.
В основе этой теории лежит представление о том, что при растворении электролитов происходит диссоциация (распад) их молекул на электрически заряженные частицы – ионы (катионы и анионы).
Количественно процесс диссоциации характеризуется степенью диссоциации () и константой диссоциации Кд. равна отношению числа продиссоциировавших молекул к общему числу молекул электролита.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1).
16) Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей. Различные случаи гидролиза солей. Степень и константа гидролиза.
Ионное произведение воды. Водородный и гидроксильный показатели
Вода является очень слабым амфотерным электролитом. Электролитическая диссоциация её выражается уравнением:
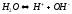
Константа диссоциации воды составляет
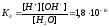
Так как вода диссоциирует в крайне малой степени, то можно считать, что [H2O] – величина постоянная, она равна

Тогда Кд·[H2O]=[H+]·[OH-]=1,8·10-16·55,56=1·10-14=KW
Величина KW=[H+]·[OH-] называется ионным произведением воды и является постоянной не только для чистой воды, но и для разбавленных водных растворов любых веществ. С повышением температуры KW увеличивается, с понижением – уменьшается. Однако для комнатной температуры можно во всех случаях принимать KW=10-14.
Если [H+]>10-7 моль/л, то [OH-] будет меньше этой величины и раствор станет кислым. Наоборот, щелочной раствор соответствует [OH-]>10-7 моль/л при [H+] меньше этой величины.
В кислой среде водородный показатель pH<7 (6, 5, 4 и т.д.), а гидроксильный pOH>7. В нейтральной среде рН=рОН=7, в щелочной среде рН>7 (8, 9, 10 и т.д.), а рОН<7.
