
- •1)Основные классы неорганических соединений. Номенклатура. Диссоциация. Степень окисления и валентность. Графические формулы.
- •3) Строение атома. Элементарные частицы и ядро. Квантово-механическое объяснение строения атома.
- •6) Химическая связь. Типы и характеристики химических связей.
- •7) Метод валентных связей. Основные положения метода. Свойства ковалентной связи в рамках метода вс.
- •8) Сигма и пи связи. Особенности перекрытия электронных облаков при этих видах связи. Гибридизация атомных орбиталей, типы гибридизации.
- •9) Межмолекулярное взаимодействие и как разновидность его – водородная связь. Примеры.
- •11) Химическая кинетика. Скорость химической реакции и влияющие на нее факторы. Закон действующих масс. Константа химического равновесия. Принцип Ле Шателье.
- •13) Растворы. Способы выражения концентрации растворов.
- •14) Растворы неэлектролитов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •15) Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень и константа диссоциации. Диссоциация слабых и сильных электролитов.
- •16) Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей. Различные случаи гидролиза солей. Степень и константа гидролиза.
- •17) Произведение растворимости. Пр для двух-, трех-, четырех-, пяти-ионных электролитов.
- •18) Коллоидные растворы. Классификация.
- •19) Гидрофобные и гидрофильные коллоиды. Строение мицеллы гидрофобного коллоида. Правила избирательной адсорбции Фаянса-Пескова.
- •20) Коагуляция золей. Правила коагуляции Шуляце-Гарди. Способы получения золей. Значение коллоидных растворов. Оптические явления в коллоидах.
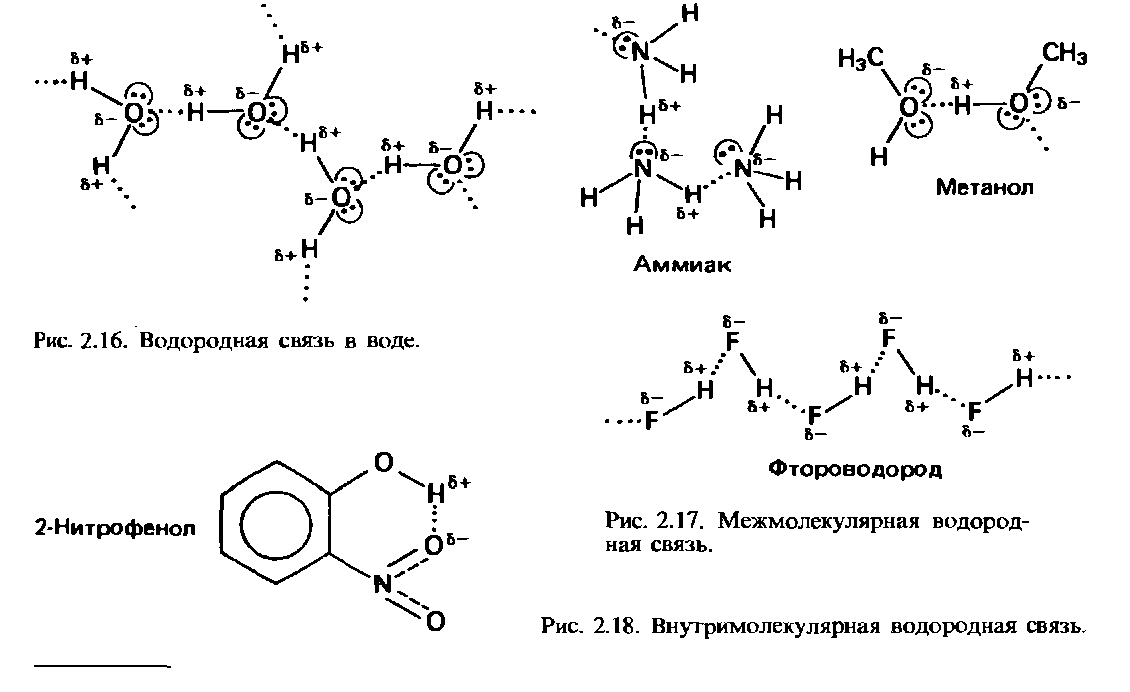
9) Межмолекулярное взаимодействие и как разновидность его – водородная связь. Примеры.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ - это взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей.
Водородная связь - форма ассоциации между электроотрицательныматомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
10) Простые вещества. Химические свойства их соединений в свете теории атома. Понятия о кислотных, основных и амфотерных, оксидах, кислотах и основаниях. Изменение кислотно-основных свойств этих соединений по периодам и группам.
Простые вещества — вещества, состоящие исключительно из атомов одногохимического элемента.
У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Основные оксиды – образованны основным металлом и кислородом.
Кислотные оксиды – образованны не металлом или амфотерным металлом с наибольшей степенью окисления.
Амфотерные оксиды – образованны амфотерными элементами.
Сильные основания – щелочи (это гидрооксиды щелочных и щелочноземельных металлов). Остальные являются слабыми.
Сильные кислоты – дисоциируют практически полностью и относятся к сильным электролитам (НNO3,H2SO4, HSeO4, HMnO4)
Слабые кислоты – диссоциируют в меньшей степени по ступеням и обратима.
