
- •1)Основные классы неорганических соединений. Номенклатура. Диссоциация. Степень окисления и валентность. Графические формулы.
- •3) Строение атома. Элементарные частицы и ядро. Квантово-механическое объяснение строения атома.
- •6) Химическая связь. Типы и характеристики химических связей.
- •7) Метод валентных связей. Основные положения метода. Свойства ковалентной связи в рамках метода вс.
- •8) Сигма и пи связи. Особенности перекрытия электронных облаков при этих видах связи. Гибридизация атомных орбиталей, типы гибридизации.
- •9) Межмолекулярное взаимодействие и как разновидность его – водородная связь. Примеры.
- •11) Химическая кинетика. Скорость химической реакции и влияющие на нее факторы. Закон действующих масс. Константа химического равновесия. Принцип Ле Шателье.
- •13) Растворы. Способы выражения концентрации растворов.
- •14) Растворы неэлектролитов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •15) Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень и константа диссоциации. Диссоциация слабых и сильных электролитов.
- •16) Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей. Различные случаи гидролиза солей. Степень и константа гидролиза.
- •17) Произведение растворимости. Пр для двух-, трех-, четырех-, пяти-ионных электролитов.
- •18) Коллоидные растворы. Классификация.
- •19) Гидрофобные и гидрофильные коллоиды. Строение мицеллы гидрофобного коллоида. Правила избирательной адсорбции Фаянса-Пескова.
- •20) Коагуляция золей. Правила коагуляции Шуляце-Гарди. Способы получения золей. Значение коллоидных растворов. Оптические явления в коллоидах.
6) Химическая связь. Типы и характеристики химических связей.
Химическая связь возникает при взаимодействии атомов, обуславливающем образование устойчивой двух- или многоатомной системы (молекулы, кристалла и др.). Основными типами химической связи являются ковалентная, ионная и металлическая.
Характеристики химической связи.
Энергия связи – это та энергия, которая выделяется при образовании химической связи или затрачивается на ее разрыв, выражается в кДж/моль
Длина связи (межъядерное расстояние) – это расстояние между ядрами атомов в молекуле, выражается в нм. Длины связей обусловлены в основном размерами реагирующих атомов.
Валентные углы – это углы между направлениями химических связей в многоатомных молекулах, т.е. углы между прямыми линиями, соединяющими ядра атомов в молекуле. Валентные углы зависят от пространственной структуры образуемой молекулы.
7) Метод валентных связей. Основные положения метода. Свойства ковалентной связи в рамках метода вс.
Ковалентная химическая связь
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Она являются универсальным типом химической связи. Ковалентная связь возникает как между одинаковыми атомами (например, в молекулах H2, N2, Cl2), так и между разными атомами (например, в молекулах H2O, NH3, CO2).
Метод валентных связей
Согласно этому методу, одинарную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам. При этом происходит перекрывание электронных облаков взаимодействующих атомов с образованием области повышенной электронной плотности в межъядерном пространстве.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
8) Сигма и пи связи. Особенности перекрытия электронных облаков при этих видах связи. Гибридизация атомных орбиталей, типы гибридизации.
По характеру перекрывания электронных облаков различают (сигма)-связи, (пи)-связи.
-Связь осуществляется при перекрывании электронных облаков вдоль линии соединения ядер атомов. В образовании этой связи могут участвовать все атомные орбитали.
-Связи реализуются за счет перекрывания электронных облаков p- и d-типов с образованием двух областей перекрывания, расположенных по разные стороны от линии соединения ядер атомов.
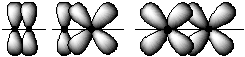
Гибридизация атомных орбиталей
Если у атома, вступающего в химическую связь, имеются разные АО (s-, p-, d- или f- АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО.
При смешивании одной s- и одной p-орбитали реализуется sp-гибридизация. Например, в молекуле гидрида бериллия BeH2 атом бериллия Be 1s22s2 находится в возбужденном двухвалентном состоянии:
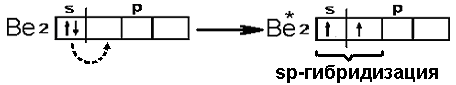
а неспаренные электроны располагаются на разных (s и p) орбиталях:
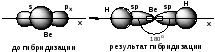
Рис.1.10 Схема sp- гибридизации
Таким образом, sp-гибридизация приводит к образованию двух равноценных электронных облаков, расположенных под углом 180 друг к другу, следствием чего является линейная форма молекулы гидрида бериллия
![]()
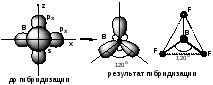
Смешивание одной s- и двух p-орбиталей приводит к sp2-гибридизации электронных облаков. Так, в молекуле трифторида бора атом бора (B 1s22s22p1) находится в возбужденном трехвалентном состоянии
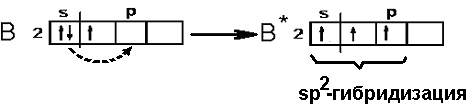
Таким образом, sp2-гибридизация приводит к образованию трех равноценных гибридных электронных облаков, расположенных под углом 120 друг ко другу. Перекрывание этих облаков с одноэлектронными орбиталями фтора 1s22s22p5
![]()
приводит к структуре молекулы BF3 в виде правильного треугольника с углами связей FBF равными 120
При смешивании одной s- и трех p-орбиталей реализуется sp3-гибридизация. Например, в молекуле метана CH4 атом углерода C 1s22s22p2 находится в возбужденном четырехвалентном состоянии
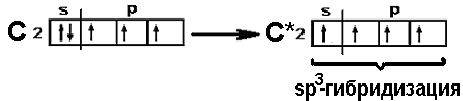
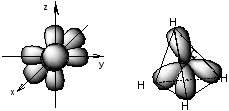
Рис. 1.12 Схема sp3 - гибридизации
При sp3-гибридизации образуются четыре равноценные гибридные орбитали, направленные от центра к вершинам правильного тетраэдра под углом 109,5, что приводит к тетраэдрической структуре молекулы CH4
