
- •Зависимость скорости реакции от рН
- •Виды нуклеиновых кислот
- •Метаболизм белково-пептидных гормонов.
- •Пути экскреции гормонов и их метаболитов.
- •Биосинтез мелатонина.
- •Метаболизм аминокислотных гормонов.
- •Метаболизм тиреоидных гормонов.
- •Метаболизм мелатонина.
- •Пути экскреции гормонов и их метаболитов.
- •Регуляция обмена белков.
- •Этапы синтеза стероидных гормонов.
- •Транспорт гормонов.
- •Специфические транспортные белки плазмы крови.
- •Неспецифические белки.
- •Физиологическая роль связывания гормонов в крови.
- •Периферический метаболизм гормонов.
- •Виды метаболизма:
- •Билет 77. Регуляция обмена белков.
- •Этапы действия стг.
- •Этапы действия инсулина.
- •Половые гормоны.
- •Регуляция водно-солевого обмена.
- •Гормональная регуляция обмена кальция.
- •Функции кальция.
- •Биохимические принципы витаминотерапии
- •Белки плазмы крови.
- •Высаливание.
- •Функции белков плазмы крови.
- •Альбумины.
- •Строение гемоглобина.
- •Функция гемоглобина.
- •Производные гемоглобина.
- •Типы гемоглобинов.
- •Физиологические типы гемоглобина.
- •Аномальные типы гемоглобина
- •Патология обмена гемоглобина.
- •Порфирии.
- •Синтез гема.
- •-Глобулины.
Функции белков плазмы крови.
Белки поддерживающие коллоидно-осмотическое (онкотическое)давление и тем самым постоянный объем крови.
Белки определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке.
Белки участвуют в регуляции кислотно-щелочного равновесия (белковая буферная система).
Белки выполняют транспортную функцию. Они транспортируют углеводы, липиды, гормоны, лекарства.
Белки удерживают в связанном состоянии и транспортируют катионы Са2+,Fe2+,Mg2+, Сu2+, препятствуют их потере с мочой.
Специализированные белки участвуют в свертывании крови (фибриноген, протромбин).
Белки выполняют защитную функцию. Иммуноглобулины участвуют в реакциях гуморального иммунитета.
Белки являются резервом аминокислот.
Альбумины.
На долю альбуминов приходится 55 – 60% белков плазмы крови. Молекулярная масса 70 тыс Да. Содержание альбуминов в крови – 40 – 50 г/л. Период полураспада 7 дней.
Альбумины поддерживают коллоидно-осмотическое давление и регулируют обмен жидкостей между кровью и тканями.
Снижение концентрации альбумина в сыворотке крови ниже 30 г/л сопровождается уменьшением онкотичекого давления крови и возникновением онкотического давления крови и возникновением отеков.
Функции альбуминов: транспорт неэстерифицированных жирных кислот, желчных кислот, желчных пигментов (билирубин), стероидные гормоны, ионы Са2+, многие лекарства – сульфаниламиды, пенициллин, дикумарин, аспирин.
Билет 92
К группе гемопротеидов относятся гемоглобин и его производные, миоглобин и ферменты – цитохромная система, каталаза и пероксидаза.
Все хромопротеиды содержат различные по составу и структуре белки. Небелковый компонент обладает структурным сходством.
Строение гемоглобина.
В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем.
Глобин состоит из
4 субъединиц 2 и 2
и 2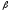 .
Каждая
.
Каждая -цепь
содержит по 141 аминокислотному остатку,
а
-цепь
содержит по 141 аминокислотному остатку,
а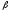 - по 146.
- по 146.
Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем.
Гем представляет собой плоскую молекулу, содержащую 4 пиррольных цикла и соединенный с ними атом железа:
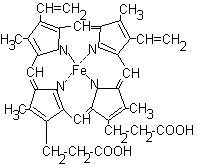
Гем соединяется с белковой частью (глобином) гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. Между атомом железа и имидазольным кольцом одного из остатков гистидина в глобине имеется координационная связь. За счет еще одной координационной связи к атому железа может присоединяться молекула кислорода с образованием оксигемоглобина.
Пиррольные кольца гема расположены в одной плоскости, а атом железа выступает из этой плоскости. Присоединение кислорода «выпрямляет» молекулу гема: железо перемещается в плоскость пиррольных колец и это вызывает изменение конформации белка. В молекуле гемоглобина имеется 4 протомера, каждый из которых содержит гем и может присоединять кислород. Присоединение первой молекулы кислорода изменяет конформацию протомера. Изменение конформации одного протомера изменяет конформацию остальных протомеров. Изменение конформации протомеров облегчает присоединение остальных молекул кислорода. Это явление называется кооперативным действием. Сродство гемоглобина к четвертой молекуле О2примерно в 300 раз больше, чем к первой.
