
Prtakt_fiz_him-och
.pdf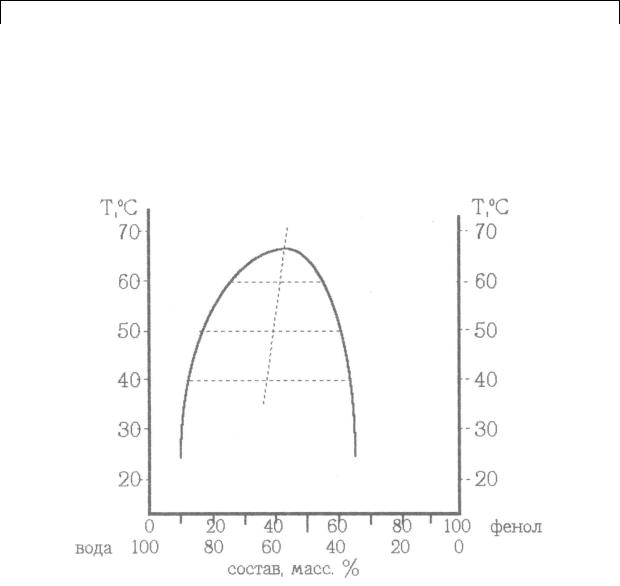
через экспериментальные точки. Указать на ней области существования гомогенных и гетерогенных смесей.
15.Провести конноды, отвечающие температурам 40, 45, 50, 60, 65оС (или другим, указанным преподавателем), как показано на рисунке. Определить составы сопряжѐнных растворов при температурах, указанных преподавателем.
16.Найти и отметить точки, отвечающие среднему арифметическому из составов сопряжѐнных фаз, которые находятся точно в середине каждой конноды. Провести прямую линию, соединяющую середины коннод, и продлить еѐ до пересечения с кривой расслоения. Определить критическую температуру растворения системы. Установить, подчиняется ли данная система правилу Алексеева.
17.Занести расчетные данные в таблицу.
Температура, оС
|
|
% фенола |
% фенола |
% фенола |
Составы сопряжѐнных фаз |
|
% воды |
% воды |
% воды |
Среднее арифметическое из |
|
% фенола |
% фенола |
% фенола |
|
|
|
|
|
состава сопряжѐнных фаз |
|
% воды |
% воды |
% воды |
Критическая температура растворения КТР = |
|
|
|
|
|
|
|
|
|
18. Сформулировать выводы.
61

Работа 2.4. Определение коэффициента распределения третьего компонента между двумя жидкими фазами.
Цель работы: Определение коэффициента распределения третьего компонента между водой и органическим растворителем путем про-
ведения жидкостной экстракции.
Целевые задачи: Проведение жидкостной экстракции третьего ком-
понента из водного раствора органическим растворителем; титри-
метрическое определение концентрации третьего компонента в обеих фазах системы; расчет коэффициента распределения и степени ассоциации вещества в органическом растворителе; оценка экстрак-
ционной эффективности органического растворителя.
Если в систему из двух несмешивающихся жидкостей ввести не-
большое количество третьего компонента, то после установления равнове-
сия он окажется в обеих фазах, но в разном количестве. Для каждой
температуры отношение концентраций третьего компонента в двух равновесных жидких фазах является величиной постоянной, незави-
симо от этих концентраций (закон распределения Нернста):
С1
 = К
= К
С2
где К коэффициент распределения.
Закон распределения является теоретической основой жидкостной экстракции. Экстракцией из растворов называется извлечение и разделе-
ние компонентов раствора путем перевода их из одной жидкой фазы в дру-
гую, содержащую экстрагент. Основными условиями экстракции являются:
а) несмешиваемость экстрагента с исходным раствором,
62

б) отсутствие химического взаимодействия извлекаемого вещества с экст-
рагентом,
в) лучшая растворимость извлекаемого вещества в экстрагенте, чем в пер-
воначальном растворителе.
Фаза, в которую после экстракции переходит извлекаемое вещество,
называется экстрактом, а фаза, обедненная им рафинатом.
Количественной характеристикой эффективности экстракции явля-
ется коэффициент распределения. В данных методических указаниях вы-
брана такая система обозначений: С1 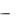 концентрация извлекаемого вещества в рафинате, С2
концентрация извлекаемого вещества в рафинате, С2 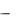 его концентрация в экстракте. При этом чем меньше значение коэффициента распределения, тем эффективнее экстра-
его концентрация в экстракте. При этом чем меньше значение коэффициента распределения, тем эффективнее экстра-
гент и тем больше степень извлечения третьего компонента. Она опреде-
ляется как отношение массы извлекаемого вещества в экстракте к его массе, содержавшейся в исходном растворе до экстракции.
В ряде случаев при переходе третьего компонента через поверхность раздела фаз его средняя молярная масса изменяется вследствие ассоциа-
ции или диссоциации в одном из растворителей. В таких случаях уравне-
ние закона распределения можно представить в виде С1
= К, |
(1) |
С2n
где n - показатель при данной температуре, обусловленный свойствами всех трех компонентов системы, и представляющий собой отношение средних молярных масс третьего компонента в экстрагенте и в исходном растворителе. Например, если уксусная кислота в воде существует глав-
ным образом в виде отдельных молекул, а в бензоле - в виде ассоциатов из двух молекул (димеров), то:
Ммолекулы |
60 |
1 |
n = |
= |
= . |
Массоциата |
120 |
2 |
63

Чаще других используют графический метод определения К. Его принцип заключается в следующем. Уравнение (1) путем логарифмирова-
ния преобразуется в уравнение прямой, не проходящей через начало коор-
динат:
lgC1 = lgK + n lgC2 .
Затем по экспериментальным данным строится график зависимости lgC1 от lgC2, отсекающее от оси ординат отрезок, равный lgK. Тангенс угла наклона этого графика к оси абсцисс равен n. (подробнее об этом см. «Проведение опыта»).
|
Оснащение рабочего места |
|
Пипетка на 1 мл. |
Склянки с пробками на 100 мл. |
|
Колбы для титрования. |
Раствор NаОН 0,1 н. |
|
Цилиндр на 10 мл. |
Бюретка на 25 мл. |
|
Раствор фенолфталеина в спирте. |
||
Растворы экстрагируемого вещества и органические растворители |
||
(по указанию преподавателя). |
|
|
|
|
|
ВНИМАНИЕ! |
Органические растворители отмеривать только под |
|
тягой! После окончания работы категорически запрещается сливать их в канализацию. Для этого имеется специальный сосуд в вытяжном шкафу.
Проведение опыта
1.Проверить оснащение рабочего места.
2.Измерить и записать температуру.
3.В три склянки с притертыми пробками поместить по 10 мл водных рас-
творов экстрагируемого вещества кислотной природы (по указанию преподавателя).
4.Добавить к каждому раствору по 10 мл указанного преподавателем ор-
ганического растворителя (под тягой!).
64

5.Склянки плотно закрыть пробками и после интенсивного встряхивания в течение трех минут оставить для перераспределения не менее чем на 20
минут.
6.Определить титрованием концентрацию экстрагируемого вещества во всех исходных растворах (обозначается С0I, С0II и С0III) для чего отмерить
1 мл исходного раствора экстрагируемого вещества в колбу для титро-
вания, затем добавить 1 каплю раствора фенолфталеина и титровать 0,1
н. раствором NaOH до появления слабо-розового окрашивания, не исче-
зающего в течение 30 - 40 секунд. Повторить титрование трижды для каждого раствора. Рассчитать С0I, С0II и С0III по уравнению:
СщVщ
С = |
(2) |
Vк
где Vщ - объѐм раствора NaOH, пошедший на титрование (среднее арифметическое из результатов трех титрований), Cщ - концентрация
NaOH, моль-экв/л, Vк - объѐм раствора экстрагируемого вещества,
взятый для титрования (в данном случае – 1 мл).
Данные занести в таблицу 1.
7.После установления экстракционного равновесия определить равновес-
ные концентрации экстрагируемого вещества С1I, С1II и С1III в водном слое (рафинате). Для этого из склянок отобрать пипеткой по 1 мл вод-
ных растворов экстрагируемого вещества (нижний слой) в колбы для титрования и оттитровать 0,1 н. раствором NaOH. Титрование провести трижды для каждого раствора (все результаты титрования сверить у преподавателя). Для расчета использовать уравнение (2).
8.По разности С0 – С1 = С2 вычислить равновесные концентрации экстра-
гируемого вещества С2I, С2II и С2III в органическом слое (экстракте).
Данные сверить у преподавателя и занести в таблицу 1.
9.Рассчитать логарифмы С1 и С2 (с точностью до четырех десятичных
65
знаков) и занести данные в таблицу 1.
Таблица 1.
№ V0 щ C0 V1 щ C1 lgC1 C2 lgC2 K=C1/C2n
п.п.
1
2
3
Kсредн=
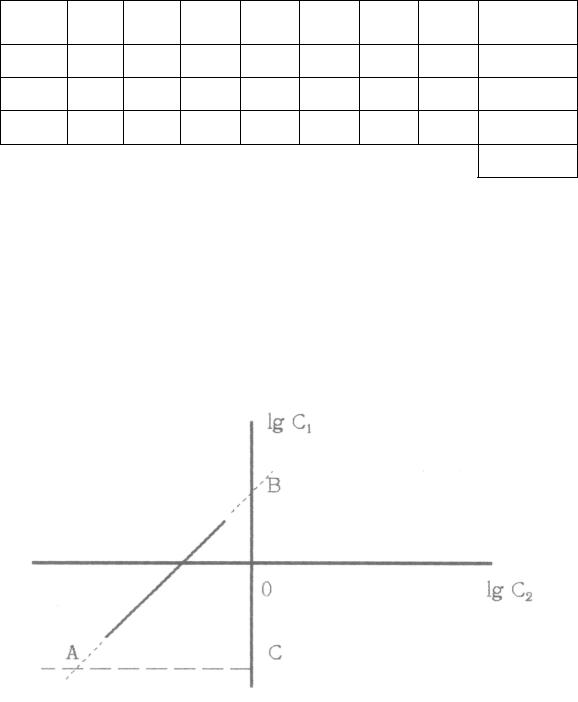
11. Построить график зависимости lgC1 от lgC2 (см. рис.) и продлить его до пересечения с осью Y. При этом от неѐ отсекается отрезок ОВ, равный lgК, а тангенс угла наклона графика к оси Х равен n. Рассчитать коэффициент распределения К=10ОВ. Построить прямоугольный треугольник АВС (так, чтобы отрезки ВС и АС были как можно больше для повышения точности расчета). Рассчитать степень ассоциации экстрагируемого вещества в экстрагенте n = BC/AC.
66

Примечание. Отрезки ВС и АС измеряются в масштабных единицах.
12. Рассчитать по уравнению (1) К для каждого опыта (КI, КII и КIII) и вы-
числить среднее арифметическое. Сравнить это значение с найденным графически. Все расчетные данные занести в таблицу 2.
13. Привести в порядок рабочее место и сдать его дежурному.
|
Таблица 2. |
|
|
Экстрагируемое вещество: |
|
|
|
Органический растворитель: |
|
|
|
Температура опыта: |
T = Co |
|
|
Степень ассоциации в органическом растворителе: |
n = |
|
|
Коэффициент распределения, |
|
найденный графически: |
К = |
Коэффициент распределения, |
|
рассчитанный по уравнению Нернста: |
Ксредн = |
|
|
14. Сформулировать выводы. |
|
67
Тема 3. Кондуктометрия
Кондуктометрия – физико-химический метод исследования и анали-
за различных систем (главным образом водных растворов), основанных на измерении электрической проводимости. Кондуктометрический метод по-
зволяет:
-определить наличие или отсутствие диссоциации исследуемого вещест-
ва в растворе;
-термодинамические характеристики электролитической диссоциации вещества (в частности, энергию диссоциации);
-растворимость трудно растворимых соединений;
-степень и константу диссоциации слабых электролитов;
-константы устойчивости комплексных ионов .
Зависимость электрической проводимости растворов от концентра-
ции веществ лежит в основе одного из методов количественного анализа -
кондуктометрического титрования.
Кондуктометрический метод применяется для фармацевтического анализа лекарственных веществ, для описания свойств новых веществ (как синтезированных, так и выделенных из растительного сырья), для изуче-
ния термодинамики и кинетики биохимических и физиологических про-
цессов, связанных с проницаемостью биологических мембран, со свойствами аминокислот, белков и других, способных к ионизации соеди-
нений.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
 свойства растворов электролитов;
свойства растворов электролитов;
 теорию электролитической диссоциации;
теорию электролитической диссоциации;
 основные положения теории растворов сильных электролитов Дебая– Хюккеля;
основные положения теории растворов сильных электролитов Дебая– Хюккеля;
68
 закон разведения Оствальда, закон Кольрауша;
закон разведения Оствальда, закон Кольрауша;
 расчетные формулы используемых кондуктометрических методов;
расчетные формулы используемых кондуктометрических методов;
 устройство и принцип работы кондуктометра.
устройство и принцип работы кондуктометра.
Студент должен уметь:
 измерять электрическое сопротивление растворов электролитов с по-
измерять электрическое сопротивление растворов электролитов с по-
мощью кондуктометра;
 рассчитывать константу ячейки кондуктометра;
рассчитывать константу ячейки кондуктометра;
 определять удельную и эквивалентную электрические проводимости,
определять удельную и эквивалентную электрические проводимости,
степень и константу диссоциации (ионизации) электролитов;
 проводить кондуктометрическое титрование;
проводить кондуктометрическое титрование;
 строить и анализировать кривые кондуктометрического титрования.
строить и анализировать кривые кондуктометрического титрования.
Студент должен приобрести или закрепить навыки:
 приготовления, разбавления и отмеривания растворов;
приготовления, разбавления и отмеривания растворов;
 расчета концентрации веществ в растворах;
расчета концентрации веществ в растворах;
 титрования;
титрования;
 заполнения таблиц, построения и анализа графиков;
заполнения таблиц, построения и анализа графиков;
 пользования справочной литературой.
пользования справочной литературой.
Вопросы для самоподготовки.
1.Электрохимия. Основные понятия. Электролитическая диссоциация.
Теория растворов сильных электролитов Дебая-Хюккеля. Ионная сила растворов.
2.Коллигативные свойства (криоскопия, эбулиоскопия, осмотическое дав-
ление) растворов электролитов. Изотонический и осмотический коэф-
фициенты, их расчет.
3.Электролитическая диссоциация воды. Водородный показатель рН как мера активной реакции среды.
69

4.Активность ионов и еѐ связь с концентрацией электролита. Коэффици-
ент активности. Константа диссоциации слабых электролитов. Степень диссоциации. Закон разведения Оствальда. Вывод его математического выражения.
5.Удельная и эквивалентная (мольная) электрическая проводимость рас-
творов. Зависимость электропроводимости от различных факторов.
Подвижность ионов. Закон Кольрауша.
6.Кондуктометрическое определение степени и константы диссоциации слабых электролитов.
7.Кондуктометрическое титрование.
Решение типовых задач
Задача 1. Удельная электрическая проводимость 0,175 М раствора аммиака равна 0,476 Ом 1см 1. Подвижности ионов NH4+ и ОН– при 25оС
соответственно равны 73,5 и 198,3 Ом 1см2моль 1. Рассчитать молярную проводимость, степень и константу ионизации аммиака рКb, концентрацию ионов водорода в растворе и его рН.
Решение: Удельная 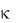 и молярная
и молярная 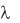 электрические проводимости связаны между собой соотношением =
электрические проводимости связаны между собой соотношением = 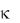 1000/С, где С – концентрация в моль/л; 1000 — пересчетный коэффициент из л в см3.
1000/С, где С – концентрация в моль/л; 1000 — пересчетный коэффициент из л в см3.
Рассчитываем :
0,476  1000
1000  =
= 
 = 2,72 Ом 1см2моль 1
= 2,72 Ом 1см2моль 1
0,175
Степень ионизации вычисляется с помощью уравнения: = /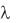 , где
, где
 – мольная (эквивалентная) проводимость при бесконечном разведении,
– мольная (эквивалентная) проводимость при бесконечном разведении,
70
