
Prtakt_fiz_him-och
.pdf
а) критическую температуру растворения (КТР) в системе “фенол + вода”;
б) температуру гомогенизации смеси, содержащей 70% фенола и 30% во-
ды;
в) составы сопряжѐнных растворов при температуре 45оС;
г) пределы растворимости компонентов при температуре 37оС.
Решение:
а) КТР определяется по максимуму кривой растворения. КТР = 68оС.
б) нагревание этой смеси отображается движением фигуративной точки вверх по линии АВ. Точка С, соответствующая переходу из гетерогенной области в гомогенную, соответствует искомой температуре гомогенизации
( 41оС).
в) точки D и Е, отвечающие пересечению конноды (части изотермы, «стя-
гивающей» ветви кривой) с ветвями линии расслоения при 45оС, позволя-
ют определить составы D’ и Е’ сопряжѐнных растворов, сосуществующих при равновесии: D’: 14% фенола +86% воды; Е’: 69% фенола +31% воды.
г) задание аналогично п. в) : при 37оС возможно существование гомоген-
ных растворов, содержащих от 0 до 28% воды в фенольном растворе (об-
ласть G) и от 0 до 12% фенола (область F).
Задача 5. В 1 л (V1) водного раствора содержится 0,15 г иода. Рас-
считать:
а) сколько г иода будет извлечено из этого раствора при однократной экс-
тракции с помощью 40 мл (V2) CСl4;
б) при четырехкратной экстракции порциями (V2)по 10 мл ССl4;
в) степень извлечения в обоих случаях;
г) число экстракций порциями по 10 мл ССl4 , необходимых для извлече-
ния 99% иода.
41

Коэффициент распределения иода между водой и ССl4 К = 0,0117.
Решение.
а) Количество иода, экстрагированного при однократном извлечении:
|
КV1 |
0,0117 1000 |
mэ = mо [1 ( |
)] = 0,15[1 – ( |
)] = 0,116 г. |
|
KV1+V2 |
0,0117 1000 + 40 |
б) Количество иода, экстрагированного при четырехкратном извлечении:
КV1 |
4 |
0,0117 1000 |
4 |
mэ = mо [1 ( |
) ] = 0,15[1 ( |
|
) ] = 0,137 г |
KV1+V2 |
|
0,0117 1000+10 |
|
в) Степень извлечения в первом случае: |
1 = mэ/mо = 0,116/0,15 = 0,773 |
||
(или 77,3%). |
|
|
|
Во втором случае: 2 = mэ /mо = 0,137/0,15 = 0,913 (или 91,3%).
г) решим уравнение для количества экстрагированного вещества
|
|
КV1 |
n |
|
|
|
mэ = mо[1 ( |
) ] |
|
|
|
KV1+V2 |
|
|
относительно числа экстракций (заменяя mэ/mо на ): |
|
|||
mэ |
КV1 |
n |
0,0117 1000 |
n |
= |
= 1 ( |
); 0,99 = 1 ( |
) |
; |
mо |
KV1+V2 |
0,0117 1000 + 10 |
|
|
(0,5391)n = 1 0,99 = 0,01. Для удобства дальнейшего решения логарифми-
руем полученное выражение: n lg 0,5391 = lg 0,01.
Отсюда n = lg 0,01/lg 0,5391 = 2/ 0,2683 = 7,46.
Поскольку возможно проведение только целого числа экстракций,
примем n = 8.
Задача 6. В 100 г воды растворено 1,53 г глицерина (плотность гли-
церина 1,26 г/см3). Рассчитайте для этого раствора:
42

а) температуру кипения, б) температуру замерзания, в) осмотическое дав-
ление.
Решение.
а) С помощью эбулиоскопической формулы для раствора неэлектролита
|
|
Кэ m 1000 |
|
Ткип = |
, |
|
|
М а |
где Кэ |
эбулиоскопическая константа растворителя (для воды она равна |
|
0,52); m |
масса растворенного вещества в г; М его молярная масса; а |
|
масса растворителя в г, |
|
|
рассчитаем Ткип повышение температуры кипения раствора по сравне-
нию с чистым растворителем (водой):
0,52 |
1,53 |
1000 |
|
Ткип = |
|
|
= 0,086о. |
|
92 |
100 |
|
Следовательно, температура кипения раствора будет равна 100 + 0,086 =
100,086 100,1оС.
б) Понижение (депрессию) температуры замерзания раствора неэлектроли-
та найдем с помощью криоскопической формулы
Кк m 1000
Ткип = 
 ,
,
М а
где Кк 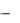 криоскопическая константа растворителя (для воды она равна
криоскопическая константа растворителя (для воды она равна
1,86):
1,86 1,53 1000
Ткип = |
= 0,310о. |
92 100
43

Следовательно, температура замерзания раствора будет равна
0 0,310 = 0,31оС.
в) В соответствии с законом Вант-Гоффа осмотическое давление раство-
ра неэлектролита может быть рассчитано по уравнению
= СRТ,
где Т абсолютная температура; R универсальная газовая постоянная; С
молярная концентрация растворенного вещества (при расчетах в системе СИ она должна быть выражена в моль/м3). Считая плотность воды равной
1 г/см3, найдем объѐм раствора:
Vр р = 1,53/1,26 + 100 = 101,21 см3 =0,10121 л.
Тогда
С = 1,53/92 0,10121 = 0,164 моль/л = 0,164 103 моль/м3,
и
= 0,164 103 8,314 298 = 406321,8 Па ( 4,06 атм).
Задача 7. Камфора С10Н16О перегоняется при нормальном атмосфер-
ном давлении и температуре 95оС с водяным паром. Рассчитайте а) коэф-
фициент расхода водяного пара, б) массу водяного пара, необходимого для получения из сырья 15 кг камфоры.
Решение. а) Коэффициент расхода водяного пара mв/mк рассчиты-
вается по уравнению
mв |
рв Мв |
= |
, |
mк |
рк Мк |
где рв и рк парциальные давления паров воды и камфоры, Мв и Мк их молярные массы.
Давление пара воды находим в справочнике: при 95оС оно равно
84525 Па; давление пара камфоры определим с помощью закона Дальтона,
44

в соответствии с которым общее давление пара в системе из несмешиваю-
щихся компонентов равно сумме парциальных давлений пара каждого из компонентов. Так как общее давление пара равно атмосферному, т.е.
101325 Па, рк = 101325 |
84525 = 16800 Па. |
|
Отсюда |
|
|
mв |
84525 |
18 |
|
= |
= 0,596 кг/кг, |
mк |
16800 |
152 |
то есть для перегонки одного килограмма камфоры требуется 0,596 кг водяного пара.
б) Для получения 15 кг камфоры потребуется 15 0,596 =8,940 кг водяного пара.
Задачи для самостоятельного решения
Задача 1. Рассчитайте давление пара растворителя над раствором,
содержащим 180 г воды и 68,4 г сахарозы, если при температуре 338 К
давление пара над чистым растворителем равно 25003 Па.
Ответ: р = 24502,9 Па.
Задача 2. Рассчитайте температуру замерзания раствора, содержаще-
го 0,9 л глицерина (плотность 1,261 г/см3) в 10 л воды. Криоскопическая константа воды 1,86.
Ответ: Òз = 2,29оС.
Задача 3. Для очистки анилина от примесей его перегоняют с водя-
ным паром при нормальном атмосферном давлении и температуре 98,4оС.
Давление пара воды при этом равно 96258,5 Па. Вычислить расход пара на
1 кг анилина.
Ответ: 3,67 кг пара.
45
Задача 4. Вычислите концентрацию иода в амиловом спирте, нахо-
дящемся в равновесии с водным раствором, содержащим при 25оС 0,340
г/л иода, а коэффициент распределения иода между спиртом и водой К=230.
Ответ: 78,2 г/л.
Задача 5. Коэффициент распределения салицилового альдегида ме-
жду водой и тетрахлорметаном равен 0,0125. 0,5 л водного раствора са-
лицилового альдегида с концентрацией 1,0 г/л взбалтывают с 0,02 л ССl4.
Рассчитайте массу (г) экстрагированного салицилового альдегида и его концентрацию в водном растворе после экстракции.
Ответ: 0,381 г; 0,238 г/л.
Задача 6. Построить (схематически) диаграмму плавкости системы
KCl – AgCl с одной эвтектикой по следующим данным: Тпл KCl 768оС,
AgCl – 455оС, эвтектическая температура 310оС, состав эвтектики 70
мольн.% AgCl.
а) определить, что представляет собой система из 40 мольн.% AgCl и 60
мольн.% KCl;
б) какое вещество выкристаллизуется первым при охлаждении этой систе-
мы;
в) при какой температуре закончится кристаллизация системы? Чему равен состав последних еѐ капель?
г) описать изменение состояния системы при охлаждении еѐ до 250оС
д) каким будет фазовый состав той же системы, если еѐ охладить до 450оС
(при общей массе системы 3 кг)? Рассчитать по правилу фаз Гиббса вари-
антность этой системы (принимая n=1).
46
Ответ к пункту (д): 0,625 г кристаллов KCl, жидкая фаза 71 масс %
AgCl; С = 1.
Задача 7. Для раствора, содержащего 3 г сахарозы в 50 г воды, рас-
считать: а) температуру замерзания, б) температуру кипения.
Ответ: а) 0,3оС |
б) 100,1оС. |
Задача 8. Рассчитать процентную концентрацию глюкозы в инъек-
ционном растворе, который можно вводить внутривенно без дополнитель-
ного изотонирования.
Ответ: 5,41%.
47
Работа 2.1.
Построение диаграммы плавления бинарной смеси.
Цель работы: построение диаграммы плавления и еѐ анализ.
Целевые задачи: освоение принципов построения диаграмм состоя-
ния двухкомпонентных систем и их анализа.
Если два твердых вещества смешать друг с другом в определенных пропорциях и смесь нагреть до высокой температуры, то, как правило, об-
разуется однородная жидкость (расплав), представляющая собой раствор одного компонента в другом. При охлаждении такого расплава до опреде-
ленной температуры он начнет кристаллизоваться, поскольку раствори-
мость веществ друг в друге с понижением температуры уменьшается.
При кристаллизации жидких систем могут выделяться как чистые компоненты и образуемые ими химические соединения, так и твердые рас-
творы. В зависимости от того, какая фаза выделяется из раствора, двух-
компонентные системы с неограниченной растворимостью в жидком состоянии могут быть разделены на типы, из которых для изучения лекар-
ственных веществ наиболее важны следующие:
1.Без химических соединений и твердых растворов.
2.С образованием устойчивого химического соединения (плавяще-
гося конгруэнтно).
3.С образованием неустойчивого химического соединения (плавя-
щегося инконгруэнтно).
4.С неограниченной растворимостью компонентов в твердом со-
стоянии.
Диаграммы состояния изображают равновесия между всеми фаза-
ми, образуемыми компонентами системы при различных концентрациях и
48
температурах и при постоянном давлении. В случае изображения равнове-
сий между расплавом и твердыми фазами такие диаграммы называются
диаграммами плавления (плавкости).
Диаграммы плавления обычно строятся на основе данных термиче-
ского анализа. Из способов термического анализа рассмотрим построение
кривых охлаждения.
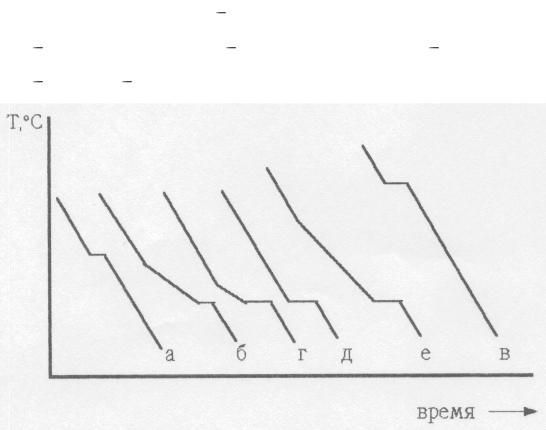
Кривые охлаждения строятся на основании эксперимента по охлаж-
дению расплавленных веществ с непрерывным контролем температуры.
Кривые охлаждения чистых веществ и эвтектических смесей имеют одну ступеньку, соответствующую их температуре кристаллизации (или плав-
ления). На кривых охлаждения смесей кроме ступенек имеются изломы
(см. рисунок внизу), отвечающие появлению кристаллов компонента, при-
сутствующего в избытке (или их плавлению в случае нагревания).
Кривые охлаждения: а |
чистый компонент А; |
|
б |
10% компонента В; в |
чистый компонент В; г 20% В; |
д |
60% В; е 80% В. |
|
49

На основе данных, полученных с помощью кривых охлаждения
строятся диаграммы плавления в координатах температура – состав (см.
рисунок внизу).
Для построения диаграммы плавления на неѐ наносят точки, отве-
чающие температурам изломов и ступенек на кривых охлаждения смесей с соответствующим составом (в массовых или мольных процентах), которые затем соединяют линиями ликвидуса и солидуса. Область на диаграмме выше ликвидуса отвечает жидким расплавам, область ниже солидуса – твердым кристаллам обоих компонентов (две твердые фазы), области меж-
ду ликвидусами и солидусом – гетерогенным системам (жидким распла-
вам, в которые погружены кристаллы одного из компонентов, а именно того, который присутствует в количестве, большем по сравнению с его со-
держанием в эвтектике).
Диаграмма плавления: Э эвтектическая точка;
Л линия ликвидуса; Тэ температура эвтектики;
С линия солидуса; Ж жидкая фаза; Т твердые фазы.
50
