
Prtakt_fiz_him-och
.pdf
8. Рассчитать теплоту гидратации исследуемой соли по уравнению:
Нгидр = Н р-я – Нреш.
Значение теплоты разрушения кристаллической решетки Нреш исследуемой соли следует брать из таблицы:
Вещество |
Нреш., кДж/моль |
NaCl |
+774,0 |
KCl |
+730,0 |
KBr |
+677,5 |
KI |
+637,5 |
9.Рассчитать моляльную концентрацию полученного раствора исследуемой соли:
|
nс 1000 |
m = |
, |
|
А |
где А масса воды в г (30 г), и найти в справочнике соответствующее ей значение Нр-я данной соли. Сравнить его с экспериментально найденным.
10.Сверить данные у преподавателя. Привести в порядок рабочее место и сдать его дежурному.
11.Сформулировать выводы.
31
РАБОТА 1.2.
Определение теплоты нейтрализации.
Цель работы: Определить теплоту нейтрализации сильной кислоты сильным основанием или слабой кислоты сильным основанием.
Целевые задачи: Освоить технику термохимического эксперимента,
определить графически изменение температуры в опыте, рассчитать теплоту нейтрализации:
а) В случае нейтрализации сильной кислоты сильным основанием рассчитать абсолютную и относительную экспериментальные ошиб-
ки;
б) В случае нейтрализации сильной кислоты слабым основанием рассчитать теплоту ионизации слабого основания.
Оснащение рабочего места.
Калориметр |
Термометр |
Магнитная мешалка |
Секундомер |
Цилиндр на 20 мл |
|
Растворы HCl, CH3COOH, NaOH, NH4OH - 1н.
Проведение опыта.
1.Проверить оснащение рабочего места.
2.Отмерить цилиндром 15 мл 1 н. раствора кислоты, указанной преподавателем, перенести кислоту в калориметрический сосуд. Опустить в сосуд магнитный стержень, закрыть его пробкой с вставленным термометром и включить магнитную мешалку.
3.В другой цилиндр отмерить 15 мл 1н. раствора сильного или слабого основания (по указанию преподавателя) и поместить его в непосредственной близости от калориметрической установки.
32
4.После установления теплового равновесия (через 10 минут от начала перемешивания раствора кислоты в калориметре) начать отсчет температуры.
5.Отсчет проводить в течение 5 минут с интервалом 1 мин. (предварительный период).
6.Не прекращая перемешивания перенести раствор основания в калориметрический сосуд.
7.Произвести отсчеты температуры на 6-ой минуте (главный период), и далее вплоть до 10 мин. (заключительный период).
8.Результаты сверить у преподавателя и занести в таблицу.
9.Привести в порядок рабочее место и сдать его дежурному. Приступить к расчетам.
Примечание: Во избежание потери магнитного стержня раствор из калориметрического сосуда необходимо выливать в кристаллизатор. 
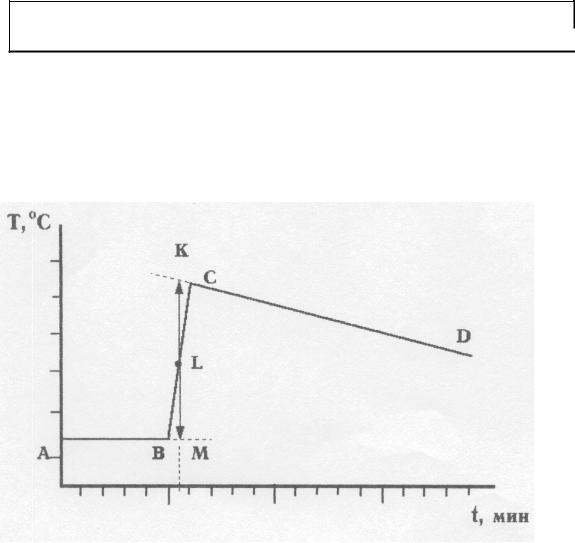
10. Построить график, отражающий зависимость температуры реакционной смеси от времени. Отрезок ВС, соединяющий точки, отвечающие температурам, измеренным на 5-ой и 6-ой минутах, разделить пополам (точка L). Провести через точку L вертикальную линию. Соединить точки начального и заключительного периодов усредняющими прямыми (АВ и СД). Продлить их до пересечения с вертикалью в точках К и М.
33
11. Определить по графику изменение температуры Т соответствующее
отрезку КМ.
12. Рассчитать теплоту нейтрализации по формуле:
Ннейтр = — (w T)/n, где
w - тепловое значение калориметра, Т - изменение температуры в опыте,
n - число молей одноосновной кислоты или основания.
Так как в ходе реакции нейтрализации теплота выделяется, то, со-
гласно термодинамическим правилам записи, еѐ значению приписывается
знак “минус”.
Примечание: Тепловое значение калориметра w указывается пре- 
подавателем или определяется в специальных опытах с навеской KCl, как
описано в работе 1.1.
13. В случае определения теплоты нейтрализации сильной кислоты
сильным основанием, рассчитать абсолютную и относительную ошибки
опыта, сравнивая полученные значения со справочными. Для этого, ис-
пользуя данные справочной таблицы, построить график зависимости
Ннейтр от температуры и с его помощью определить значение Ннейтр,теор, соответствующее температуре опыта Т. (В качестве Т принимается
среднее значение температуры в начальном периоде).
|
|
|
14. В случае определения теплоты ней- |
||
Теплота нейтрализации |
|||||
трализации слабой кислоты сильным ос- |
|||||
сильной кислоты силь- |
|||||
нованием (или сильной кислоты слабым |
|||||
ным основанием при |
|||||
основанием) рассчитать теплоту диссо- |
|||||
|
|
различных |
|||
|
|
циации (ионизации) соответственно сла- |
|||
|
температурах. |
||||
|
бого основания или слабой кислоты: |
||||
Т, К |
|
Ннейтр, кДж/моль |
|||
|
|
Ндисс = Ннейтр слаб – Ннейтр сильн |
|||
283 |
|
-58,70 |
|
||
|
|
|
|||
288 |
|
-57,80 |
15. |
Сформулировать выводы. |
|
293 |
|
-56,90 |
|||
|
|
|
|||
298 |
|
-55,90 |
|
|
|
303 |
|
-54,75 |
|
|
|
34
Тема 2. Фазовое равновесие.
В раздел «Фазовое равновесие» входят вопросы, связанные с качест-
венным и количественным описанием всех видов фазовых переходов (ис-
парение, кипение, сублимация, плавление, отвердевание, конденсация пара, растворение, кристаллизация из растворов, экстракция) в одно- и
многокомпонентных системах.
Фазовые переходы сопровождают все стадии получения и стандар-
тизации лекарственных средств. Термодинамика фазовых переходов явля-
ется теоретической базой перегонки (простой, фракционной,
ректификации, перегонки с водяным паром), жидкостной экстракции, по-
лучения настоек, вымораживания и других процессов, применяемых при получении лекарственных веществ из растительного сырья. Определение с помощью термического анализа температур плавления эвтектических сме-
сей лекарственных веществ позволяет предусмотреть их физическую со-
вместимость или несовместимость. Изучение диаграмм плавления и свойств эвтектических смесей, образующихся при отвердевании двойных смесей, позволяет улучшить качество лекарств, повысить их биодоступ-
ность.
Закон распределения третьего компонента между двумя несмеши-
вающимися жидкостями лежит в основе жидкостной экстракции, исполь-
зуемой для выделения веществ из растворов, их концентрирования,
разделения, очистки. Распределительная хроматография используется для качественного и количественного анализа.
Коэффициент распределения веществ между водой и н-октанолом
(мера гидрофобности) являются важнейшими молекулярными дескрипто-
рами при изучении всасывания лекарственных веществ и проникновения их сквозь клеточные мембраны.
35
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
 основные понятия теории фазовых равновесий (фаза, компонент, число независимых компонентов, вариантность);
основные понятия теории фазовых равновесий (фаза, компонент, число независимых компонентов, вариантность);
 правило фаз Гиббса;
правило фаз Гиббса;
 виды фазовых диаграмм и принципы их построения;
виды фазовых диаграмм и принципы их построения;
 законы Нернста, Рауля, Коновалова, Дальтона, правило Алексеева;
законы Нернста, Рауля, Коновалова, Дальтона, правило Алексеева;
 физико-химические основы экстракции и различных видов перегонки;
физико-химические основы экстракции и различных видов перегонки;
 причины образования и свойства азеотропных растворов и эвтектиче-
причины образования и свойства азеотропных растворов и эвтектиче-
ских смесей.
студент должен уметь:
 строить и анализировать диаграммы кипения, плавления, растворения;
строить и анализировать диаграммы кипения, плавления, растворения;
 проводить жидкостную экстракцию;
проводить жидкостную экстракцию;
 рассчитывать коэффициент распределения и степень ассоциации ве-
рассчитывать коэффициент распределения и степень ассоциации ве-
ществ в растворе;
 рассчитывать число операций экстрагирования, необходимых для дос-
рассчитывать число операций экстрагирования, необходимых для дос-
тижения заданной степени извлечения растворенного вещества;
 определять температуру гетерогенизации и критическую температуру растворения жидкостных смесей;
определять температуру гетерогенизации и критическую температуру растворения жидкостных смесей;
 с помощью правила рычага определять соотношение масс различных фаз в гетерогенных системах;
с помощью правила рычага определять соотношение масс различных фаз в гетерогенных системах;
 определять состав эвтектик и азеотропов и температуры их фазовых пе-
определять состав эвтектик и азеотропов и температуры их фазовых пе-
реходов;
 с помощью правила фаз рассчитывать вариантность (число степеней свободы) гетерогенных систем.
с помощью правила фаз рассчитывать вариантность (число степеней свободы) гетерогенных систем.
студент должен приобрести или закрепить навыки:
 приготовления и отмеривания растворов;
приготовления и отмеривания растворов;
 титрования;
титрования;
36
 пользования термометрами;
пользования термометрами;
 пользования справочной литературой;
пользования справочной литературой;
 табулирования экспериментальных данных;
табулирования экспериментальных данных;
 построения и анализа графиков (диаграмм).
построения и анализа графиков (диаграмм).
Вопросы для самоподготовки
1.Фазовое равновесие. Основные понятия (фаза, компонент, число неза-
висимых компонентов, вариантность системы, фазовые переходы).
Правило фаз Гиббса.
2.Фазовые диаграммы (диаграммы состояния). Диаграмма состояния од-
нокомпонентной системы и еѐ анализ (на примере воды).
3.Уравнение Клапейрона для фазовых переходов (вывод). Применение уравнения.
4.Уравнение Клаузиуса - Клапейрона для процесса кипения (вывод).
5.Растворы. Определение. Способы выражения концентрации. Значение растворов в фармации.
6.Двухкомпонентные (бинарные) смеси летучих жидкостей. Идеальные растворы. Закон Рауля.
7.Реальные растворы. Отклонения от закона Рауля. Диаграммы кипения.
1-й закон Коновалова.
8.Простая перегонка (дистилляция) бинарных смесей, еѐ возможности и применение. Ректификация.
9.2-й закон Коновалова. Азеотропные смеси (азеотропы), их виды. При-
меры. Способы разделения азеотропных смесей. Получение абсолюти-
зированного спирта.
10.Нерастворимые друг в друге жидкости. Закон Дальтона. Перегонка с водяным паром. Вывод уравнения для расчета коэффициента расхода пара.
37
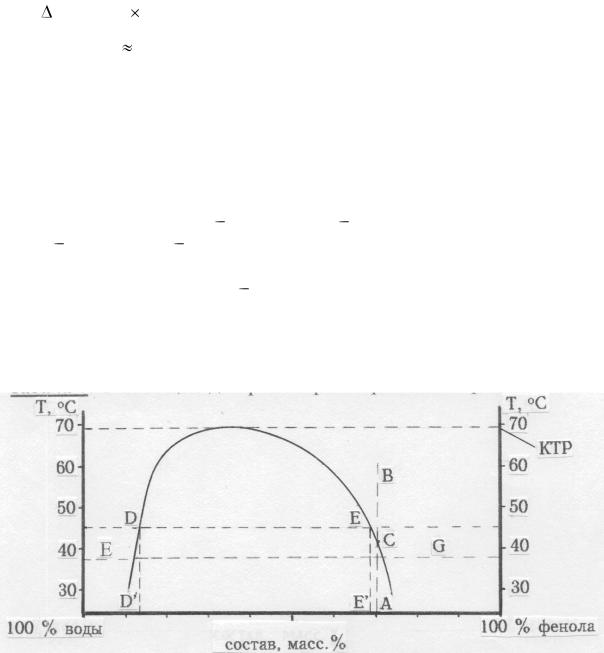
11.Критическая температура растворения. Диаграмма растворимости с верхней, нижней и двумя КТР (примеры).
12.Правило Алексеева. Графическое определение КТР. Сопряженные рас-
творы.
13.Жидкостная экстракция. Основные условия проведения экстракции. За-
кон распределения Нернста.
14.Коэффициент распределения. Степень ассоциации и способы ее опре-
деления.
15.Расчет количества экстрагированного вещества, степени извлечения,
числа экстракций, необходимых для заданного процента извлечения.
16.Диаграммы плавления бинарных смесей. Кривые охлаждения. Терми-
ческий анализ.
17.Диаграммы плавления смесей веществ, образующих химические соеди-
нения. Диаграммы плавления тройных смесей.
18.Коллигативные свойства растворов неэлектролитов. Понижение (де-
прессия) температуры отвердевания растворов. Криоскопическая кон-
станта. Криометрическое определение молярной массы веществ.
19.Повышение температуры кипения растворов. Эбулиоскопическая кон-
станта. Эбулиоскопическое определение молярной массы веществ.
20.Осмос. Осмотическое давление растворов неэлектролитов. Уравнение Вант-Гоффа.
21.Изо-, гипо- и гипертонические растворы в фармации. Изотонирование.
Осмометрическое определение молярной массы веществ.
Решение типовых задач.
Задача 1. Для предотвращения частичного разложения лекарствен-
ного препарата в кипящем водном растворе при отгонке воды необходимо снизить температуру кипения на 20оС. Вычислить, какое давление при
38

этом надо поддерживать в перегонном аппарате. Теплота испарения воды
40,66 кДж/моль.
Решение. Используем для расчета уравнение Клапейрона-Клаузиуса:
где Т1 и Т2 - температуры кипения при давлениях р1 и р2 соответственно.
|
р2 |
|
Н (Т2 |
|
Т1) |
|
|
ln |
= |
|
|
|
, |
|
p1 |
|
R T1 T2 |
|
||
Считая, что при нормальном атмосферном давлении р2 =101325 Па |
||||||
температура кипения раствора Т2 |
100oС (373 К), подставим значения: |
|||||
|
р2 |
40,66 (373 |
353) |
|||
ln |
= |
|
|
|
|
= 0,7428. |
|
p1 |
8,314 |
10 3 |
353 |
373 |
|
Отсюда ln p1 = ln 101325 – 0,7428 = 11,5261 – 0,7428 = 10,7833
и, значит, р1 = е10,7833 = 48208,95 Па = 0,48 атм.
Задача 2. В 100 г воды растворено 1,53 г глицерина. Давление пара воды при 298 К равно 31672 Н/м2 . Рассчитать понижение давления пара воды над раствором по сравнению с чистой водой.
Решение. По закону Рауля относительное понижение давления рав-
новесного с раствором пара равно мольной доле Х растворенного вещест-
ва:
р/ро = Хгл,
откуда
р =Хглро , где Хгл - мольная доля глицерина.
Так как Хгл = nгл/( nгл+nН2О), где n - количество вещества в молях
(nН2О = 100/18 = 5,555 моль; nгл = 1,53/92 = 0,0166 моль), то Хгл = 0,0166/(0,0166 + 5,555) = 0,003.
39
И тогда р = 0,003 31672 = 95,016 Па (то есть давление пара воды над
этим раствором на 95 Па ниже, чем над чистой водой).
Задача 3. Рассчитать вариантность систем:
а) водный раствор NaCl и KCl + водяной пар лед + кристаллы KCl +
+ кристаллы NaCl. |
|
б) водный раствор KOH и CO2 |
+ водяной пар. |
Решение: Вариантность (число степеней свободы) рассчитывается |
|
по правилу фаз Гиббса С = К |
Ф + n, где К число независимых компо- |
нентов, Ф число фаз, n число внешних факторов, влияющих на состояние системы. Для систем, содержащих газовую фазу, n = 2, для состоящих только из конденсированных фаз n = 1.
а) В системе 3 компонента (вода и две соли), между которыми не происходит химической реакции, 5 фаз (раствор, пар, лед и кристаллы двух солей), значит
С = 3 – 5 + 2 = 0.
б) В этом случае в системе возможна реакция 2КОН + СО2 = К2СО3 + Н2О, при этом появляется еще один компонент К2СО3 . Число независимых компонентов равно общему числу компонентов минус число протекающих в системе реакций, и значит
С = ( 4 – 1 ) – 2 + 2 = 3.
Задача 4. С помощью диаграммы растворимости определить:
40
