
Prtakt_fiz_him-och
.pdf
Vсопр. к. и С сопр. к. те же величины для раствора сопряжѐнной кислоты.
Решаем уравнение относительно объѐмов:
Vсопр. осн.  Ссопр. осн.
Ссопр. осн.
lg |
= рН рКа |
Vсопр. к. |
С сопр. к. |
Примем объѐм раствора СН3СООН, необходимый для приготовления 10
мл буферного раствора, за х мл. Тогда объѐм раствора сопряжѐнного осно-
вания (в данном случае ацетата натрия) будет равен 10 х мл. Отсюда
(10 – х) |
0,2 |
|
lg |
= 3,2 – 4,74 = 0,02884; |
|
0,5 х |
|
|
2 – 0,2 х = 0,01442 х; |
0,21442 х = 2; |
|
х = 2/0,21442 = 9,33 мл |
(объѐм 0,2 М СН3СООН); |
|
10 – х = 0,67 мл |
(объѐм 0,2 М СН3СООNa). |
|
Задача 2. Рассчитать электродные потенциалы, электродвижущую силу, изменение энергии Гиббса и константу равновесия реакции, проте-
кающей в гальваническом элементе
( ) Zn | ZnSO4 || CuSO4 | Cu (+)
C = 0,5 M C = 1 M
при замыкании цепи. Указать катод и анод. Т = 25оС
Решение: Потенциалы электродов ЕМе n+/Ме рассчитаем по уравнению Нернста:
91

|
|
|
|
RT |
|
|
0,059 |
|
|
|
|
n+ |
|
о |
n+ |
n+ |
о |
n+ |
/Ме + |
|
n+ |
, |
|
ЕМе /Ме = Е |
Ме |
/Ме + |
ln aMe |
= Е |
Ме |
ln aMe |
|||||
|
|
|
|
nF |
|
|
|
n |
|
|
|
|
|
о |
n+ |
|
|
|
|
|
|
|
|
где Е |
Ме |
/Ме – стандартный электродный потенциал; |
|
|
|||||||
|
n+ |
– активность ионов, участвующих в электродной реакции. |
|||||||||
aMe |
|||||||||||
Коэффициенты активности |
и стандартные электродные потенциа- |
||||||||||
лы ЕоМеn+/Ме возьмем в справочнике: |
|
|
|
|
|
|
|||||
аCu2+ = |
Cu2+CCu2+ = 0,043 |
1 = 0,043 моль/л; |
ЕоCu2+/Cu = +0,337 В; |
||||||||
аZn2+ = |
Zn+CZn+ = 0,063 0,5 = 0,0315 моль/л; |
ЕоZn2+/Zn = |
0,763 В. |
||||||||
Подставляем значения: |
|
|
|
|
|
|
|||||
|
|
|
|
|
0,059 |
|
|
|
|
|
|
ЕСu2+/Cu = +0,337 + |
lg 0,043 |
= +0,297 В |
|
(E+); |
|||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
0,059 |
|
|
|
|
|
|
|
ЕZn2+/Zn = |
0,763 + |
lg 0,0315 = –0,807 В |
|
(E–). |
|||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
ЭДС элемента равна разности потенциалов более положительного и более отрицательного электродов:
Е = Е+ – Е– ,
то есть в данном случае:
Е = ЕCu2+/Cu EZn2+/Zn = +0,297 ( 0,807) = 1,104 B.
В гальваническом элементе катод заряжен положительно, а анод  отрицательно, значит, катодом является медный электрод, а анодом цин-
отрицательно, значит, катодом является медный электрод, а анодом цин-
ковый. На катоде при замыкании цепи идет реакция восстановления меди,
на аноде - реакция окисления цинка.
Зная ЭДС, можно рассчитать изменение энергии Гиббса в ходе реак-
ции Gо: Gо = nFE, где n - число электронов, участвующих в реакции,
F - число Фарадея.
92

Подставляем значения:
Gо = 2 96500 1,104 = 212300 Дж/моль.
Так как Gо < 0, равновесие в реакции
Zno + Cu2+ = Zn2+ + Cuo
будет смещено вправо. По величине Gо можно вычислить константу рав-
новесия реакции (так как в реакции не участвуют газообразные вещества,
то Kp = Kc):
Gо |
212300 |
|
lnKp = lnKc = – |
= |
= 85,6887. |
RT |
|
8,314 298 |
Отсюда Кр = Кс = е85,6887 = 1,64 |
1037. |
|
Задача 3. ЭДС элемента, составленного из водородного и нормаль-
ного хлоридсеребряного электродов, при 25оС равна 0,300 В. Рассчитать рН раствора, с которым контактирует водородный электрод и активность ионов водорода в нѐм.
Решение: Поскольку потенциал хлоридсеребряного электрода ЕХСЭ
равен +0,222 В, а потенциал водородного электрода ЕВЭ близок нулю и Е =
Е+ Е , можно записать:
Е = ЕХСЭ |
ЕВЭ. |
|
Помня, что ЕоВЭ = 0 и значит ЕВЭ = 0,059 lg aH+ = |
0,059 pH, получаем |
|
Е = ЕХСЭ + 0,059 рН, |
|
|
откуда |
|
|
Е ЕХСЭ |
0,300 |
0,222 |
рН = |
= |
= 1,32 ; |
0,059 |
0,059 |
|
93

и аН+ = 10 рН = 10 1,32 = 0,0479 моль/л.
Задача 4. Рассчитать растворимость и произведение растворимости
AgI при 25оС, если электродвижущая сила элемента, составленного из двух серебряных электродов, погруженных соответственно в насыщенный рас-
твор иодида серебра и в раствор AgNO3 c активностью 1 моль/л, равна
0,4535 В.
Решение: В случае концентрационного элемента, которым является элемент, описанный в условии,
Е = Е+ Е = ЕоAg+/Ag + 0,0591 lg aAg+ (1) (ЕоAg+/Ag + 0,0591 lg aAg+ (2) ).
Отсюда получаем
|
aAg+ (1) |
Е = 0,0591 lg |
= 0,4535. |
|
aAg+ (2) |
Индекс 1 в данном случае относится к более положительному электроду,
контактирующему с раствором AgNO3, индекс 2 - к более отрицательному,
погруженному в насыщенный раствор AgI. Так как коэффициент активно-
сти 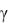 1М AgNO3 равен 0,429, то aAg+ (1) = 0,429 1 = 0,429. Решаем уравне-
1М AgNO3 равен 0,429, то aAg+ (1) = 0,429 1 = 0,429. Решаем уравне-
ние относительно искомой концентрации, которая в очень разбавленном растворе практически совпадает с активностью:
lg [aAg+ (1)/ aAg+ (2)] = 0,4535/0,0591 = 7,6734; 0,429/aAg+ (2) = 107,6734 = 4,7141 107; aAg+ (2) = 0,429/4,7141 107 = 9,1 10 9.
То есть концентрация AgI в насыщенном растворе, равная aAg+ (2)
составляет 9,1 10 9 моль/л, а произведение растворимости при этом будет ПР = aAg+ аI = (9,1 10 9)2 = 8,3 10 17.
94

Задачи для самостоятельного решения
Задача 1. ЭДС элемента, состоящего из водородного и нормального каломельного электродов, погруженных в исследуемый раствор, при 298К
равна 0,664 В. Рассчитать рН и активность ионов водорода в растворе.
Ответ: 6,50; 3,16 10 7.
Задача 2. Рассчитать ЭДС гальванического элемента
Zn|Zn2+ a=0,0004||Cd2+ a=0,2|Cd
и изменение энергии Гиббса протекающей в нѐм при 25оС реакции
Znо + Cd2+ =Zn2+ + Cdî,
если стандартные электродные потенциалы соответственно равны: ЕоZn2+/Zn
= – 0,763 B и EоCd2+/Cd = – 0,403 В.
Ответ: 0,4398 В; 84,88 кДж/моль.
Задача 3. Рассчитать ЭДС двух элементов с общей формулой Pt|H2; HCl||Cl2(газ); Cl |Pt, отличающихся концентрацией HCl: 1) СHCl = 0,01 М (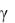 =
=
0,906); 2) СНСl = 0,05 М ( = 0,833) (в скобках приведены коэффициенты ак-
тивности растворов). Потенциал хлорного электрода Pt Cl2(газ); Cl равен
равен
+1,3595 В.
Ответ: 1) 1,480 В; 2) 1,441 В.
Задача 4. Рассчитать Gо реакции Mgо + 2Ag+ Mg2+ + 2Agо, проте-
кающей в гальваническом элементе при стандартных условиях (активность ионов равна единице). Стандартные электродные потенциалы: ЕоMg/Mg2+ = 2,37 B, EоAg/Ag+ = +0,799 B. Указать, пойдет ли реакция в данных условиях
в прямом направлении.
95

Ответ: 611,6 кДж/моль; реакция может идти самопроизвольно, так как Gо <0.
Задача 5. Вычислить константу равновесия реакции
SnCl2 + 2 FeCl3 SnCl4 + 2 FeCl2,
идущей в гальваническом элементе. Соответствующие окислитель-
но восстановительные потенциалы равны: ЕоFe3+/Fe2+ = 0,771 В, EоSn4+/Sn2+
= 0,150 В.
Ответ: K = 1021.
Задача 5. Рассчитать растворимость и произведение растворимости сульфида цинка при 25оС. ЭДС концентрационного гальванического эле-
мента
Zn | ZnS || ZnSO4 | Zn a = x C = 0,5M
равна 0,276В ( ZnSO4 = 0,063).
Ответ. 1,39 10 11 моль/л; 1,93 10 22.
96

Работа 4.1
Потенциометрическое и колориметрическое определение рН растворов и концентрации водородных ионов
Цель работы: измерение водородного показателя (рН) растворов при помощи потенциометрического и колориметрического методов.
Целевые задачи: приготовление буферных растворов с заданными значениями рН, освоение методики работы на рН–метре, сравнение достоинств и недостатков колориметрического и потенциометриче-
ского методов определения рН растворов.
Константа равновесия реакции диссоциации воды Н2О |
Н+ + ОН– |
|
определяется соотношением: |
|
|
|
аН+ аОН |
|
Ка = |
, |
|
|
аН2О |
|
где а – активности. |
|
|
Так как активность недиссоциированной воды аН2О=1, то
Ка = аН+ аОН- = Кв.
Величина Кв представляет собой ионное произведение воды. Она за-
висит только от температуры. При 25оС Кв = 1,008 10 14. Отсюда, при той же температуре, активность ионов водорода в воде
аН+ СН+ = Кв 10 7 г-ион/л.
Активность ионов водорода выражается следующими соотношения-
ми:
в воде:
в сильной одноосновной кислоте:
в слабой одноосновной кислоте:
аН+ аН+ = аН+ =
СН+
С
С,
97

где С – молярная концентрация раствора кислоты, 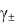 – средний ионный коэффициент активности, – степень диссоциации.
– средний ионный коэффициент активности, – степень диссоциации.
Величину аН+ называют активной кислотностью, а СН+ – общей
кислотностью.
Активную кислотность принято выражать с помощью водородного показателя рН – десятичного логарифма активности водородных ионов,
взятого с противоположным знаком:
рН = lg aН+
При 25оС в нейтральном растворе рН = 7, в кислом рН < 7, в щелоч-
ном рН > 7. Аналогично можно ввести понятие гидроксильного показателя рОН.
Во многих случаях необходимо готовить растворы с устойчивым
значением водородного показателя (буферные растворы).
Буферными растворами называются растворы, которые поддержи-
вают определенное значение рН при разбавлении или введении небольших
количеств сильных кислот, сильных оснований и других веществ.
Буферный раствор может быть образован смесью сопряжѐнной ки-
слоты и сопряжѐнного основания, а именно смесью слабой кислоты и еѐ соли с сильным основанием (например, смесь уксусной кислоты с ацета-
том натрия в водных растворах), или смесью слабого основания и его соли с сильной кислотой (например, аммиака с хлоридом аммония), или смесью
двух или более солей многоосновных слабых кислот.
Рассмотрим подробно первый пример. В соответствии с уравнением
диссоциации уксусной кислоты СН3СООН СН3СОО– + Н+
еѐ термодинамическая константа диссоциации равна:
|
аСН3СОО– аН+ |
Ка = |
, |
|
аСН3СООН |
98 |
|

откуда
аСН3СООН
aН+ = Ка 
 .
.
аСН3СОО–
Введение в раствор уксусной кислоты еѐ полностью ионизированной соли ацетата натрия смещает равновесие диссоциации влево. В резуль-
тате активность недиссоциированной кислоты становится практически равной еѐ общей (аналитической) концентрации, а активность ацетат-иона
– равной активности иона прибавленной соли. Поэтому
Скисл
aН+ = Ка  .
.
Ссоль
В обычно используемых на практике буферных растворах концен-
трации кислоты и соли не очень велики, поэтому можно принять 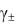 = 1.
= 1.
Отсюда:
|
Скисл |
рН = рКа – lg |
, |
|
Ссоль |
где рКа = lg Ка. |
|
Таким образом, рН буферного раствора зависит от величины рКа слабой кислоты и от соотношения концентраций кислоты и еѐ соли в рас-
творе, т.е. для приготовления буферного раствора с заданным значением рН необходимо ввести в раствор слабую кислоту и еѐ соль в определен-
ных, легко рассчитываемых соотношениях.
Аналогичное уравнение можно получить для буферного раствора,
образованного слабым основанием и его солью, и для солевых буферных растворов.
99
Буферные растворы обладают тем важным свойством, что разбавле-
ние их почти не изменяет концентрации водородных ионов, так как при разбавлении отношение Скисл/Ссоль меняется очень мало (в основном из-за изменения коэффициента активности соли).
Многие биологические жидкости, в том числе кровь, являются бу-
ферными растворами. Компоненты таких растворов карбонаты, фосфаты,
белки.
Для измерения водородного показателя растворов разработан ряд методов, из которых наиболее часто применяются потенциометрический и колориметрический.
При использовании потенциометрического метода рН определяют с помощью гальванического элемента, один из электродов которого (ин-
дикаторный) обратим относительно ионов водорода, т.е. его потенциал может изменяться пропорционально рН раствора; другой электрод (элек-
трод сравнения) имеет постоянный потенциал, не зависящий от состава и свойств исследуемого раствора.
Индикаторными электродами могут быть, например, водородный,
стеклянный; электродами сравнения – каломельный или хлоридсеребря-
ный.
В лабораторной практике чаще всего используются стеклянный и хлоридсеребряный электроды.
Внутреннее сопротивление гальванического элемента, состоящего из стеклянного и хлоридсеребряного электродов, велико и может достигать десятков МОм. По этой причине для измерения его ЭДС используют спе-
циальные приборы с большим внутренним сопротивлением, что позволяет практически исключить из измеряемой ЭДС падение напряжения в стек-
лянной мембране. Широкое применение для этих целей нашли электрон-
100
