
Prtakt_fiz_him-och
.pdf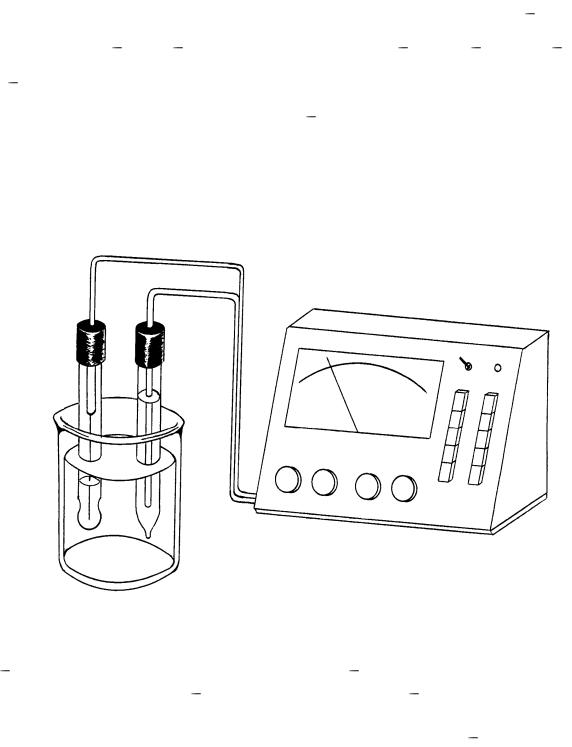
ные потенциометры с логарифматорами, получившие название рН |
метров |
(например, рН метры милливольтметры ЛПУ 01, рН 340, |
pH 121 |
рН 150 .).
Хлоридсеребряный электрод в рН метре помещается в насыщенный раствор КСl для поддержания постоянной величины его потенциала. Стек-
лянный электрод надо хранить в воде или в 0,1М растворе НСl.
1 стеклянный электрод (индикаторный); 2 хлоридсеребряный электрод (электрод сравнения); 3 исследуемый раствор; 4 измерительный прибор.
Перед началом измерений правильность работы рН метра должна быть проверена с помощью эталонных буферных растворов.
При колориметрическом методе рН растворов измеряется с помо-
щью особых веществ – индикаторов. В качестве индикаторов использу-
ются некоторые слабые органические кислоты или основания, имеющие в недиссоциированном и диссоциированном состояниях различную окраску.
101

Перемена окраски в случае индикатора – слабой кислоты связана с изме-
нением электронной структуры молекул при их диссоциации:
НInd H+ + Ind– .
В достаточно кислой среде равновесие сдвинуто влево и окраска раствора определяется цветом недиссоциированного индикатора (кислой формы); в достаточно щелочной среде – цветом анионов (щелочной фор-
мы). При употреблении терминов «кислая» и «щелочная форма» речь идет о состоянии индикаторов в среде с меньшим или большим значением рН,
чем отвечающее перемене окраски, но не обязательно меньшим или боль-
шим 7.
Интенсивность окраски раствора определяется степенью диссоциа-
ции индикатора, зависящей от рН. В некотором интервале значений рН,
который называют зоной перехода индикатора, происходит изменение окраски. Однако из-за малой чувствительности глаза к перемене окраски она ощущается лишь тогда, когда отношение количеств окрашенной и не-
окрашенной форм достигает 10 (или 0,1). Поэтому область применения индикатора, зависящая от константы его диссоциации (ионизации) КInd,
приближенно находится в пределах двух единиц рН: рН = рКInd 1.
Область применения индикаторов зависит также от температуры,
природы растворителя и примесей посторонних веществ.
Раньше для колориметрического определения рН растворов в широ-
ком диапазоне готовилась так называемая колориметрическая шкала,
представляющая собой ряд пробирок с эталонными растворами, имеющи-
ми определенное значение рН, и содержащими смесь индикаторов (или
«универсальный индикатор»). Цвет индикатора в исследуемом растворе сравнивался (часто с помощью воздушного компаратора) с эталонами. На основании совпадения цвета делалось заключение о рН раствора. В на-
стоящее время в связи с громоздкостью комплекта пробирок, с трудоѐмко-
102

стью и большим расходом реактивов этот метод вытеснен применением
индикаторной бумаги. С еѐ помощью можно быстро и надежно оценить рН
раствора с точностью до одной единицы рН.
Оснащение рабочего места.
рН-метр Эталонные буферные растворы Стаканы на 50 мл Бюретки
Реактивы для приготовления буферных растворов Универсальная индикаторная бумага
Проведение опыта.
1.Проверить оснащение рабочего места.
2.Включить рН метр и дать ему прогреться не менее 20 минут.
3.Приготовить серию буферных растворов с различными значениями рН (по указанию преподавателя).
4.С помощью универсальной индикаторной бумаги ориентировочно определить рН каждого буферного раствора. Результаты занести в таблицу.
Номера буферных |
|
|
|
|
|
Контрольный |
растворов |
1 |
2 |
3 |
4 |
5 |
раствор |
Компоненты бу- |
Объѐмы (мл) растворов компонентов, взятых для |
N |
||||
ферных растворов |
|
приготовления буферных смесей |
|
|
||
1. |
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
рН, найденный |
|
|
|
|
|
|
колориметрически |
|
|
|
|
|
|
рН, найденный |
|
|
|
|
|
|
потенцио- |
|
|
|
|
|
|
метрически |
|
|
|
|
|
|
аН+, моль/л |
|
|
|
|
|
|
5. Проверить правильность работы рН-метра, измерив рН эталонных бу-
ферных растворов.
ВНИМАНИЕ! Корректировку показаний прибора проводить только под руководством преподавателя.
103
6.Измерить рН приготовленных буферных растворов.
7.Измерить рН контрольного раствора.
8.Полученные данные показать преподавателю и занести в таблицу.
9.Выключить прибор. Опустить стеклянный электрод и наконечник элек-
тролитического мостика (или хлоридсеребряный электрод при другой
конструкции прибора) в стакан с дистиллированной водой. 10.Рассчитать активности водородных ионов во всех растворах и результа-
ты занести в таблицу (аН+=10-рН).
11.Привести в порядок рабочее место и сдать его дежурному. 12.Сформулировать выводы.
104
Работа 4.2
Потенциометрическое определение буферной ёмкости
Цель работы: определение величины буферной ѐмкости буферного раствора.
Целевые задачи: закрепление навыка работы на рН-метре и опреде-
ления достоверности его показаний; умение определять буферную ѐмкость растворов по кислоте и щѐлочи графическим способом.
Значение рН буферного раствора зависит от концентраций компо-
нентов буферной смеси, находящихся в химическом равновесии. Оно мало меняется при концентрировании и разбавлении раствора, а также при вве-
дении относительно небольших количеств веществ, взаимодействующих с одним из компонентов буферного раствора, в том числе кислот и основа-
ний. Количественно буферное действие характеризуется буферной ѐмко-
стью. Ёмкость буферного раствора соответствует числу эквивалентов (или миллиэквивалентов) сильной кислоты или сильного основания, которое необходимо добавить к 1 л раствора, чтобы изменить его рН на единицу.
Буферная ѐмкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Наибольшей буферной ѐм-
костью обладает раствор, в котором отношение количеств сопряжѐнной кислоты и сопряжѐнного основания равно единице.
|
Оснащение рабочего места. |
рН метр |
Эталонные буферные растворы |
Стакан на 50 мл |
Растворы HCl и NaOH (0,1 н.) |
Бюретки на 25 мл |
Растворы реактивов для приготовления |
Магнитная мешалка |
буферных растворов |
105

Проведение опыта.
1.Проверить оснащение рабочего места.
2.Включить рН метр и дать ему прогреться не менее 20 минут.
3.Приготовить два одинаковых образца по 20 мл буферного раствора, ука-
занного преподавателем.
4.Проверить правильность работы рН метра, измерив рН эталонных бу-
ферных растворов.
ВНИМАНИЕ! Корректировку показаний прибора проводить только под руководством преподавателя. 
5.Стакан с 20 мл исследуемого буферного раствора и опущенным в него магнитным стержнем поставить на столик магнитной мешалки. Погру-
зить в раствор стеклянный электрод и наконечник электролитического мостика (или хлоридсеребряный электрод при другой конструкции при-
бора). Подвести к стакану бюретку с 0,1н. раствором NaОН.
6.Включить магнитную мешалку. Измерить рН раствора.
7.Не снимая стакана со столика магнитной мешалки и не прекращая пе-
ремешивания прилить к буферному раствору из бюретки 1 мл раствора
NaОН. После этого вновь измерить рН раствора.
8. Продолжать приливать из бюретки раствор NaОН порциями по 1 мл,
каждый раз измеряя и записывая в таблицу величины рН, до тех пор, по-
ка рН изменится больше, чем на единицу по сравнению с исходным зна-
чением.
9. Произвести согласно п.п. 7 – 8 аналогичные измерения с другой порци-
ей исходного буферного раствора, добавляя к нему 0,1н. раствор HCl.
10. После проверки экспериментальных данных у преподавателя занести их в таблицу. Выключить рН метр и магнитную мешалку. Погрузить стек-
106
лянный электрод и наконечник электролитического мостика в дистиллиро-
ванную воду.
Название буферной смеси и еѐ состав:
VNaOH, |
pH |
|
VHCl, |
pH |
мл |
|
|
мл |
|
|
|
|
|
|
0 |
|
|
0 |
|
1 |
|
|
1 |
|
2 |
|
|
2 |
|
3 |
|
|
3 |
|
... |
|
|
... |
|
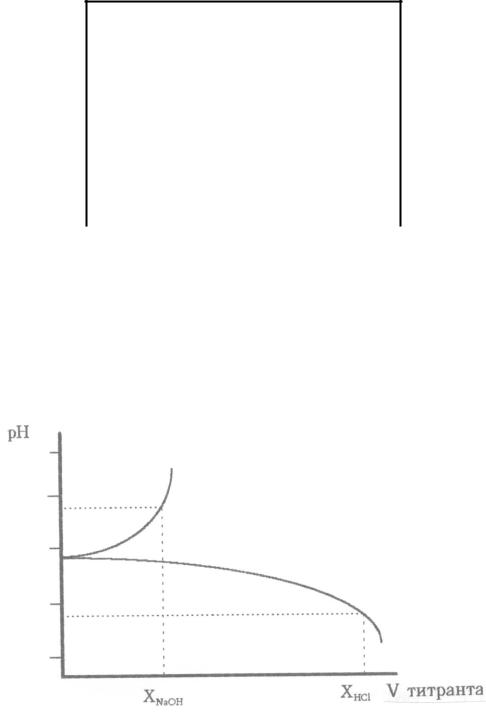
11. Построить графики зависимости рН раствора от объѐма прибавленных
растворов основания и кислоты. Определить по графику точные объѐмы
(в мл) растворов титрантов (ХNaOH и XHCl), необходимые для изменения рН раствора на единицу.
107

12. Рассчитать буферную ѐмкость В раствора по NaOH и по HCl по уравне-
ниям:
ХNaOH CNaOH ВNaOH = 
 ,
,
a
XHCl CHCl ВHCl = 

 ,
,
a
где С - концентрация титранта, моль-экв/л; а - объѐм исходного бу-
ферного раствора, взятый для опыта, мл.
13.Привести в порядок рабочее место и сдать его дежурному.
14.Сформулировать выводы.
108
Тема 5. Кинетика химических реакций
Химическая кинетика – раздел физической химии изучающий зави-
симость механизма и скорости реакций от различных факторов (темпера-
туры, давления, концентрации, присутствия катализаторов). Главная область использования кинетических закономерностей в фармации - опре-
деление и продление сроков годности лекарственных препаратов, расчет эффективности аппаратов, используемых для получения лекарственных веществ, изучение механизмов химических и биохимических реакций. Та-
кие составляющие действия лекарств, как высвобождение, всасывание из пищеварительного тракта и через кожу, диффузия через клеточные мем-
браны, взаимодействие с рецептором и т. п. также описываются кинетиче-
скими уравнениями; их изучением занимаются специальные фармакологические дисциплины фармакокинетика и фармакодинамика.
Присутствие катализаторов сказывается не только на процессах по-
лучения, но и на реакциях разложения веществ, в том числе лекарствен-
ных. При этом различные примеси, в том числе продукты разложения,
материал сосуда или упаковки могут являться как катализаторами, так и ингибиторами. Ингибиторы в ряде случаев специально вводятся в лекарст-
венные препараты для продления сроков годности.
Практически все реакции, протекающие в живом организме, осуще-
ствляются с помощью биологических катализаторов  ферментов (энзи-
ферментов (энзи-
мов). На основе ферментов создано много лекарственных препаратов,
применяемых главным образом для стимуляции обменных процессов.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
 виды скорости химических реакций, факторы, влияющие на неѐ;
виды скорости химических реакций, факторы, влияющие на неѐ;
 закон действующих масс;
закон действующих масс;
 кинетическую классификацию химических реакций;
кинетическую классификацию химических реакций;
 понятие о молекулярности и порядке (псевдопорядке) реакций;
понятие о молекулярности и порядке (псевдопорядке) реакций;
109

 методы определения порядка;
методы определения порядка;
 кинетические уравнения реакций 1 и 2 порядков;
кинетические уравнения реакций 1 и 2 порядков;
 способы расчета сроков годности и времени полупревращения веществ в реакциях 1 и 2 порядков;
способы расчета сроков годности и времени полупревращения веществ в реакциях 1 и 2 порядков;
 правило Вант Гоффа;
правило Вант Гоффа;
 понятие о температурном коэффициенте скорости;
понятие о температурном коэффициенте скорости;
 уравнение Аррениуса, его практическое значение для расчета сроков годности лекарственных веществ методом ускоренного старения.
уравнение Аррениуса, его практическое значение для расчета сроков годности лекарственных веществ методом ускоренного старения.
Студент должен уметь:
определять скорость химических реакций;
определять порядок реакции;
рассчитывать константы скорости реакции 1 и 2 порядка;
рассчитывать энергию активации реакции;
рассчитывать сроки годности лекарственных веществ.
Студент должен приобрести или закрепить навыки:
титрования растворов;
работы с поляриметром;
работы с фотоколориметром;
пользования мерной посудой и другим лабораторным оборудованием;
расчетов по различным уравнениям;
 построения графиков и интерпретации экспериментальных и расчет-
построения графиков и интерпретации экспериментальных и расчет-
ных данных;
пользования справочной литературой.
Любая химическая реакция представляет собой совокупность эле-
ментарных актов химического превращения, каждый из которых представ-
ляет собой превращение одной или нескольких частиц реагентов в частицы продуктов. Простые реакции состоят из однотипных элементарных актов.
110
