
Prtakt_fiz_him-och
.pdf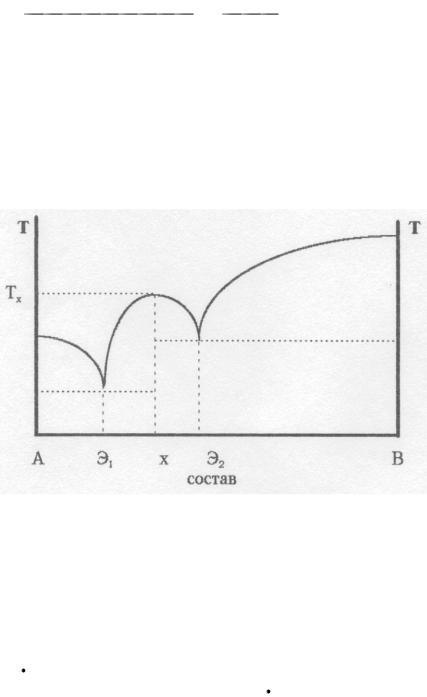
Точка Э на диаграмме плавления, в которой пересекаются ликвидусы и солидус, соответствует эвтектической смеси (или эвтектике). Она представляет собой смесь компонентов с определенным составом, плавящуюся и отвердевающую подобно чистым веществам при постоянной температуре (температуре эвтектики).
Соотношение масс жидкой и твердой фазы в гетерогенной системе можно определить по правилу рычага. Например, для системы с составом Х при температуре Тх, если состав выражен в массовых процентах,
Масса жидкости |
КL |
|
= |
Масса твердой фазы |
LМ |
(при этом длина отрезка КМ пропорциональна общей массе смеси).
В том случае, когда компоненты смеси А и В образуют устойчивое химическое соединение, которое может быть выделено в твердом виде, на диаграмме плавления появляется максимум, отвечающий составу этого соединения и его температуре плавления. Такие соединения называют конгруэнтно плавящимися (см. рисунок ниже). В таких системах имеются две точки эвтектики ( Э1 и Э2).
х – состав устойчивого химического соединения,
ТХ – его температура плавления.
Для систем с химическим соединением состав на диаграммах удобнее указывать в мольных процентах (или мольных долях), так как при этом можно легко определить состав соединения. Например, если максимум соответствует составу 50 мольн.% А + 50 мольн.% В, то соединению отвечает формула А В, а если максимум приходится на состав 25 мольн.% А + 75 мольн.% В, то соединение имеет формулу А 3В (или АВ3).
51
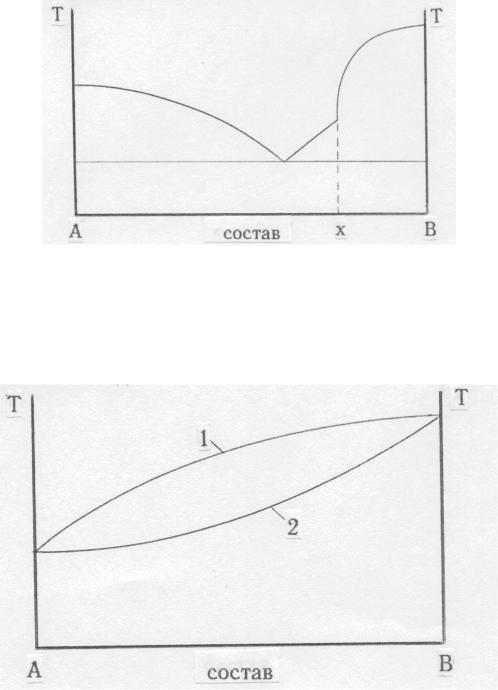
При образовании в системе неустойчивого химического соединения (плавящегося инконгруэнтно) на одном из ликвидусов появляется излом, положение которого отвечает составу этого соединения:
Если компоненты смеси не выделяются из расплава в виде самостоя-
тельной фазы, а образуют смешанные кристаллы неопределенного состава
(изоморфные смеси или твердые растворы), то диаграммы плавления та-
ких смесей принимают вид:
1-
2-
кривая затвердевания расплава
кривая плавления твердого раствора.
52
Индивидуальное задание студенту.
1.Получить у преподавателя данные о температурах начала кристаллиза-
ции двухкомпонентной системы.
2.Построить по этим данным диаграмму плавления бинарной системы.
Указать области, соответствующие жидкой, твердой и гетерогенной сис-
темам.
3.Вычертить все типы кривых охлаждения, возможных в данной системе.
4.Определить составы и температуры плавления эвтектических смесей и химических соединений.
5.Определить физическое состояние систем, содержащих а, б, в % вещест-
ва А при температуре Т1 (см. таблицу с исходными данными).
6.Показать, что произойдет с этими системами при изменении температуры до Т2.
7.Определить вариантность систем с содержанием компонента А: а) 95
мольн.% и б) 5 мольн.% при температуре Т1.
8.Определить вариантность системы в точке эвтектики и в любой точке,
указанной преподавателем.
9.Определить, при какой температуре начнет плавиться смесь, содержа-
щая а% вещества А, и при какой температуре она расплавится полно-
стью.
10.Показать результаты анализа диаграммы плавления преподавателю.
11.Сформулировать выводы.
53
Работа 2.2.
Построение диаграммы кипения бинарной смеси.
Цель работы: построение и анализ диаграммы кипения бинарной
смеси.
Целевые задачи: освоение принципа построения диаграмм кипения бинарной смеси; их анализ.
Диаграммы состояния, отражающие равновесие жидких и парооб-
разных фаз, называются диаграммами кипения. Наиболее удобной фор-
мой представления диаграмм кипения является их изображение в координатах температура–состав. Если смесь двух летучих жидкостей представляет собой раствор с небольшими отклонениями от закона Рауля,
еѐ диаграмма кипения будет иметь вид, изображенный на рисунке:
Диаграмма кипения. 1  область жидкости, 2
область жидкости, 2  область кипящей жидкости, находящейся в равновесии с паром, 3 область пара, 4 ликвидус, 5 линия пара.
область кипящей жидкости, находящейся в равновесии с паром, 3 область пара, 4 ликвидус, 5 линия пара.
54
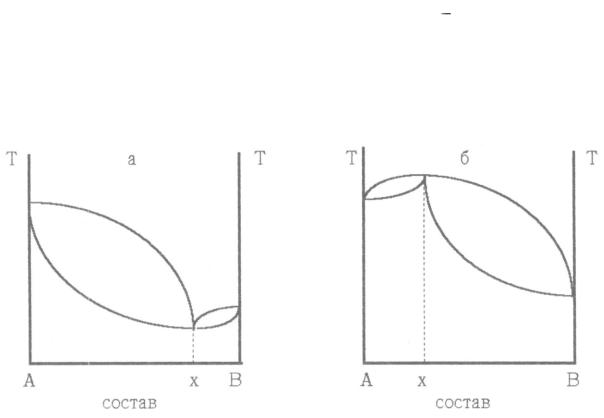
Каждая точка линии ликвидуса 4 отвечает температуре начала кипе-
ния при нагревании смеси с определенным составом (или полной конден-
сации пара при охлаждении). Точки линии 5 соответствуют окончанию кипения при полном переходе жидкости в пар ( или началу конденсации пара в жидкость при охлаждении). Область диаграммы над линией 5 отве-
чает парообразным (газообразным) системам, область под линией 4 – жид-
ким растворам. Фазовое поле между линиями 4 и 5 соответствует гетерогенным системам, в которых находятся в равновесии кипящая жид-
кость и пар.
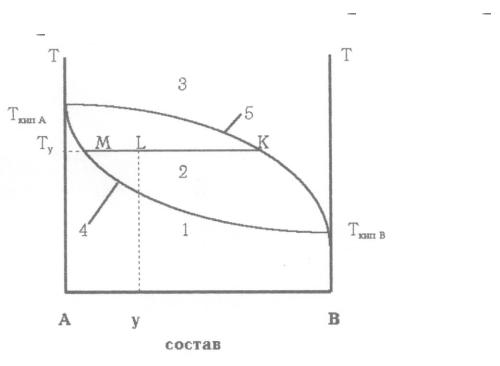
При значительных положительных отклонениях от закона Рау-
ля, когда общее давление пара над раствором превышает давление пара любого из чистых компонентов, и на диаграммах температура – состав по-
является минимум, две ветви ликвидуса сходятся в точке Х с линией пара.
При значительных отрицательных отклонениях от закона Рауля, когда об-
щее давление пара над раствором становится ниже давления пара любого из чистых компонентов, на диаграммах температура состав появляется максимум:
Диаграммы кипения:
а) положительное отклонение от закона Рауля (минимум температуры кипения)
б) отрицательное отклонение от закона Рауля (максимум температуры кипения)
55

Растворы, состав которых (х) отвечает этим экстремальным точкам,
называются азеотропными (нераздельно кипящими или азеотропами). Их состав не меняется при кипении, и температура остается постоянной до полного перехода жидкости в пар (или до полной конденсации пара в жид-
кость при охлаждении). Такие смеси, в отличие от остальных, нельзя раз-
делить перегонкой. Примером азеотропа с минимумом температуры кипения является смесь, содержащая 96% (по объѐму) этилового спирта и
4% воды, иначе называемая спиртом ректификатом.
Относительное количество жидкой и газообразной фаз для гетеро-
генной системы при температуре Тy можно рассчитать по правилу рычага
(см. соотв. рис.):
Масса жидкости |
KL |
|
= |
Масса пара |
KM |
Индивидуальное задание студенту.
1.Получить у преподавателя данные о зависимости температуры кипения от состава жидкой (Х) и газообразной (У) фаз бинарной смеси.
2.Построить по этим данным диаграмму кипения.
3.Определить температуру начала кипения системы, содержащей “а” мольн. % компонента А, и состав первого пузырька пара.
4.Определить температуру, при которой исчезнет последняя капля жидкости, и состав этой капли.
5.Определить состав пара, находящегося в равновесии с жидкой бинарной системой, кипящей при температуре Т1.
6.Определить состав и температуру кипения азеотропа.
7.Определить вариантность системы в азеотропной точке и в любой точке, указанной преподавателем.
8.Показать результаты анализа диаграммы кипения преподавателю.
9.Сформулировать выводы.
56

Работа 2.3.
Определение критической температуры растворения системы «фенол--вода».
Цель работы: Определение критической температуры растворения
(КТР) системы «фенол вода».
Целевые задачи: Овладение техникой термического анализа; по-
строение фазовой диаграммы системы «фенол вода»; графическое определение КТР; выяснение прикладных возможностей фазовых диаграмм.
Существуют жидкости с ограниченной взаимной растворимостью.
Она наблюдается в том случае, когда переход молекул через поверхность раздела сопряжѐн с совершением работы, заметно превышающей среднюю энергию движения молекул жидкостей при данных условиях. Увеличение температуры приводит к росту энергии поступательного движения моле-
кул, поэтому взаимная растворимость жидкостей при повышении темпера-
туры также увеличивается. При некоторой температуре, называемой
критической температурой растворения (КТР), растворимость стано-
вится неограниченной при любом соотношении компонентов.
Диаграмма состояния, отражающая растворимость жидкостей друг в друге при различных температурах, называется диаграммой растворения
(растворимости).
На рисунке показана типичная диаграмма растворимости с верхней
КТР.
57
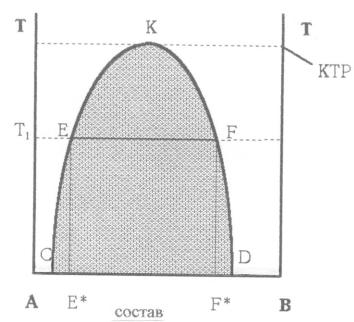
Кривая СКD - кривая растворения (расслоения). Точки, лежащие выше этой кривой, отвечают полной растворимости с образованием гомо-
генных систем; точки на кривой и ниже еѐ - ограниченной растворимости с образованием гетерогенных систем. Отрезки изотерм, соединяющие точки кривой расслоения, лежащие на еѐ разных ветвях при одной температуре
(например, Е и F при Т1), называются коннодами (нодами). Точки Е и F
соответствуют составам Е* и F* сопряжѐнных растворов (фаз), находя-
щихся в равновесии при данной температуре. При этом одна фаза пред-
ставляет собой насыщенный раствор А в В (с составом F*), а другая -
насыщенный раствор В в А (с составом Е*). Точка К, отвечающая макси-
муму кривой расслоения, лежит при температуре, равной КТР. При нагре-
вании смеси с составом Е* после достижения температуры Т1 произойдет
гомогенизация (полное взаимное растворение компонентов). При охлаж-
дении еѐ при этой же температуре произойдет гетерогенизация (разделе-
ние на две несмешивающиеся фазы).
Оснащение рабочего места.
Фенол кристаллический |
Вода дистиллированная |
Пробирка на 20 мл |
Ртутный термометр (до 100оС) |
Водяная баня |
Весы технические |
Разновес |
Пипетка на 1 мл |
58

Проведение опыта.
1.Проверить оснащение рабочего места.
2.Включить водяную баню. Нагреть воду до 70 - 80оС.
3.Взвесить чистую сухую пробирку с точностью до 0,01 г.
4.Поместить во взвешенную пробирку навеску фенола (0,48 - 0,52 г).
ВНИМАНИЕ: Остерегаться попадания фенола на руки и в глаза! В случае  попадания промыть пораженное место водой, кожу рук протереть рас-
попадания промыть пораженное место водой, кожу рук протереть рас-
твором спирта. После окончания работы раствор, содержащий фенол,
слить в специальный сосуд в вытяжном шкафу.
5.Взвесить пробирку с фенолом и по разности определить точную массу фенола.
6.Закрыть пробирку пробкой со вставленным в неѐ термометром.
ВНИМАНИЕ: Ртутный резервуар термометра должен находиться на рас- 
стоянии приблизительно 1 мм от дна пробирки.
7.Поместить нижнюю часть пробирки в горячую воду водяной бани, после расплавления фенола нагреть его до температуры около 50оС.
8.Вынув пробирку из водяной бани, дать фенолу охладиться до комнат-
ной температуры, записывая показания термометра с интервалом по 0,5
минуты. По полученным данным построить кривую охлаждения фенола в координатах температура  время. Определить по ней температуру плавления (отвердевания) фенола.
время. Определить по ней температуру плавления (отвердевания) фенола.
59

Примечание: Для большей наглядности рекомендуется использовать
следующий масштаб: по оси температур 1 см =1 градус,
а по оси времени 1 мм =1 мин.
9.Не вынимая полностью термометр из пробирки (во избежание потери массы) внести в неѐ пипеткой первую добавку дистиллированной воды
(см. табл.).
10.Поместить пробирку в горячую воду. После гомогенизации (взаимного растворения воды и фенола) вынуть еѐ из воды и охладить на воздухе до гетерогенизации (помутнения). Для равномерного охлаждения жидкости еѐ можно перемешивать термометром. Записать температуру, при которой произошла гетерогенизация, в таблицу экспериментальных данных.
11. Повторить операции, описанные в п.п. 9 10, поочередно со всеми до-
бавками воды. Сверить результаты у преподавателя и занести их в таб-
лицу.
12.Привести в порядок рабочее место и сдать его дежурному.
13.Заполнить таблицу, рассчитав все указанные в ней величины.
№ |
Масса |
Объѐм до- |
Общая |
Содержание |
Содержание |
Температура |
№ |
фенола, |
бавленной |
масса |
фенола |
воды |
гетеро- |
п.п. |
г |
воды, мл |
смеси, |
в смеси, |
в смеси, |
генизации, |
|
|
|
г |
% |
% |
оС |
1 |
|
0,25 |
|
|
|
|
2 |
|
0,05 |
|
|
|
|
3 |
|
0,05 |
|
|
|
|
4 |
|
0,05 |
|
|
|
|
5 |
|
0,1 |
|
|
|
|
6 |
|
0,1 |
|
|
|
|
7 |
|
0,1 |
|
|
|
|
8 |
|
0,1 |
|
|
|
|
9 |
|
0,2 |
|
|
|
|
10 |
|
0,5 |
|
|
|
|
11 |
|
0,5 |
|
|
|
|
12 |
|
0,5 |
|
|
|
|
13 |
|
0,5 |
|
|
|
|
14 |
|
1,0 |
|
|
|
|
15 |
|
1,0 |
|
|
|
|
14. Построить по данным о температуре гетерогенизации диаграмму растворения (см. рисунок внизу), проведя плавную усредняющую линию
60
