
- •2. Эквивалент. Закон эквивалентов уровень в
- •1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. Кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
- •2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.У. Рассчитать молярные массы эквивалентов оксида и металла.
- •1Моль а – 2 моль в
- •0,1 Моль а – х моль в
- •7. Растворы сильных и слабых электролитов. Произведение растворимости.
- •Уровень в
- •1. Вычислить рН следующих водных растворов:
- •2. Вычислить рН 0,05 м водного раствора хлорноватистой кислоты (hoCl).
- •9. Окислительно-восстановительные реакции уровень в
- •Решение
- •Решение
- •Решение
- •11. Электролиз растворов уровень в
- •1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия.
- •3. Способы выражения состава растворов уровень а
- •4. Энергетика химических реакций уровень а
- •1. Указать, какие из приведенных реакций являются эндотермическими:
- •Решение
- •2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение:
- •3. Написать полное молекулярное уравнение по данному сокращенному ионно-молекулярному уравнению:
3. Способы выражения состава растворов уровень а
Записать выражение массовой доли растворенного вещества. Указать единицу измерения.
Ответ:
![]() ,
%.
,
%.
Записать выражение молярной доли растворенного вещества.
Ответ:
![]() .
.
Записать выражение молярной концентрации вещества. Указать единицу измерения.
Ответ:
св
=
![]() ,
моль/л.
,
моль/л.
Записать выражение молярной концентрации эквивалентов вещества. Указать единицу измерения.
Ответ:
сэк(в)
=
![]() ,
моль/л.
,
моль/л.
Записать выражение моляльности вещества в растворе. Указать единицу измерения.
сm(в)
=
![]() ,
моль/кг.
,
моль/кг.
Записать выражение титра раствора вещества. Указать единицу измерения.
Ответ:
Tв
=
![]() ,
г/см3.
,
г/см3.
4. Энергетика химических реакций уровень а
1. Указать, какие из приведенных реакций являются эндотермическими:
а) Mn(к) + 1/2O2(г) = MnO(к);
б) 1/2N2(г) + 3/2H2(г) = NH3(г);
в) 1/2N2(г) + 1/2O2(г) = NO(г).
Решение
Так как данные реакции являются реакциями образования 1 моль сложного вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования этих веществ. Для определения теплового эффекта (изменения энтальпии) реакции из таблицы выписываем значения стандартных энтальпий образования: MnO(к)), NH3(г), NO(г):
ΔfHо (298 К, MnO(к)) = –384,93 кДж/моль;
ΔfHо(298 К, NH3(г)) = –46,2 кДж/моль;
ΔfHо = (298 К, NO(г)) = 90,3 кДж/моль.
Реакции а, б имеют отрицательные значения изменения энтальпии, а реакция в – положительное значение изменения энтальпии. Эндотермическими являются те реакции, изменения энтальпии которых имеют положительные значения.
Ответ: в).
2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение:
а) CO(г) + H2(г) = C(к) + H2O(г);
б) 2Cu(NO3)2(к) = 2CuO(к) + 4NO2(г) + O2(г);
в) 2PbS(к) + 3O2(г) = 2PbO(к) + 2SO2(г).
Решение
Так как наибольшее значение стандартной энтропии имеют вещества, находящиеся в газообразном состоянии, то энтропия увеличивается, если в ходе реакции возрастает число газовых моль (реакция б)). При протекании реакций а и в наблюдается уменьшение числа газовых моль системы. Следовательно, изменение энтропии данных реакций имеет отриательное значение.
Ответ: б).
3. Написать формулу для расчета стандартной энтальпии растворения вещества. Указать единицы измерения.
Ответ:
ΔраствН°(298К)
=
![]() =
=![]() ,
кДж/моль.
,
кДж/моль.
5. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ А
Написать формулу связи Кр с термодинамическими функциями.
Ответ: ∆rGº(298 K) = ∆rHº(298 K) – T∆rSº(298 K) = –2,3 RT lg Kp .
2. Написать формулу зависимости скорости реакции от температуры и Еакт.
Ответ:
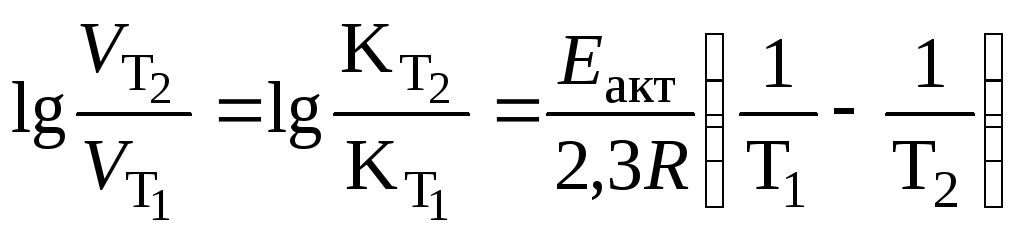 .
.
3. Написать формулу зависимости скорости реакции от присутствия в системе катализатора.
Ответ:
![]() .
.
Указать реакцию среды водных растворов солей K2SO3, ZnCl2, Cr(NO3)3, KNO3.
Ответ:
K2SO3
KOH + H2SO3
сильн. слаб.
Реакция среды определяется сильным электролитом, участвующим в образовании соли. Сульфит калия образован слабой кислотой и сильным основанием, поэтому реакция среды щелочная, рН > 7.
ZnCl2 Cr(NO3)3
Zn(OH)2 + HCl Cr(OH)3 + HNO3
слаб. сильн. слаб. сильн.
Хлорид цинка и нитрат хрома (III) образованы сильной кислотой и слабым основанием, поэтому реакция среды кислая, pH < 7.
КNO3
КOH + HNO3
сильн. сильн
Нитрат калия образован сильным основанием и сильной кислотой, гидролизу не подвергается, поэтому реакция среды – нейтральная, рН = 7.
