
2.
2.1 Количественно зависимость скорости гомогенных реакций от температуры может быть выражена установленным опытным путем в приближенной форме правилом Вант - Гоффа: при повышении температуры на каждые 10оС скорость гомогенной химической реакции увеличивается в 2-4 раза.
Математически правило Ван-Гоффа, может быть выражено следующим образом:
Vt2 = Vt1 · γ( t2-t1 ) / 10
если температура повышается от t1 до t2, то скорость реакции при температуре t2 ( Vt2) выразится через скорость при температуре t1 ( Vt1),
где γ – температурный коэффициент скорости реакции ( изменяется обычно от 2 до 4 ) – это число, показывающее во сколько именно раз увеличивается скорость химической реакции при повышении температуры на 100С ( это отношение константы скорости при температуре t + 10 к константе при температуре t).
γ = k t+10 / k t..
Для большинства биохимических реакций температурный коэффициент Вант-Гоффа варьирует от 1,5 3,0. Поэтому, если в результате какого-либо заболевания температура человеческого тела поднялась, например, с 36,50 до 39,50С, это значит увеличение скорости происходящих биохимических процессов в 1,13 – 1,39 раз, т.е. на 13-39%.
2.2 Шведский ученый Аррениус предложил уравнение, выражающее более точно зависимость скорости реакции от температуры:
![]() ,
,
где К – константа скорости реакции ;
А – предэкспоненциальный множитель, зависящий от числа столкновений молекул за единицу времени;
е - основание натуральных логарифмов (е = 2,72 );
Еа – энергия активации;
R - универсальная газовая постоянная;
Т - абсолютная температура.
В логарифмической форме
ln k = ln A – Eа/RT
Если известны константы скорости kT1 и kT2 при двух температурах Т1 и Т2 можно найти значение Еа из уравнения Аррениуса в логарифмической форме:
ln kT1 = lnA – Eа/RT1 (1)
ln kT2 = lnA - Eа/RT2 (2)
Из уравнения 2 вычитаем уравнение 1:
ln kT2 – ln kT1 = -Eа/RT2 + Eа/RT1
ln kT2/kT1 = Eа/R(1/T1 - 1/T2)
Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры
4) Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями.
Равновесие химическое, состояние системы, в которой обратимо протекает одна или несколько реакций химических,причём для каждой из них скорости прямой и обратной реакций равны, вследствие чего состав системы остаётся постоянным, пока сохраняются условия её существования.
Константа равновесия.
mA+nB=pC+qD
Kc=Kпр/Kобр=[C]p[D]q/[A]m[B]n где =[C], [D], [A], [B] – равновесные концентрации реагирующих вещ-ств, Kпр, Kобр – константы скоростей прямой и обратной реакции. свойства: 1) если температура повышается то происходит сдвиг равновесия в ту сторону, которая идет с поглощением теплоты(эндотерм. реакция), а понижение температуры ведет к сдвигу в ту сторону, которая протекает с выделением теплоты(экзотермич. реакция)
2) при повышении температуры сдвиг равновесия влево, при понижении в правую сторону.
3)при повышении давления, равновесие смещается вправо.
5)Принцип Ле-Шаталье
Если на систему, находящуюся в равновесии, оказывается внешенее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
7) Законы Рауля и Вант-Гоффа для растворов неэлектролитов:
Закон Рауля: P(A)=p0(A)*χ(A) (парциальное давление насыщенного пара над раствором прямо пропорционально его молярной доле)
Закон Вант-Гоффа: πV=nRT; π – осмотическое давление.
8) Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты:
Теория эл-ской диссоциации: 1) все электролиты в воде распадаются на ионы; 2) ионы отличаются от атомов по строению и свойствам; 3) движение ионов в водном растворе – хаотическое, но при внешних электрических/магнитных полях движение – целенаправленное; 4) диссоциация слабых электролитов – есть процесс равновесный.
Степень: α=n/N; n - число продиссоциировавших молекул; N – общее число молекул.
Константа: AxBy xA+yB Kд = ([A]^x *[B]^y)/[AxBy]; Кд=α^2 *Cв
Сильные и слабые электролиты: 1) Сильные: кислоты(H2SO4, HNO3), основания (LiOH, KOH, Ca(OH)2 и т.д.), соли (хорошо растворимые. NaCl, K2SO4); 2) Слабые: кислоты (H2SO3, H2S, H2CO3), основания (Zn(OH)2, Ni(OH)2), соли (ПР), H2O.
9) Активность ионов. Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов:
Активность – эффективная концентрация, зависящая от концентрации раствора, количества других ионов и их заряда. а=f*C(иона)
Кажущаяся степень диссоциации – реальная степень диссоциации, определяемая по электропроводности раствора.
Изотонический коэффициент (i): i=α(K-1)+1; i=число частиц в р-ре/общее число молекул электролита.
Законы Рауля и Вант-Гоффа для электролитов: Законы Рауля не выполняются для растворов, которые проводят электрический ток — электролитов. Для учёта этих отклонений Вант-Гофф внёс поправку — изотонический коэффициент i, учитывающий диссоциацию молекул растворённого вещества, p=p0+Xр-ля=p0*(n(р-ля)/n(р-ля)+i*n(в-ва).
10. Ионное произведение воды
Вода является очень слабым электролитом: лишь незначительная часть молекул воды диссоциирует на ионы:
H2O ↔ H+ + OH¯
Экспериментально установлено, что произведение концентраций ионов H+ и OH¯ в воде и разбавленных водных растворах электролитов является величиной постоянной и называется ионным произведением воды (Kw)
Kw = [H+] + [OH¯] = 10-14,
[H+] = [OH¯] = 10-7 моль/л
Для удобства условились выражать кислотность раствора как отрицательный логарифм концентрации водородных ионов. Эту величину называют водородным показателем и обозначают pH.
pH = -lg[H+]
Аналогично, отрицательный логарифм концентрации гидроксильных ионов обозначают pOH, однако, пользуются этим показателем значительно реже.
pH + pOH = 14
В зависимости от соотношения концентраций ионов H+ и OH¯ различают три вида реакции среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л; pH<pOH; pH< 7;
нейтральная среда: [H+] = [OH¯] = 10-7 моль/л; pH = pOH = 7;
щелочная среда: [H+] < [OH¯]; [H+] < 10-7 моль/л; pH>pOH; pH>7;
Таким образом, значения pH всех водных растворов электролитов укладывается в шкалу pH от 0 до 14.
Произведение растворимости
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При
постоянной температуре в насыщенных
водных растворах малорастворимых
электролитов устанавливается равновесие
между твердым веществом и ионами,
образующими это вещество. Например, в
случае для CaCO3 это равновесие можно
записать в виде:![]()
Константа
этого равновесия рассчитывается по
уравнению: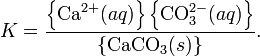
В
приближении идеального раствора с
учётом того, что активность чистого
компонента равна единице, уравнение
упрощается до выражения:![]()
Константа равновесия такого процесса называется произведением растворимости.
В
общем виде, произведение растворимости
для вещества с формулой AmBn, которое
диссоциирует на m ионов An+ и n ионов Bm-,
рассчитывается по уравнению:![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное
уравнение не учитывает коэффициенты
активности, то есть степень влияния
ионных сил. Для растворов с концентрациями
большими, чем 1·10−4 моль/л необходимо
использовать произведение активностей:![]()
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение
растворимости связано с растворимостью
следующим соотношением:![]()
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Ионные реакции
Ионные реакции — реакции между ионами в растворе. Например, реакцию
AgNO3 + NaCl = NaNO3 + AgCl
можно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgClнерастворим в воде и на ионы не расписывается:
Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−
Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение
Ag+ + Cl− = AgCl
и есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
Ионные реакции в органической химии
Органические катионы и анионы — неустойчивые промежуточные частицы. В отличие от неорганических ионов, постоянно присутствующих в водных растворах и расплавах, они возникают только в момент реакции и сразу же вступают в дальнейшие превращения.
Условия реакций органических веществ имеющих ионную природу:
невысокая температура;
полярные растворители, способные к сольватации образующихся ионов.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные.
Действие света или радиоактивного излучения не влияет на скорость реакций органических веществ имеющих ионную природу.
