
stennikova1
.pdf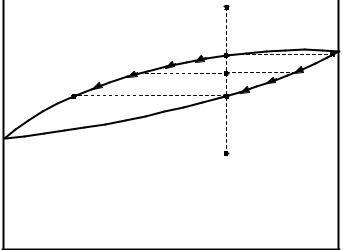
жидкий раствор |
|
1 |
|
|
|
|
|
3'' |
|
2 |
ТВ0 |
|
3 |
2' |
|
4'' |
тв |
ж |
3' |
|
|
4 |
|
Т0 |
|
|
|
А |
|
5 |
|
|
|
|
|
твердый раствор (α) |
|
|
|
А |
|
|
В |
Рисунок 2.10 – Диаграмма состояния с образованием непрерывного ряда твердых растворов
Верхняя кривая - линия ликвидуса, отображает в любой точке состав жидкого раствора. Нижняя линия – линия солидуса, отвечает за состав твердого раствора (α). Области выше линии ликвидуса и ниже линии солидуса – однофазные. Область между этими линиями – область двухфазного равновесия жидкости и кристаллов α. При охлаждении сплава 1, достигнув температуры, отвечающей точке 2, начинается кристаллизация α – твердого раствора состава 2I . По мере охлаждения системы количество твердой фазы увеличивается, а жидкой - уменьшается. Так, в точке 3 количество твердой фазы отвечает участку конноды 3II – 3, а количество жидкой фазы участку 3I -3. Затвердевание заканчивается в точке 4, где имеются последние капли жидкости. Процесс кристаллизации сопровождается изменением состава как жидкости по линии ликвидуса (от точки 2 к точке 4II), так и твердого раствора (от точки 2I до точки 4).
Следует учесть, что говоря о равновесии жидкости и твердой фазы при той или иной температуре, мы имеем в виду средний состав как всей выпавшей к этому моменту твердой фазы, так и оставшейся жидкости. В твердом состоянии кристаллы не будут однородны по составу: центральные области кристаллических зерен, закристаллизовавшиеся раньше, будут обогащены более тугоплавким компонентом, В. Однородность достигается за счет протекающей диффузии в твердом состоянии, которая происходит медленно.
Твердые растворы могут давать смеси, в которых состав жидкой и твердой фаз одинаков. Это отражается на диаграмме в виде экстремумов – минимума или, реже, максимума (рисунок 2.11).
71

|
жидкий раствор |
|
Т0 |
|
В |
Т0 |
|
А |
|
|
твердый раствор (α) |
А |
В |
Рисунок 2.11 - Диаграмма с образованием минимума на кривых |
|||
ликвидуса и солидуса при образовании твердых растворов |
|||
2.8.2 Диаграмма состояния с ограниченной растворимостью в |
|||
твердом виде |
|
|
|
Весьма часто компоненты, взаимно неограниченно растворимые в |
|||
жидкой фазе, обладают ограниченной растворимостью в твердом состоянии. |
|||
При этом возможны два типа соотношений между составами жидкой фазы и |
|||
выделяющегося из нее твердого раствора и два типа диаграмм. |
|||
1) Диаграммы с эвтектическим превращением |
|||
Т0 |
|
|
|
А |
|
1 |
жидк. |
|
2' |
||
|
2 |
|
|
|
|
|
|
|
|
|
Т0 |
|
|
|
В |
|
α |
3 |
e |
|
n |
||
|
m |
||
|
|
||
|
|
|
β |
|
|
4 |
|
|
|
α + Э(α+β) |
β + Э(α+β) |
А |
|
a |
b В |
Рисунок – 2.12 – Диаграмма состояния системы с ограниченной |
|||
растворимостью в твердом виде при наличии эвтектического превращения |
|||
(характерна для систем: Cu – Ag; Zn – Cd; KNO3 - NaNO3) |
|||
72
Область АТ0Аma отвечает однородному твердому раствору В в А (α – твердый раствор). Линия Т0Ае – линия кристаллизации α – твердых растворов. Линия ma – линия предельной растворимости В в А (α – насыщенный твердый раствор) в зависимости от температуры. Линия Т0Аm – линия состава α – ненасыщенного твердого раствора.
Аналогично область Т0ВВbn – область растворов А в В (β – твердый раствор). Линия Т0Ве – начало кристаллизации β – твердого раствора. Т0Вn – линия состава ненасыщенных β – твердых растворов; nb – насыщенных β – твердых растворов.
Проведем охлаждение раствора 1. При понижении температуры в точке 2 жидкий раствор становится насыщенным и начинает кристаллизоваться α – ненасыщенный твердый раствор состава 2I. По мере охлаждения от точки 2 до точки 3 количество твердого раствора увеличивается, а его состав меняется от точки 2I до точки «m» и достигает предела растворимости В в А в точке «m». При этом состав жидкой фазы меняется по линии ликвидуса от точки 2 до «е». Раствор состава «е» является насыщенным по отношению к α - и β – твердым растворам (точка «е» принадлежит как линии Т0Ае так и линии Т0Ве), следовательно, из него кристаллизуются одновременно оба твердых раствора, т.е. эвтектика (α + β). Состав α и β в эвтектике отвечает точкам «m» и «n» соответственно.
При дальнейшем охлаждении системы растворимость А в В и В в А уменьшается и идет по линиям mа и nb, показывающим состав твердых растворов α и β (насыщенных).
В этой системе температура кристаллизации растворов всегда ниже температуры кристаллизации чистого компонента, который принимается за растворитель и чей тип кристаллической решетки сохраняется при образовании твердого раствора. Так, α – твердый раствор – это раствор В в А и тип кристаллической решетки вещества А сохраняется. Для β – твердого раствора растворителем является компонент В и его тип кристаллической решетки сохраняется при растворении в нем компонента А.; Тβ < Т0В.
Жидкая фаза любого состава в диаграммах этого типа содержит больше растворенного вещества, чем твердая фаза, т.е. СВжидк. > СαВ и САжидк. > СβА.
2) Диаграмма с перитектическим превращением
В этом случае образуются твердые растворы, содержащие больше растворенного вещества, чем жидкие растворы, из которых они кристаллизуются. При этом температура начала кристаллизации таких твердых растворов выше температуры кристаллизации вещества, на основе кристаллической решетки которого образуется твердый раствор (можно
назвать его растворителем). Это раствор α на рисунке 2.13.
СαВ. > СВжидк Тα > Т0А
73
|
|
|
|
|
|
Т0 |
|
|
жидк. |
|
|
|
В |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
d |
2 |
с |
f |
|
|
m |
|
|
|
||
|
n |
|
|
|
||
ТА0 |
|
|
|
β |
||
|
3 |
|
4 |
|||
|
|
|
||||
|
|
α |
|
|
|
|
А |
|
a |
|
|
b |
В |
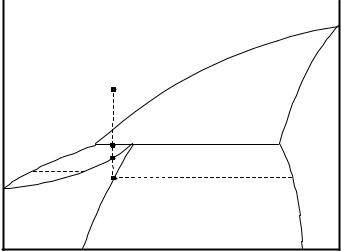
Рисунок 2.13 - Диаграмма состояния системы с ограниченной растворимостью в твердом виде при наличии перитектического превращения (характерна для систем: Cu – Co; AgNO3 - NaNO3)
Линии ликвидуса Т0Аd и Т0Вd – линии кристаллизации ненасыщенных растворов α и β соответственно. Кристаллы β в этой диаграмме и β в предыдущей – принципиально ничем не отличаются друг от друга: это твердый раствор А в В, где жидкость содержит больше растворенного вещества (А) по сравнению с твердой фазой.
Твердый раствор α (В в А) содержит больше растворенного вещества
(В), чем жидкость. Например, для равновесных жидкого раствора «m» и α – твердого раствора «n» СαВ. > СВжидк.
Линия df – перитектическая, здесь происходит кристаллизация α – твердого раствора состава «с» и растворение ранее выпавших кристаллов
«β».
Перитектический процесс для систем, попадающих на линию «сf» заканчивается образованием α – твердого раствора и растворением части ранее выпавших β – кристаллов, а избыток β – кристаллов остается.
В области асfb – две фазы: αкр + βкр.
Если же система 1 попадает на участок «dc» - то кристаллы β все растворяются, а в избытке будет жидкая фаза и при дальнейшем ее охлаждении образуются кристаллы α – твердого ненасыщенного раствора (до точки 2). При охлаждении системы от точки 2 до точки 3 система становится однофазной и не меняет своего состава. В точке 3 твердый раствор α становится насыщенным и появляется новая твердая фаза β состава 4. При дальнейшем охлаждении увеличивается количество β – кристаллов, изменяется состав α – кристаллов по линии 3а и β – кристаллов по линии 4b.
74
2.8.3 Примеры анализа диаграмм
Проанализировать диаграмму, используя нижеприведенный план.
План анализа диаграммы двухкомпонентной системы
1.Найти химические соединения, обозначить их, определить состав: а) устойчивые; б) неустойчивые.
2.Найти твердые растворы, обозначить области их существования: а) с неограниченной растворимостью; б) с ограниченной растворимостью.
Определить, кристаллическая решетка какого компонента сохранена.
3.Определить и подписать участки линии ликвидуса, где кристаллизуются соединения и твердые растворы.
4.Определить фазы в областях, прилегающих к этим участкам линии ликвидуса.
5.Определить наличие эвтектик. Их состав: качественный (что совместно кристаллизуется) и количественный (% А и % В).
6.Определить перитектические превращения, перитектическую линию. Что кристаллизуется и что растворяется?
7.Определить монотектические превращения.
8.Определить фазы во всех других областях.
9.Для любой точки на диаграмме определить: число фаз; состав фаз;
относительное количество фаз; число степеней свободы.
10.Для раствора любого состава провести охлаждение и уметь изобразить кривую охлаждения.
0 |
|
|
C' |
|
|
|
|
t |
γ |
F' |
|
|
1 |
В |
|
ТВ0 |
ТА |
α |
β |
|
|
|
|
|
y u |
F |
|
x |
2 |
VIII |
p |
||
|
|
C |
E |
E' VI |
G |
3 |
||||||||||
|
n I |
II |
|
|
IV |
|
|
VII |
IX |
|
|
|
||||
|
m |
|
r |
q |
g |
|
s |
|
|
|||||||
|
III |
D |
e3 |
4 |
|
|
||||||||||
|
α |
e |
β |
|
|
V |
|
|
|
|
|
|
|
|
||
|
1 |
|
|
|
|
|
|
|
|
|
|
X |
|
|||
|
|
|
k |
|
e2 |
d |
|
γ |
|
|
|
5 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
XI |
XII |
|
XIII |
XIV |
XV |
|
|
XVI |
|
XVII |
|
|
|
||
|
А a |
|
b C |
|
|
D |
|
E |
|
F |
|
|
|
G |
В |
|
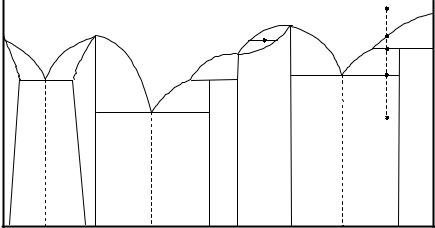
1.В данной системе есть три устойчивых соединения (С, Е, F) и два
неустойчивых (Д, G). Устойчивым отвечают конгруэнтные точки их плавления (СI, ЕI, FI), а неустойчивым – линии разложения соединений при их нагревании (rq и хр). Состав соединений определяется по оси состава (% А и % В).
2.Есть три области существования твердых растворов:
75

1)с неограниченной растворимостью друг в друге веществ Е и F (γ – твердый раствор). Кристаллическая решетка обоих соединений одинакова, эту же решетку имеет и γ –раствор.
2)два твердых раствора с ограниченной растворимостью – α – твердый раствор с сохранением кристаллической решетки А и β – твердый
раствор с сохранением решетки С.
3.На диаграмме подписаны участки линии ликвидуса и что начинает кристаллизоваться на них.
4.В областях, прилегающих к этим участкам линии ликвидуса, существует в равновесии две фазы: твердая (смотри пункт 3) и жидкая, отвечающая линии ликвидуса.
5.В системе есть три эвтектики: е1, е2 и е3. Качественный состав (что
совместно кристаллизуется) определяется точками на концах эвтектической линии:
е1 : линия mn; совместно кристаллизуются твердые насыщенные растворы α (состав «n») и β (состава «m»);
е2 : линия кd; кристаллизуются соединения «С» и «Д». е3 : линия gs; кристаллизуются соединения F и G.
Состав эвтектик (% А и % В) определяется проецированием точек е1, е2 и е3 на ось состава.
6. Перитектические превращения происходят при охлаждении растворов на перитектических линиях rq и xp.
На линии rq кристаллизуется неустойчивое «Д», что приводит к растворению ранее выпавших (в области IV) кристаллов Е.
На линии xp кристаллизуется неустойчивое соединение «G», что вызывает растворение ранее выпавших (в области VIII) кристаллов В.
7.Монотектических превращений нет.
8.В областях ниже эвтектических линий находятся по две твердые фазы: ниже линии mn – α и β твердые растворы; кd – твердые С и Д; gs – соединения F и G. Эти фазы могут быть либо в чистом виде, либо входить в состав эвтектики.
Так в области XI – α + Э (α + β) XII - β+ Э (α + β)
XIII – С + Э (С + Д)
XIV – Д + Э (С + Д)
В области XV две твердые фазы Д и Е, в области Х – две твердые фазы G и В.
9. Для точки «у» в области VI: число фаз – две (твердый раствор γ состава «u» и жидкий раствор состава «t»). Проецируя точки «u» и «t» на ось состава, находим % А и % В в этих фазах.
Относительное количество фаз определяется по конноде «tu», которая берется за 100 %:
mтв = ty mж yu
76
Число степеней свободы рассчитывается по правилу фаз Гиббса: С= К-f+n
=2-2+1=1. Система моновариантна.
10.Проведем охлаждение раствора 1.
От точки 1 до 2 идет охлаждение жидкой системы без фазовых превращений.
От 2 до 3 – кристаллизуется В, при этом состав жидкости меняется от точки 2 до х. В точке 3 - перитектическое превращение: образование G и растворение В; состав жидкой фазы не меняется (точка х). По окончании процесса остается в избытке жидкая фаза.
От точки 3 до 4 – кристаллизуется G, состав жидкой фазы изменяется от точки х до е3.
В точке 4 – эвтектический процесс, совместная кристаллизация F и G. Ниже точки 4 – охлаждение системы (F + G) без фазовых превращений. На любой диаграмме двухкомпонентных систем горизонтальные линии
отвечают равновесию трех фаз (одна жидкая и две твердые); такие системы инвариантны (С = 0). На кривых охлаждения это отразится в виде горизонтальных участков (Т = const). На рассмотренной диаграмме таких пять линий: mn, rq, gs, sp, kd.
2.8.4 Вопросы для самоконтроля
1.В чем суть физико-химического анализа?
2.На чем основан термический анализ?
3.Типы кривых охлаждения.
4.Что изображает линия ликвидуса? В каких координатах построена?
5.Объяснить суть принципов непрерывности и соответствия.
6.В чем различие понятий «эвтектическая точка», «эвтектическая температура», «эвтектика»?
7.В чем суть перитектического превращения?
8.Типы твердых растворов.
9.Сколько и каких фаз на линии монотектического превращения?
10.Какой геометрический образ на диаграммах: с образованием устойчивого химического соединения; с образованием неустойчивого химического соединения; с образованием эвтектики?
77
Литература
1Стромберг, А. Г. Физическая химия [Текст] / А. Г. Стромберг, Д. П. Семченко. - М. : Высшая школа, 2006. - 527 с.
2Киреев, В. А. Краткий курс физической химии [Текст] / В. А. Киреев.
-М. : Химия, 1995. - 676 с.
3Физическая химия [Текст] в 2 кн. / под ред. К. С. Краснова. - М.:
Высшая школа, 2001. - Кн.1. - 512 с., Кн.2. - 319 с.
4Карапетьянц, М. Х. Химическая термодинамика [Текст] / М. К. Карапетьянц. - М. : Химия, 1975. - 583 с.
5Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. – М.: Изд-во Иван Федоров, 2009. - 232 с.
6Рекомендации и номенклатурные правила ИЮПАК по химии: книгасправочник / сост. Б. Ф. Мясоедов, Ю. А. Золотов, В. М. Иванов [и др.] [Текст]. - М. : Наука, 2004. - 158 с.
7Методические указания по унификации определений, понятий, терминов, обозначений в неорганической, физической, коллоидной и аналитической химии. Химическая термодинамика [Текст] . - М. : МХТИ им. Д. И. Менделеева, 1983. - 48 с.
78
