
Теоретическая часть 2
1) Энтальпия, такжетепловая функцияитеплосодержание—термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменныхдавления,энтропиии числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня площадьюS с грузом весом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
![]()
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергиии другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. являетсяфункцией состояния.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими.
2)
Энтальпия — величина
аддитивная(экстенсивная), т. е.
для сложной системы равна сумме энтальпий
её независимых частей![]() .
Подобно другим термодинамическим
потенциалам, энтальпия определяется с
точностью до постоянного слагаемого,
которому в термодинамике часто придают
произвольные значения (например, при
расчете и построении тепловых диаграмм).
При наличии немеханических сил величина
энтальпии системы равна
.
Подобно другим термодинамическим
потенциалам, энтальпия определяется с
точностью до постоянного слагаемого,
которому в термодинамике часто придают
произвольные значения (например, при
расчете и построении тепловых диаграмм).
При наличии немеханических сил величина
энтальпии системы равна
![]()
где
![]() — обобщённая сила;
— обобщённая сила;![]() —обобщённая
координата.
—обобщённая
координата.
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкостивеществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):

Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
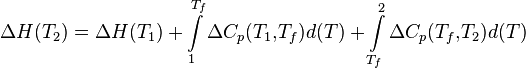
где ΔCp(T1,Tf) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; ΔCp(Tf,T2) — изменение теплоемкости в интервале температур от температуры фазового перехода до конечной температуры, и Tf — температура фазового перехода.
3) Энтальпия идеального газане зависит от давления.Энтальпия идеального газазависит только от его абсолютной температуры.
Энтальпия идеального газа зависит только от его абсолютной температуры и пропорциональна массе газа.
Для энтальпии идеального газа, подчиняющегося уравнению Pv=RT, будет выполняться равенство
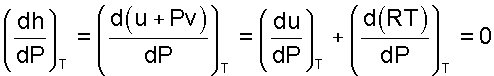
|
|
т.е. энтальпия идеальных газов не зависит от давления, а уравнение для идеальных газов примет вид
![]()
Поскольку изобарная теплоемкость идеальных газов величиа постоянная, то энтальпия идеальных газов есть функция только температуры. В свою очередь, для изобарной теплоемкости идеального газа не зависимо от процесса справедливо выражение

Для идеального газа начало отсчета энтальпии и внутренней энергии фиксируется только температурой.
4) Тепловой процесс(термодинамический процесс) — изменение макроскопического состояния термодинамической системы.
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесныеинеравновесные. Равновесным называется процесс, при котором все состояния, через которые проходит система, являютсяравновесными состояниями.
Тепловые процессы можно разделить на обратимыеинеобратимые. Обратимым называется процесс, который можно провести в противоположном направлении через все те же самые промежуточные состояния.
Можно выделить несколько простых, но широко распространённых на практике, тепловых процессов:
Адиабатный процесс— без теплообмена с окр. средой;
Изохорный процесс— происходящий при постоянном объёме;
Изобарный процесс— происходящий при постоянном давлении;
Изотермический процесс— происходящий при постоянной температуре;
Изоэнтропийный процесс— происходящий при постоянной энтропии;
Изоэнтальпийный процесс— происходящий при постоянной энтальпии;
Политропный процесс— происходящий при постоянной теплоёмкости;
