
- •1.2. Атомная, молекулярная и молярная масса
- •1.3 Основные газовые законы в химии
- •1.5. Эквиваленты и закон эквивалентов
- •1.6. Основные классы неорганических веществ.
- •151. Получение оксидов металлов
- •152.Получение оксидов неметаллов
- •1.7. Типы химических реакций. Составление уравнений реакций.
- •1.8 Стехиометрические расчеты
- •2.3. Химическая кинетика.
- •3.3.4. Теория гибридизации и оэпво
- •3.4. Межмолекулярное взаимодействие. Агрегатное состояние вещества.
3.4. Межмолекулярное взаимодействие. Агрегатное состояние вещества.
471.Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O,F,N,Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей. Образование водородных связей возможно междуHF.
472. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O,F,N,Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Чем более электроотрицательный атом связан с водородом, тем сильнее водородная связь, поэтому наибольшая энергия водородных связей междуHF, а наименьшая междуNH3.
473.Аномально высокая температура кипения плавиковой кислоты объясняется наличием между ее молекулами водородных связей. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O,F,N,Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей.
474.Аномально высокая растворимость в воде плавиковой кислоты по сравнению с соляной кислотой объясняется наличием между молекуламиHFводородных связей. Молекулы воды также притянуты друг к другу водородными связями. МеждуHFиH2Oвозможно сильное межмолекулярное взаимодействие, а между водой иHClмежмолекулярное взаимодействие гораздо слабее. В результате растворимость фтороводорода выше.
475.Аномально высокая растворимость в воде аммиака по сравнению с фосфином объясняется наличием между молекуламиNH3водородных связей. Молекулы воды также притянуты друг к другу водородными связями. МеждуNH3иH2Oвозможно сильное межмолекулярное взаимодействие, а между водой иPH3межмолекулярное взаимодействие гораздо слабее. В результате растворимость аммиака выше.
476. Аномально высокая растворимость в воде серной кислоты по сравнению с соляной кислотой объясняется наличием между молекуламиH2SO4водородных связей. Молекулы воды также притянуты друг к другу водородными связями. МеждуH2SO4иH2Oвозможно сильное межмолекулярное взаимодействие, а между водой иHClмежмолекулярное взаимодействие гораздо слабее. В результате растворимость серной кислоты выше соляной.
477.Природа водородных связей электростатическая, а при образовании ковалентной связи взаимодействие настолько сильное, что электронные оболочки атомов перекрываются, поэтому длина ковалентной связи во много раз меньше водородной. ДимерH2F2представляет собой две молекулы плавиковой кислоты притянутые друг к другу водородной связью. Н-F---F-H. Водородная связьHFгораздо длиннее ковалентных связейHF.
478. С увеличением молекулярной массы температура кипения однотипных веществ увеличивается. Однако, в предложенном ряду температура кипения воды имеет аномально высокое значение из-за наличия между молекулами Н2О водородных связей. Дополнительное связывание между молекулами приводит к увеличению температуры кипения воды, поэтому ее температура кипения не укладывается в типичную закономерность.
479.Водородные связи между молекулами воды имеют крайне важное значение, поскольку, благодаря этому дополнительному взаимодействию, вода при н.у. жидкая, обладает упорядоченностью ближнего порядка и некоторыми другими полезными свойствами. Если бы водородные связи отсутствовали, вода при н.у. была газообразной, и жизнь в том виде, в котором она существует сейчас, вряд ли была.
480. Внутримолекулярная связь имеет
место в соединении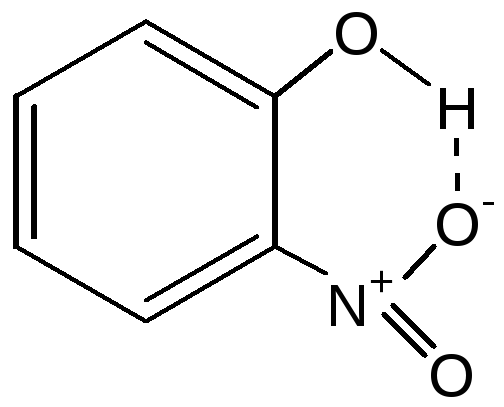 .
Внутримолекулярная связь изменяет
валентные углы, немного увеличивает
температуру его кипения.
.
Внутримолекулярная связь изменяет
валентные углы, немного увеличивает
температуру его кипения.
481.1) Водородная связь не является разновидностью ковалентной, т.к. при ее образовании не происходит образования электронных пар, перекрывания электронных облаков и энергия водородной связи намного меньше энергии ковалентной связи. 2) Донорно-акцепторный механизм - это один из видов образования ковалентной связи, а водородная связь не является ковалентной. 3) Метод МО описывает образование молекул, а при образовании водородной связи новых молекул не образуется.
482.Вандерваальсовским взаимодействием называются такие взаимодействия, как дисперсионное, индукционное и ориентационное. Вандерваальсовское взаимодействие осуществляется за счет электростатических сил, в то время как химические связи образуются при взаимодействии электронов. Дисперсионное взаимодействие наблюдается, например, между молекулами хлора, атомами благородных газов. При увеличении размера атома увеличивается дисперсионное взаимодействие - увеличивается температура кипения вещества. Индукционное взаимодействие осуществляется, например, между полярными молекулами воды и неполярными молекулами спирта, что соответствует процессу растворения спирта в воде. Ориентационное взаимодействие осуществляется, например, между полярными молекулами аммиака. Данный вид взаимодействия ответственен за увеличение температуры кипения веществ.
483.Вандерваальсовским взаимодействием называется взаимодействие молекул, которое осуществляется за счет электростатических сил. Переход в конденсированное состояниеNe,N2,Cl2обусловлен дисперсионным взаимодействием. Переход в конденсированное состояниеHI,BF3,H2Oобусловлен ориентационным взаимодействием.
484.Универсальным взаимодействием, действующим между всеми молекулами, является дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей.
485.Вандерваальсовское взаимодействие делится на три вида. 1) Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. 2) Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. 3) Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Не способны к индукционному и ориентационному взаимодействию неполярные молекулыN2,Ar,He,Cl2.
486.Дисперсионное взаимодействие:H2+O2,H2+H2O,H2O+NH3,NH3+NF3,NF3+BF3,HCl+HCl,HF+HF. Индукционное взаимодействие:H2+H2O,H2O+NH3,NH3+NF3,NF3+BF3,HCl+HCl,HF+HF. Ориентационное взаимодействие:H2O+NH3,NH3+NF3,NF3+BF3,HCl+HCl,HF+HF.
487.При повышении порядкового номера благородного газа возрастает размер атома - увеличивается дисперсионное взаимодействие между атомами - в результате увеличивается температура кипения.
488.Увеличение температуры кипения в рядуBF3,BCl3,BBr3,BI3, объясняется ростом вклада дисперсионного взаимодействия между молекулами при увеличении их размеров. Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Обсуждение таблицы: не способны к индукционному и ориентационному взаимодействию неполярные молекулы, поэтому междуArи СО действует только дисперсионное взаимодействие. МолекулаHClмало полярная, поэтому вклад дисперсионного взаимодействия больше, чем ориентационного и индукционного, в то время как для полярных молекул воды и аммиака наблюдается обратная закономерность.
489.В методичке нет условия
490.Ион-дипольным взаимодействием называется индукционные силы Вандерваальса. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. К++H2O,H2O+NH4+,NH3+NF3,NF3+BF3,H++HCl,HF+HF. Оно проявляется, например, при растворении спирта в воде.
491.Данный вид межмолекулярного взаимодействия описывает ориентационные силы Вандерваальса. Взаимодействие происходит при диссоциации сильного электролита (NaCl) в воде.
492.При образовании гидратов и клатратов между частицами и молекулами воды действуют силы Вандерваальса. При образовании связи между водой и полярной молекулой (NH3*H2O,H2SO4*H2O,H2SO4*2H2O,CuSO4*5H2O) действуют ориентационные силы, а между водой и неполярной молекулой (Ar*8H2O) - индукционное взаимодействие.
493. Уравнение Вандерваальса:![]() ,
где а/V2- поправка
на давление,b- поправка
на объем реального газа.
,
где а/V2- поправка
на давление,b- поправка
на объем реального газа.
494.Агрегатные состояния: твердое (в свободном состоянии не твердое тело изменяет форму и объем) → жидкое (в свободном состоянии жидкое тело принимает форму сосуда, в котором находится, но не изменяет объем) → газообразное (в свободном состоянии принимает форму сосуда, в котором находится, может изменять объем).
495.Кристаллическое состояние характеризуется наличием дальнего порядка в решетке, в то время как аморфное состояние вещества определяется как отсутствие дальнего порядка в объеме. Аморфные вещества обладают значительной вязкостью, а кристаллические практически не вязкие. Кристаллические вещества классифицируются на ионные (ионная связь: решеткаNaCl), ковалентные (ковалентная связь: решеткаPbO), молекулярные (молекулярная связь, решетка СО2), металлические (металлическая связь: решеткаFe).
496.Поваренная соль:NaCl(ионная связь - ионная решетка), алмаз и графит: С (ковалентная связь, ковалентная кристаллическая решетка), кремнезем:SiO2(ковалентная связь, ковалентная кристаллическая решетка), железо:Fe(металлическая связь - металлическая решетка), сухой лед: СО2(молекулярная связь - молекулярная кристаллическая решетка).
497.Необходимо все три порошка разместить в разные сосуды с дистиллированной водой. Сразу идентифицировать не растворившийся песок. Затем в оставшиеся сосуды опустить разомкнутые концы электрической цепи, в которую включена лампочка. Т.к. раствор хлорида натрий проводит электрический ток, то в сосуде, содержащемNaClцепь замкнется и лампочка загорится. Раствор с сахаром - это оставшийся третий сосуд.
498.Дальтониды -NaCl,CaF2,MgO. Бертоллиды -TiO0.8-1.7,CuxOy,MnS0.9-1.1. Бертоллиды имеют переменный состав, т.к. их кристаллические решетки имеют очень высокую дефектность - выпадение атомов из узлов решетки, либо, наоборот, внедрение атомов в решетку. В зависимости от степени и вида дефектности меняется состав бертоллида.
499. Полиморфизм - способность вещества при определенных температурах и давлениях образовывать в твердом состоянии различные типы кристаллических структур. Например,SiCимеет более сорока модификаций, у олова их две - белое и серое. Изоморфизм - сходство пространственной структуры и химической природы веществ. Например, медь и серебро имеют одинаковую структуру решетки - гцк. Полиморфные модификации: диоксид кремния - 3 (кварц, кристобаллит, тридимит), фторид кальция - 2, железо - 4 (α, β, δ, γ).
500. Идеальным называется кристалл, не имеющий дефектов. Реальные кристаллы содержат поверхностные (дислокации, гряды, ступеньки и т.д.) и объемные дефекты (внедрения, замещения, вычитания). Наличие дефектов сильно изменяет свойства кристаллов: меняется ковкость, пластичность, электро- и теплопроводность. Химическая активность дефектных структур обычно увеличивается.
Блажен лишь тот, кто по утру
Имеет стул без принужденья
Тому и пища по нутру
И прочие мирские наслажденья.
