501. [Cr(H2O)5Cl]2+(NO3)2 - нитрат хлорпентааквахрома(+3), к.о. - хром, с.о.= +3, к.ч.= 6.
K2[Sn(OH)4] 2- - тетрагидроксостаннат(+2) калия, к.о. - олово, с.о. = +2, к.ч. = 4.
[Co(NO2)3(NH3)3]0 - тринитротриамминкобальт(+3), к.о. - кобальт, с.о. = +3, к.ч. = 6.
502. K2[Ni(CN)4] 2- - тетрацианоникелат(+2) калия, к.о.= никель, с.о.= +2, к.ч.= 4. [Ti(H2O)6]1+ Cl - хлорид гексаакватитана(+1), к.о.= титан, с.о.= +1, к.ч.= 6; [Co(SCN)2(NH3)2]0 - дироданодиамминкобальт(+2), к.о.= кобальт, с.о.= +2, к.ч.= 4.
503. K2[HgCl4] 2- - тетрахлоромеркурат(+2) калия, к.о.= ртуть, с.о.= +2, к.ч.=4. [Ag(NH3)2]1+ Cl - хлорид диамминсеребра(+1), к.о.=серебро, с.о.= +1, к.ч.=2. [Cu(SCN)2(NH3)2]0 - дироданодиамминмедь (+2), к.о.=медь, с.о.= +2, к.ч.= 4.
504.
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
Тетрахлороплатинат(II) аммония |
(NH4)2[Pt(Сl)4] |
платина |
+2 |
4 |
-2 |
Нитрат пентаамминроданокобальта(III) |
[Co(NH3)5СNS](NO3)2 |
кобальт |
+3 |
6 |
+2 |
Гексабромоплатинат(IV)тетрааквацинка(II) |
[Zn(H2O)4][PtBr6] |
Цинк-платина |
+2 +4 |
4 6 |
+2 -2 |
505.
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
Гексагидроксоалюминат калия |
K3[Al(OH)6] |
Алюминий |
+3 |
6 |
-3 |
Гидросульфат пентаамминнитратокобальта(III) |
[Co(NH3)5NO3](HSO4)2 |
Кобальт |
+3 |
6 |
+2 |
Гексахлороплатинат(IV) гексаакважелеза(II) |
[Fe(H2O)6][PtCl6] |
железо-платина |
+2 +4 |
6 6 |
+2 -2 |
506.
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
гексацианоферрат(III) натрия |
Na3[Fe(CN)6] |
Железо |
+3 |
6 |
-3 |
Бромид гексааминхрома(III) |
[Cr(NH3)6]Br3 |
Хром |
+3 |
6 |
+3 |
Гексафтороманганат(IV) тетраакваникеля(II) |
[Zn(H2O)4][MnF6] |
Цинк-марганец |
+2 +4 |
4 6 |
+2 -2 |
507.
Комплекс |
Название комплекса |
Особенности |
[Cr(H2O)5Cl](NO3)2 |
Гексааквахлорохром(III) нитрат |
Соль, катионное, смешанное. |
H[AuCl4] |
Водорода тетрахлороаурат(III) |
Кислота, анионное, ацидокомплексное. |
[Cu(NH3)4](OH)2 |
Тетраамминмедь(II) гидроксид |
Основание, катионное, амминокомплексное |
[Fe(H2O)6]SO4 |
Гексаакважелезо(II)сульфат |
Соль, катионное, аквакомплекс |
508.
Комплекс |
Название комплекса |
Особенности |
H2[SiF6] |
Гексааквахлорохром(III) нитрат |
Кислота, анионное, ацидокомплексное |
[Zn(NH3)4](OH)2 |
Водорода тетрахлороаурат(III) |
Основание, катионное, амминокомплексное. |
Na[Co(NH3)2(NO2)4] |
Тетраамминмедь(II) гидроксид |
Соль, анионное, смешанное. |
[Fe(H2O)6]2(SO4)3 |
Гексаакважелезо(III)сульфат |
Соль, катионное, аквакомплекс |
509.
Комплекс |
Название комплекса |
Особенности |
H2[Pt(CN)6] |
Водорода гексацианоплатинат(IV) |
Кислота, анионное, ацидокомплексное. |
[Co(SO4)(NH3)5]NO3 |
Пентаамминсульфаткобальта(III) нитрат |
Соль, катионное, смешанное. |
[Pd(H2O)4]Cl2 |
Тетрааквапалладий(II)хлорид |
Соль, катионное, аквакомплекс |
[Cd(NH3)4](OH)2 |
Тетраамминкадмий(II) гидроксид |
Основание, катионное, амминокомплексное |
510. Сульфат меди CuSO4, вода H2O, газообразный аммиак NH3. Необходимо растворить сульфат меди, пропустить через раствор аммиак - образуется комплекс:
CuSO4(тв) + H2O = CuSO4(ж),
CuSO4(ж) + NH3(г) = [Cu(NH3)4](SO4)
511. Нитрат ртути Hg(NO3)2, вода H2O, иодид калия KI. Необходимо растворить соли в воде, к нитрату ртути добавить иодид калия - выпадет осадок. Прилить иодида до полного растворения осадка - образовалась комплексная соль:
Hg(NO3)2(тв) + H2O = Hg(NO3)2(ж),
KI(тв) + H2O = KI(ж),
Hg(NO3)2(ж) + KI(ж) = HgI2(тв) + 2KNO3.
HgI2(тв) + 2 KI(ж) = K2[HgI4]
512. Co3+, NH3, NO2-, K+
-
Комплекс
Название
[Co(NH3)6](NO2)3
Гексаамминкобальт(III) нитрит
[Co(NH3)5(NO2)](NO2)2
Пентаамминнитритокобальт(III) нитрит
[Co(NH3)4(NO2)2](NO2)
Тетраамминдинитритокобальт(III) нитрит
[Co(NH3)3(NO2)3]
Триамминтринитритокобальт(III)
K[Co(NH3)2(NO2)4]
Калия диамминтетранитритокобальтат(III)
K2[Co(NH3)(NO2)5]
Калия амминпентанитритокобальтат(III)
K3[Co(NO2)6]
Калия гексанитритокобальтат(III)
513. Поскольку из раствора комплекса осаждается сульфат бария, то барий находится во внешней сфере комплекса: Ba[Cu(SCN)2(CN)2] - бария дицианодироданокупрат(II).
Ba[Cu(SCN)2(CN)2] + H2SO4 = BaSO4 + H2[Cu(SCN)2(CN)2]
514. Поскольку комплекс реагирует с нитратом серебра в соотношении 1:1, то во внешней сфере комплекса находится 1 атом хлора: [Pt(NH3)3Cl3]Cl - триамминдихлорплатина(IV). [Pt(NH3)3Cl3]Cl + AgNO3 = AgCl + [Pt(NH3)3Cl3]NO3.
515. Данные сложные соединения представляют собой комплексные соли, различающиеся между собой устойчивостью. Первый комплекс K[Fe(SO4)2] малоустойчив, т.е. в его растворе присутствуют катионы железа, а второй комплекс железа K3[Fe(CN)6] устойчив настолько, что в растворе нет катионов железа, способных реагировать с роданидом калия. Fe3+ + 3CNS- = Fe(CNS)3 - красный роданид железа.
516. При хранении на воздухе сульфат меди превращается в комплекс, который имеет синюю окраску (медный купорос): CuSO4 + 5H2O = [Cu(H2O)5]SO4.
517. Гексацианоферрат(II) калия и сульфат меди: K4[Fe(CN)6] + CuSO4 = Cu2[Fe(CN)6]. Образуется комплексная соль - гексацианоферрат(II) меди, которая нерастворима. [Fe(CN)6]+4 + Cu+2 = Cu2[Fe(CN)6].
518. 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O. Образовался K3[Fe(CN)6] - гексацианоферрат(III) калия.
519. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Co(CN)6]3- , т.к. z (Co = 3) > z (Co = 2). В случае б) прочнее [Co(CN)6]4-, т.к. CN- - лиганд сильного поля. в) прочнее [ZrF6]2- , т.к. r (Ti)< r (Zr).
520. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(NH3)4]2- , т.к. NH3 - лиганд сильного поля. В случае б) прочнее [Hg(CN)4]2-, т.к. CN- - лиганд сильного поля. в) прочнее [Cu(NH)3]2+ , т.к. z (Cu2+)< z (Cu+).
521. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(СN)4]2- , т.к. CN - лиганд сильного поля. В случае б) прочнее [BeF4]2-, т.к. F – ионы более сильные лиганды, чем Cl-ионы. в) прочнее [Zr(CN)6]2- , т.к. z (Ti+4)< z (Zr4+).
522. н
523. Взаимодействие между центральным атомом Ni и лигандами (NH3) происходит по донорно-акцепторному механизму.
В образовании гибридных облаков участвуют вакантные 4s-, 4p-, 4d-орбитали иона Ni2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-, три р-орбитали и две 4d-орбитали, тип гибридизации комплекса: sp3d2, геометрия: октаэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.
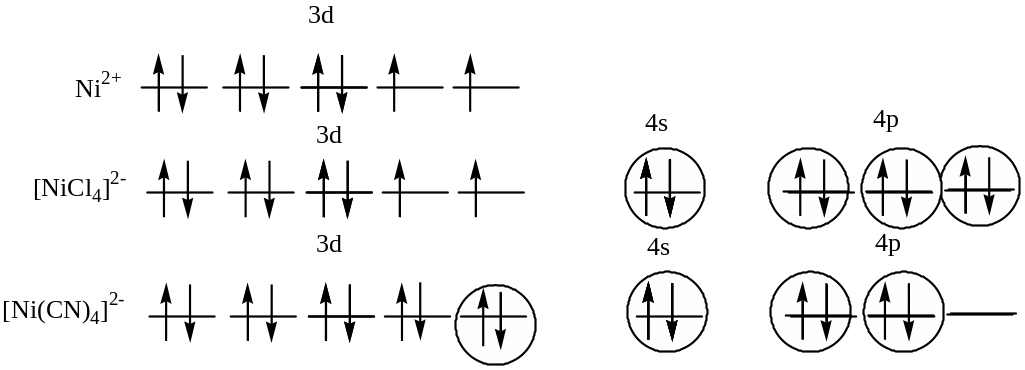
524.
Взаимодействие между центральным атомом Ni и лигандами (Cl) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали иона Ni2+ и электронные пары атомов хлора. Т.о., гибридизуются одна s- и три р-орбитали, тип гибридизации комплекса: sp3, геометрия: тетраэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.[Ni(CN)4]2- Взаимодействие между центральным атомом Ni и лигандами (CN) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали иона Ni2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-, две р-орбитали и одна 3d-орбиталь, тип гибридизации комплекса: dsp2, геометрия: плоский комплекс. Т.к. на 3d-орбиталях атома никеля нет неспаренных электронов, то комплекс диамагнитен.
525.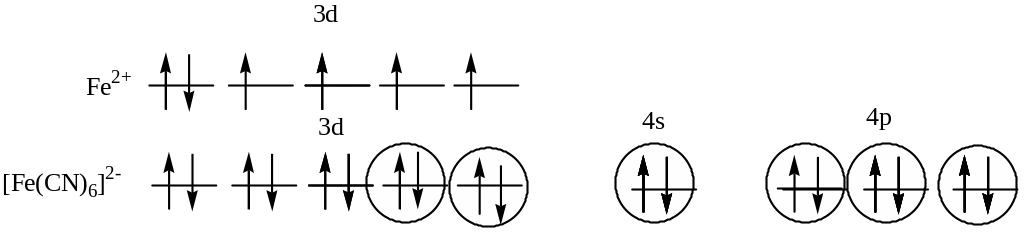 Взаимодействие
между центральным атомом Fe
и лигандами (CN) происходит
по донорно-акцепторному механизму. В
образовании гибридных облаков участвуют
вакантные3d-, 4s-
и 4p- орбитали иона Fe2+
и электронные пары атомов азота. Т.о.,
гибридизуются одна s- ,три
р- и две d- орбитали, тип
гибридизации комплекса: d2sp3,
геометрия: октаэдр. На 3d
- орбиталях атома железа нет неспаренных
электронов, поэтому комплекс диамагнитен.
Взаимодействие
между центральным атомом Fe
и лигандами (CN) происходит
по донорно-акцепторному механизму. В
образовании гибридных облаков участвуют
вакантные3d-, 4s-
и 4p- орбитали иона Fe2+
и электронные пары атомов азота. Т.о.,
гибридизуются одна s- ,три
р- и две d- орбитали, тип
гибридизации комплекса: d2sp3,
геометрия: октаэдр. На 3d
- орбиталях атома железа нет неспаренных
электронов, поэтому комплекс диамагнитен.
526.
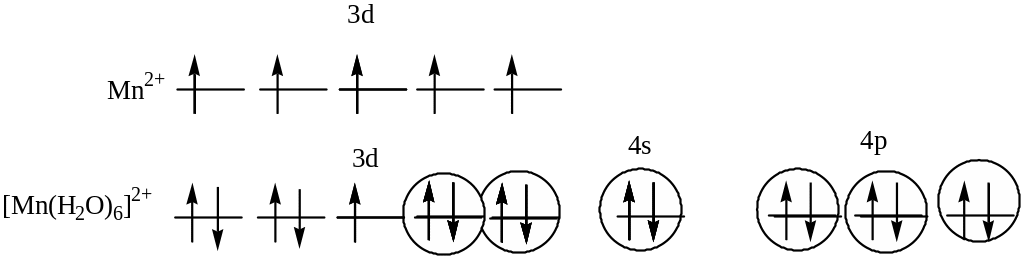
Взаимодействие между центральным атомом Mn и лигандами (Н2О) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные3d-, 4s- и 4p- орбитали иона Mn2+ и электронные пары атомовкислорода. Т.о., гибридизуются одна s- ,три р- и две d- орбитали, тип гибридизации комплекса: d2sp3, геометрия: октаэдр. На 3d - орбиталях атома марганца есть один неспаренный электрон, поэтому комплекс парамагнитен.
527.
528. Цветность комплексов объясняется наличием неспаренных электронов на расщепленных под действием лигандов d-орбиталях. Неспаренный электрон может возбуждаться под действием кванта света и переходить на свободную расщепленную орбиталь – соединение приобретает цветность. Так,
529. Сила лиганда в комплексе определяет его спин. Если лиганд слабого поля, как в случае с комплексом [CoF6]3- , то заполнение расщепленных d-подуровней происходит по правилу Хунда, вкруговую. Если лиганд сильного поля, как в [Co(NH3)6]3+ , то расщепленные подуровни заполняются против правила, сначала низ, а за тем верх, и комплекс имеет низкий спин.
рисунок
530. В случае лиганда сильного поля, например СО, NH3, расщепленные d-подуровни центрального атома заполняются против правила Хунда, сначала низ, а за тем верх. Это случай а). Например, [Fe(NH3)4]2-. В случае лиганда слабого поля, например F-, OH-, заполнение расщепленных d-подуровней происходит по правилу Хунда, вкруговую. Это случай б). Например, [CoF6]3 .
4.1. Способы выражения концентрации растворов.
531. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Массовая доля растворенного вещества - количество грамм растворенного вещества, содержащееся в 100 граммах раствора. Например, концентрация спирта 40% означает, что в 100 граммах водки содержится 40 грамм спирта. 1%-ный раствор иода означает, что 100 грамм раствора содержат 1 грамм иода.
Дано V(раствора)=10л. W%(KOH)= 40% ρ = 1.40 г.мл |
Найдем массу раствора: m = V*ρ = 10000*1.4 = 14000 г. В растворе должно содержаться: m(KOH) = 14000*40%/100% = 5600 грамм, m(H2O) = 14000 - 5600 = 8400 грамм. |
532.
Дано: m(раствора)=5 кг. W%(FeSO4)= 40% |
FeSO4*7H2O = FeSO4(раствор). 5 кг раствора с массовой долей FeSO4 равной 1% содержится соли: m(FeSO4) = 5000*1%/100% = 50 грамм. n(FeSO4) = m/M = 50/152 = 0.33 моль = n(FeSO4*7H2O) m(FeSO4*7H2O) = n*M = 0.33*278 = 91.74 грамм. |
533.
Дано: V(раствора)=1 л W%(HCl)= 30% ρ = 1.15 г.мл |
Найдем массу раствора: m = V*ρ = 1000*1.15 = 1150 г. В растворе должно содержаться: m(HCl) = 1150*30%/100% = 345 грамм, m(H2O) = 1150 - 345 = 805 грамм. |
534. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Молярная концентрация растворенного вещества - количество моль растворенного вещества, содержащееся в 1 литре раствора. Молярная концентрация эквивалента растворенного вещества - количество моль эквивалентов растворенного вещества, содержащееся в 1 литре раствора. Например, концентрация соли 1 моль/л или 1 моль-экв/л означает, что в 1 литре раствора содержится 1 моль или 1 моль эквивалентов соли.
Дано: V(H2SO4)=500 мл. m(H2SO4) = 196 г. |
n(H2SO4) = m/M = 196/98 = 2 моль nэ(H2SO4) = m/Mэ = 196/49 = 4 моль См(H2SO4) = n/V = 2/0.5 = 4 моль/л, Сн(H2SO4) = nэ/V = 4/0.5 = 8 моль-экв/л, |
535.
Дано: См(Al2(SO4)3)=0.1 моль/л V(раствора) = 2 литра |
m(Al2(SO4)3) = См*V*М = 0.1*2*342 = 68.4 г. Э(Al2(SO4)3) = 6, следовательно, Сэ = 6*См = 0.6 моль-экв/л |
536.
Дано: См(NH3) = 18 моль/л V(раствора) = 1 литр |
n(NH3) = См*V = 18*1 = 18 моль. V(NH3) = n*Vм = 36*22.4 = 806.4 литра. |
537.
Дано: а) Сэ(Na2CO3) = 0.25 н V(раствора) = 0.5 литра б) m(CuSO4) = 8 г. Cэ = 0.1 н |
а) nэ(Na2CO3) = Сэ*V = 0.25*0.5 = 0.125 моль-экв. Мэ(Na2CO3) = 53 г/моль-экв. m(Na2CO3) = nэ*Мэ = 0.125*53 = 6.625 г. б) V = m/(Mэ*Cэ) = 8/(80*0.1) = 1 литр. |
538. Моляльность - количество моль растворенного вещества, приходящееся на 1 кг. растворителя.
Дано: m(глицерина) = 460 г. V(воды) = 5 л. |
n(глицерина) = m/M = 460/92 = 5 моль. Моляльность Сm(глицерина) = n/m(H2O) = 5 моль/5 кг = 1 моль/кг |
539. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Титр - количество грамм растворенного вещества в 1 миллилитре раствора.
Дано: а) См(HCl) = 0.1 м б) Сэ(H2SO4) = 0.1 н в) w%(HNO3) = 31.5% p = 1.19 г/мл. |
а) Возьмем 1 литр раствора. n(HCl) = 0.1 моль. m(HCl) = n*M = 0.1*36.5 = 3.65 г. Т(HCl) = m/V = 3.65/1000 = 0.00365 г/мл. б) Возьмем 1 литр раствора. Поскольку эквивалент серной кислоты равен 2, то См(H2SO4) = 1/2Сэ(H2SO4) = 0.05 моль/л. n(H2SO4) = 0.05*1 = 0.05 моль. m(H2SO4) = n*M = 0.05*98 = 4.9 г. Т(H2SO4) = m/V = 4.9/1000 = 0.0049 г/мл в) Возьмем 1 литр раствора. Масса раствора равна V*p = 1000*1.19 = 1190 г. m(HNO3) = 1190*31.5%/100% = 374.85 г. Т(HNO3) = 374.85/1000 = 0.375 г/мл. |
541.
Дано: См(HNO3) = 4.65 м p = 1.15 г/мл. |
Возьмем 1 литр раствора. m(раствора) = 1000*1.15 = 1150 г. m(HNO3) = См*М(HNO3)*V = 4.65*63*1 = 292.95 г. w%(HNO3) = 292.95*100%/1150 = 25.5% |
542.
Дано: W%(KOH) = 26 % p = 1.24 г/мл. |
Возьмем 1 литр раствора. m(раствора) = 1000*1.24 = 1240 г. m(KOH) = 1240*26%/100% = 322.4 г. m(H2O) = 1240 - 322.4 = 917.6 г. = 322.4/(56*1) = 5.75 моль/л Моляльность Cm = n(КОH)/m(H2O) = 5.75/0.9176 = 6.27 моль/кг. Титр Т(КОН) = См*М/1000 = 5.75*56/1000 = 0.322 г/мл |
543.
Дано: w%(HNO3) = 36 % p = 1.22 г/мл. |
а) Возьмем 1 литр раствора. m(раствора) = 1000*1.22 = 1220 г. m(HNO3) = 1220*36%/100% = 439.2 г. m(H2O) = 1220-439.2 = 780.8 г. б) = 439.2/(63*1) = 7 моль/л в) Т.к. Э(HNO3) = 1, то Сэ = См = 7 моль-экв/л. г) Моляльность Cm = n(HNO3)/m(H2O) = 7/0.7808 = 8.9 моль/кг. д) Т = Сэ*Мэ/1000 = 7*63/1000 = 0.441 г/мл е) n(H2O) = m/M = 780.8/18 = 43.4 моль. Мольная
доля N =
|
544.
Дано: w%(H2SO4) = 11.6 % p = 1.08 г/мл. Мэ(H2SO4) = 49 г-экв/моль |
Возьмем 1 литр раствора. m(раствора) = 1000*1.08 = 1080 г. m(H2SO4) = 1220*11.6%/100% = 141.52 г.
|
545.
Дано: w%(NaOH) = 10 % m(раствора) = 1 кг. m(H2O) = 200 г. |
m(NaOH) = m(раствора)*w%(NaOH)/100% = 1000*10/100 = 100г. В растворе было 1000-100 = 900 грамм воды, а осталось 900-200 = 700 г. m(раствора) = 700+100 = 800 грамм. w%(NaOH) = 100*100%/800 = 12.5% |
546.
Дано: w%(соли) = 20 % m(раствора) = 400 г. m(вещества) = 50 г. |
m(соли) = m(раствора)*w%(соли)/100% =400*20/100 = 80 г. В растворе было 400-80 = 320 грамм воды. Осталось соли 80-50 = 30 г. m(раствора) = 320+30 = 350 гр. w%(NaOH) = 30*100%/350 = 8.57% |
547.
Дано: w%1(соли) = 30 % V(H2O) = 300 мл. w%2(соли) = 10 % |
Пусть масса соли, которую необходимо
добавить к воде равна х. Найдем массу
воды, приходящуюся на х грамм соли:
|
548.
Дано: V1(NaCl) = 500 мл w%1(NaCl) = 20 % p1 = 1.152 г/мл w%2(соли) = 4.5 % p2 = 1.029 г/мл |
А) Найдем массу сухой соли в исходном растворе: m1(раствора) = V1*p1 = 500*1.152 = 576 г. m(соли) = 576*20%/100% = 115.2 г. Б) Эта же масса соли содержится в конечном растворе: m2(раствора) = m(соли)*100%/ w%2(соли) = 115.2*100/4.5 = 2560 г. V2(раствора) = m/p = 2560/1.029 = 2488 мл. |
549.
Дано: w%1(КOH) = 20% w%2(КOH) = 50% m(р-ра2) = 1 кг. w%3(КOН) = 25% m(р-ра1) = ? |
Выразим массу чистого гидроксида калия, содержащегося в каждом из растворов: m1(КОН) = m(р-ра1)*w%1(КОН)/100% = 0.2*m(р-ра1) m2(КОН) = m(р-ра2)*w%2(КОН)/100% = 0.5 кг. m3(КОН) = m(р-ра3)*w%3(КОН)/100% = 0.25*m(р-ра3) По смыслу задачи: m1(КОН) + m2(КОН) = m3(КОН) m(р-ра1)*0.2 + 0.5 = m(р-ра3)*0.25 m(р-ра1) + 1кг = m(р-ра3) m(р-ра1)*0.2 + 0.5 = (m(р-ра1)+1)*0.25 m(р-ра1) = 5 кг. |
550.
Дано: w%1(Сa(NO3)2) = 10% w%2(Сa(NO3)2) = 2% m(р-ра1) = 300 г. m(р-ра2) = 500 г. w%общ(Сa(NO3)2) = ? |
Найдем массу чистого Сa(NO3)2, в каждом из растворов: m1(Сa(NO3)2) = m(р-ра1)*w%1/100% = 300*10%/100% = 30 г. m2(Сa(NO3)2) = m(р-ра2)*w%2/100% = 500*25/100% = 10 г. w%общ(Сa(NO3)2)
=
|
551.
Дано: w%1(H2SO4) = 11.6% p1 = 1.08 г/мл См2 = 0.1 моль/л V2 = 250 мл. V1 = ?, V(Н2О) = ? |
Найдем массу чистой серной кислоты, содержащейся в 0.1м растворе: m(H2SO4) = См*V*М = 0.1*0.25*98 = 2.45 г. Эта же масса кислоты содержится в 11.6%-ном растворе: m(раствора) = 2.45*100%/11.6% = 21.12 г. V(р-ра) = m/p = 21.12/1.08 = 20 мл V(Н2О) = 250-20 = 230 мл. |
552.
Дано: w%1(HCl) = 20% p1 = 1.10 г/мл Сн2(HCl) = 0.1 моль/л V2 = 1 л. V1 = ?, V(Н2О) = ? |
Найдем массу чистой HCl, содержащейся в 0.1н растворе: m(HCl) = Сн*V*Мэ = 0.1*1*36.5 = 3.65 г. Эта же масса кислоты содержится в 20%-ном растворе: m(раствора) = 3.65*100%/20% = 18.25 г. V(р-ра) = m/p = 18.25/1.1 = 17 мл V(Н2О) = 1000-17 = 983 мл. |
553.
Дано: V(H2SO4) = 50 мл. Сн(H2SO4) = ? н V(щелочи) = 25 мл. Сн(щелочи) = 0.4 н |
Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(H2SO4)
=
|
554.
Дано: C(HCl) = 0.5н V(AgNO3) = 0.5л. Сн(AgNO3) = 0.2 н V(HCl) = ? |
Закон эквивалентов: Сн1*V1 = Сн2*V2
V(HCl)
=
|
555.
Дано: V(щелочи) = 20 мл. Т(щелочи) = 0.012 г/мл V(кислоты) = 24 мл. Сн(кислоты) = 0.25 н М(щелочи) = ? |
Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(щелочи)
=
|
556.
Дано: w%(H2SO4)=20% p = 1.10 г/мл m(Mg) = 24.3 г. V(H2SO4) = ? |
H2SO4 + Mg = MgSO4 + H2 n(Mg) = m/M = 24.3/24.3 = 1 моль. Согласно уравнению реакции, n(Mg) = n(H2SO4) = 1 моль. m(H2SO4) = n*M = 1*898 = 98 г. m(раствора H2SO4) = 98*100%/15% = 653.3 г. V(H2SO4) = m/p = 653.3/1.1 = 594 мл. |
557.
Дано: w%(K2СO3)=20% V(K2СO3)=650 мл p = 1.189 г/мл С(H2SO4) =2М V(H2SO4) = ? V(СO2) = ? |
H2SO4 + K2СO3= К2SO4 + СО2 + H2О Найдем число моль K2СO3: m(раствора) = V* = 650*1/189 = 772.85 г. m(K2СO3)
=
n(K2СO3) = m/M = 154.57/138 = 1.12 моль. По уравнению рекции: n(K2СO3) = n(H2SO4) = n(СО2) V(H2SO4) = n/Cm = 1.12/2 = 560 мл. V(СО2) = n*Vm = 1.12*22.4 = 25 л. |
558.
Дано: w%(NH3)=23% p =0.916 г/мл С(HСl)=6М V(HCl) = 750мл V(NH3) = ? m(NH4Cl)= ? |
NH3 + HCl = NH4Cl –образуется хлорид аммония n(HCl) = C*V = 6*0.75 = 4.5 моль. По уравнению реакции: n(HCl) = n(NH3) = n(NH4Cl). m(NH4Cl) = n*M = 4.5*53.5 = 240.75 г. m(NH3) = n*M = 4.5*17 = 76.5 г. m(раствора
NH3) =
V(NH3) = m(раствора)/ = 332.6/0.916 = 363.1 мл.
|
559.
Дано: V(BaCl2) = 100 мл w% = 15% V(H2SO4)= 14.4 мл Cм, Сн, Т = ? |
H2SO4 + BaCl2 = BaSO4 + 2HCl Пусть плотность раствора BaCl2 = 1. Найдем n(BaCl2) m(раствора BaCl2) = V*p = 100 г. m(BaCl2) = 100*15%/100% = 15 г. n(BaCl2) = m/M = 15/208 = 0.0721 моль. = n(H2SO4) Cм(H2SO4) = n/V = 0.0721/0.0144 = 5 моль/л Сн(H2SO4) = 2См = 10 моль/л. Мэ(H2SO4) = 49 г/моль. Т =
|
560.
Дано: V(BaCl2) = 100 мл w% = 20% p =1.203 г/мл m (BaSO4)= ? |
3BaCl2 + Cr2(SO4)3 = 3BaSO4 + 2CrCl3 Найдем число моль BaCl2 : m(раствора BaCl2) = V*p = 100 * 1.203 = 120.3 г. m(BaCl2) = 120.3*20%/100% = 24.06 г. n(BaCl2) = m/M = 24.06 / 208 = 0.116 моль. n(BaSO4) = n(BaCl2) = 0.116 моль. m(BaSO4) = n*M = 0.116*233 = 26.9 г. |