
- •1.2. Атомная, молекулярная и молярная масса
- •1.3 Основные газовые законы в химии
- •1.5. Эквиваленты и закон эквивалентов
- •1.6. Основные классы неорганических веществ.
- •151. Получение оксидов металлов
- •152.Получение оксидов неметаллов
- •1.7. Типы химических реакций. Составление уравнений реакций.
- •1.8 Стехиометрические расчеты
- •2.3. Химическая кинетика.
- •3.3.4. Теория гибридизации и оэпво
- •3.4. Межмолекулярное взаимодействие. Агрегатное состояние вещества.
3.3.4. Теория гибридизации и оэпво
451.Появление теории гибридизации было вызвано необходимостью объяснить геометрию многоатомных молекул. Основные положения: число гибридных орбиталей всегда равно числу атомных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий: 1) хорошее перекрывание гибридизуемых электронных орбиталей; 2) небольшая разница в энергиях атомных орбиталей, участвующих в гибридизации. Гибридизация всегда сопровождается изменением формы электронного облака.
|
Тип гибридизации орбиталей центрального атома |
Геометрическая модель гибридных орбиталей |
Пример |
|
sp sp2 sp3 sp3d sp3d2 sp3d3 |
Прямая линия Плоский треугольник Тетраэдр Тригональная бипирамида Октаэдр Пентагональная бипирамида |
СО2 BF3 H2O PCl5 SF6 ClF7 |
452. Пространственное положение гибридных орбиталей определяется строением валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар)
|
Тип гибридизации орбиталей центрального атома |
Геометрическая модель гибридных орбиталей |
Пример |
|
sp sp2 sp3 sp3d2 |
Прямая линия (угол 1800) Плоский треугольник(угол 1200) Тетраэдр(угол 1090) Октаэдр(угол 900) |
СО2 BF3 H2O SF6 |
453.Гибридное облако всегда асимметрично: имеет большую вытянутость по одну сторону ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных облаков. О гибридизации судят по строению валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар) и по валентным углам в молекуле.
454.
-
Анион
Структурная формула
Тип гибридизации
Геометрия аниона
СО32-
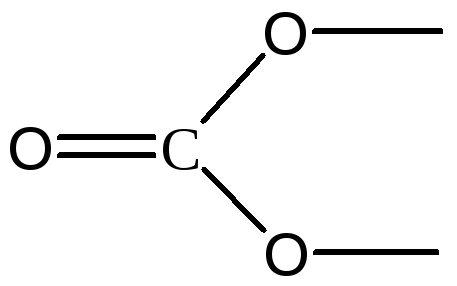
sp2
Треугольник
SО42-
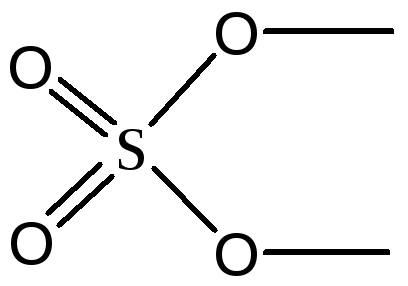
sp3
Тетраэдр
NО3-
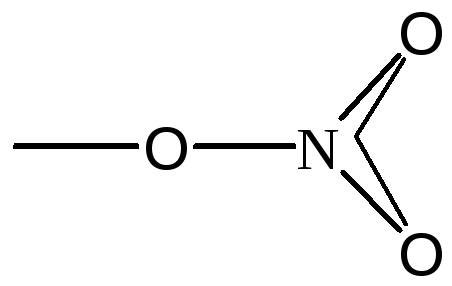
sp2
Треугольник
455. В молекуле СОCl2у центрального атома углерода в образовании связей участвуют все четыре электрона, но три из них образуют σ-связи, а один π-связь. Согласно теории гибридизации, электроны, образующие π-связь не принимают участие в гибридизации, поэтому гибридных АО не четыре а три.
456. а) Чем больше несвязывающих электронных пар, тем меньше валентный угол (CH4-нет несвязывающих пар,NH3- 1 пара,H2O- 2 несвязывающих пары). б) Чем больше электроотрицательность партнера центрального атома, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный угол (ЭО(Cl)>ЭО(Br)>ЭО(I). в) Чем дальше от ядра валентные орбитали, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный уголra(N)<ra(P)<ra(As)<ra(Sb).
457.Форма молекул и ионов зависит от типа гибридизации центрального атома и от строения его валентного слоя. Если валентная оболочка центрального атома не содержит неподеленных электронных пар, то частица будет иметь правильную геометрическую форму (СН4- тетраэдр,SF6- октаэдр). Если неподеленные электронные пары присутствуют, то у частицы будет незавершенная геометрическая форма (NH3- незавершенный тетраэдр), либо искаженная форма (Н2О - искаженная линейная структура).
458.
|
Поделен.эл.пары |
Неподел.эл.пары |
Тип гибридизации |
Расположение эл. пар |
Геометрич. форма молекулы |
примеры |
|
4 |
0 |
sp3 |
Тетраэдрическое |
Тетраэдр
|
CH4,NH4+ |
|
3 |
1 |
sp3 |
Тетраэдрическое |
Тригон. Пирамида
|
NH3,PF3 |
|
2 |
2 |
sp3 |
Тетраэдрическое |
Угловая
|
H2S,H2O |
|
5 |
0 |
sp3d |
Тригональное бипирамидальное |
Тригон. бипирамида
|
PCl5 |
|
4 |
1 |
sp3d |
Тригональное бипирамидальное |
Неправ. Тетраэдр
|
TeCl4 |
|
3 |
2 |
sp3d |
Тригональное бипирамидальное |
Т-образная
|
ClF3 |
|
6 |
0 |
sp3d2 |
октаэдрическое |
Октаэдр
|
SF5 |
|
5 |
1 |
sp3d2 |
октаэдрическое |
Квадратн. Пирамида
|
IF5 |
|
4 |
2 |
sp3d2 |
октаэдрическое |
Плоский квадрат
|
ICl4-,XeF4 |
459.
|
СО2иSO2: В молекуле СО2у центрального атомаsp-гибридизация, а в молекулеSO2за счет одной неподеленной электронной пары у атома серыsp2-гибридизация. Поэтому СО2– линейная молекула, аSO2– имеет угловую форму. |
|
BCl3иNCl3В молекулеBCl3у центрального атомаsp2-гибридизация, а в молекулеNCl3за счет одной неподеленной электронной пары у атома азотаsp3-гибридизация. ПоэтомуBCl3– плоская треугольная молекула, аNCl3– имеет форму пирамиды. |
|
CF4иXeF4В молекуле СF4у центрального атомаsp3-гибридизация, а в молекулеXeF4за счет неподеленных пар у атома ксенонаsp3d2-гибридизация. Поэтому СF4– тетраэдрическая молекула, аXeF4– имеет форму октаэдра. |
460.а) В молекулеBF3центральный атом имеетsp2-гибридизацию, в то время как в ионеBF4-у атома бораsp3-гибридизация. Поэтому при переходе от молекулы к иону форма меняется от плоского треугольника к тетраэдру. б) В молекулеNH3у атома азотаsp3-гибридизация, однако одна гибридизованная орбиталь содержит неподеленную электронную пару, из-за чего углы в тетраэдре искажены. В катионеNH4+ - гибридизованные орбитали не содержат неподеленных электронных пар, т.е. тетраэдр не искажен. в) Подобно этому, в молекуле воды Н2О у атома кислородаsp3-гибридизация, однако на двух гибридных орбиталях имеются электронные пары, из-за чего углы тетраэдра искажены очень сильно. Менее искажены углы в Н3О+, т.к. в этом катионе только одна гибридная орбиталь содержит неподеленные электронные пары.
461. Явление, называемое поляризацией химической связи, представляет собой деформацию электронной оболочки под действием сильного электромагнитного поля соседнего атома. Полярность связи тем выше, чем больше разница в электроотрицательности атомов, образующих связь: ЭО(Н) = 2,1.
|
ЭО(элемента) |
Разница ׀ЭО(Н)-ЭО(элемента)׀ |
Смещение электронного облака |
Место по увеличению полярности |
|
(N) = 3.0 |
0.9 |
К азоту |
2 |
|
(S) = 2.5 |
0.4 |
К сере |
1 |
|
(Li) = 1.0 |
1.1 |
К водороду |
3 |
|
(O) = 3.5 |
1.4 |
К кислороду |
4 |
|
(I) = 0.133 |
1.967 |
К водороду |
5 |
462. Ковалентная полярная связь характеризуется направленностью, насыщаемостью и поляризуемостью.Насыщаемость ковалентной связи- вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискрентных частиц с определенной структурой (Н2О,NH3,FeCl2).Направленность ковалентной связи- поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают σ-, π-, δ-связи. Сигма-связь осуществляется при перекрывании облаков вдоль линии соединения атомов. Пи-связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов. Дельта-связь образуется при перекрывании всех четырех лопастейd-электронных облаков, расположенных в параллельных плоскостях. Например, в молекуле азота одна сигма и две пи-связиN≡N.Поляризуемость ковалентной связи- свойство характеризует способность становится полярной в результате действия на молекулу внешнего электрического поля. Например, в молекулеHClсвязь под действием внешнего поля поляризуется и может даже разорваться.
463.Электрический момент диполя μ представляет собой произведение длины диполяlна значение электрического зарядаq: μ =l*q. Т.е. его величина зависит от расстояния между концами диполя и зарядом на полюсах диполя. Электрический момент диполя измеряется в Кл.м. Экспериментально определяется спектроскопическими методами. Если известны дипольные моменты связей в молекуле, то общий дипольный момент молекулы рассчитывается как векторная сумма моментов связей. Так, например, дипольный момент симметричной молекулы СО2равен нулю, несмотря на то, что связи С=О имеют сильно полярный характер, а угловая молекула воды Н2О имеет дипольный момент отличный от нуля.
464.При поляризации связи молекула приобретает электрический дипольный момент, т.е. получается диполь, на полюсах которого образуются заряды, которые называются эффективными. Этот заряд δ можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы НClсоставляет δН= +0.18, а на атоме хлора = -0.18 абсолютного заряда электрона. Можно сказать, что связь в молекулеHClимеет на 18% ионный характер, т.е. полярна. Эффективный заряд совпадет со степенью окисления по знаку, но не совпадает по значению.
465.Электроотрицательность характеризует способность атома в соединении оттягивать на себя электронную плотность. ЭО определяется экспериментально как относительная безразмерная величина. Если разница в ЭО двух атомов больше или равна 2.1, то связь между ними можно считать ионной:
-
Соединение
Разность электроотрицательностей элементов
Связь
NaCl
3-0.9 = 2.1
Ионная
MgCl2
3-1.2 = 1.8
Близка к ионной
AlCl3
3-1.5 = 1.5
Близка к ионной
SiCl4
3-1.8 = 1.2
Полярная
PCl3
3-2.1 = 0.9
Полярная
SCl4
3-2.5 = 0.5
Слабо полярная
Cl2
3-3 = 0
Неполярная
466.Образование ионной связи характеризуется очень сильным смещением электронной плотности к одному из атомов. 100%-я ионная связь не может быть образована, т.к. не может быть полного перехода электронов от одного атома к другому. В наиболее ионных соединениях доля ковалентности не превышает 10%. Наиболее ионным соединением являетсяFrF, т.к. разница в электроотрицательностях этих элементов максимальна.
467.Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь. Поляризуемостью иона называется способность его электронной оболочки деформироваться под действием электромагнитного поля атома, с которым образована химическая связь. Чем больше заряд иона и меньше его радиус, тем больше его поляризующее действие и меньше поляризуемость. Соответственно, чем меньше заряд иона и больше его радиус, тем меньше его поляризующее действие и больше поляризуемость. Радиус Ве меньше радиуса Ва, поэтому Ве2+имеет большую поляризующую способность. Радиус алюминия больше радиуса железа, поэтомуFe2+имеет большую поляризуемость. Радиус атома калия больше радиуса атома серебра и, кроме того, катион серебра имеет 18-электронный внешний слой (что также усиливает поляризующее действие), поэтомуAg+поляризует связь больше. Радиус аниона фтора меньше, чем анион иода, соответственно, поляризуемость иода выше. Ион Те2-крупнее ионаS2-, следовательно ион теллура поляризуется сильнее.
468. Из катионов наибольшим поляризующим действием, как известно, обладает водород. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что водород сильнее деформирует связь, чем катион любого металла, кислоты разрушаются легче (при меньшей температуре), чем соответствующие соли.
469. Поскольку радиус катиона кадмия меньше радиуса катиона кальция, катион кадмия имеет более сильное поляризующее действие. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что кадмий сильнее деформирует связь, чем кальций, соли кадмия разрушаются легче (при меньшей температуре), чем соответствующие соли кальция.
470.Fe,Cu,Pb- это вещества с металлической связью. Металлическая связь отличается от ковалентной тем, что в случае металлической связи часть электронов способна свободно перемещаться по всему объему куска металла. Кроме того при образовании металлической связи атомы не связаны друг с другом локализованными двухэлектронными связями. Способность металлов проводить электричество и тепло есть следствие именно наличия электронов, легко перемещающихся в металле. Пластичность металлов объясняется способностью металлической решетки деформироваться при механическом воздействии без разрыва связей. При повышении температуры возбуждаются электроны с глубинных слоев атомов металлов, в результате вакантных орбиталей для свободного перемещения электронов становится меньше - уменьшается электропроводность.
