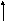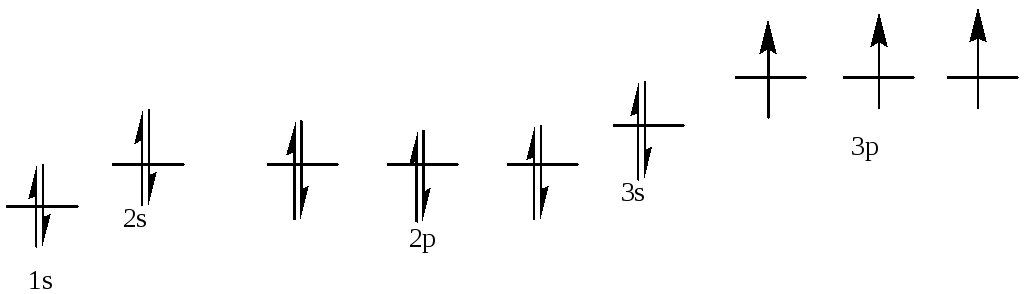- •1.2. Атомная, молекулярная и молярная масса
- •1.3 Основные газовые законы в химии
- •1.5. Эквиваленты и закон эквивалентов
- •1.6. Основные классы неорганических веществ.
- •151. Получение оксидов металлов
- •152.Получение оксидов неметаллов
- •1.7. Типы химических реакций. Составление уравнений реакций.
- •1.8 Стехиометрические расчеты
- •2.3. Химическая кинетика.
- •3.3.4. Теория гибридизации и оэпво
- •3.4. Межмолекулярное взаимодействие. Агрегатное состояние вещества.
2.3. Химическая кинетика.
301.Скорость химической реакции по некоторому компоненту называется изменение количества этого компонента в единицу времени в единице реакционного пространства. На практике скорость реакции может определяться по различным параметрам: по изменению концентрации одного из веществ, по изменению цветности, рН, электропроводности и др. Скорость реакции - это кинетическая характеристика, а энергия Гиббса - термодинамическая характеристика, эти параметры между собой не связаны. Т.к. скорость реакции определяется концентрациями реагирующих веществ, которые постоянно изменяются, то ее определяют на данный момент времени.
302. Основным понятием химической кинетики является понятие о скорости химической реакции. Математическое выражение скорости реакции зависит от типа реакции: гетерогенная или гомогенная. Поэтому в кинетике проводится такое разделение реакций.
гомогенные:N2(г)+O2(г) = 2NO2(г),N2O4(г) = 2NO2 (г);
гетерогенные:Ca(тв) + 2H2O(ж) =Ca(OH)2(ж) +H2(г),CuO(тв) =Cu(тв) + 1/2O2(г).
303. Одной из основных задач химической кинетики является нахождение зависимости скорости реакции от концентраций реагирующих веществ (кинетическое уравнение). Для простой реакции кинетическое уравнение находится легко, в то время как для сложной реакции нахождение кинетического уравнения представляет собой очень сложную задачу. Поэтому принято разделение реакций на простые и сложные.
Простые реакции. Моно: Cl2= 2Cl,Би:Н+ + Сl-=HCl,Три: 3O2= 2O3.
Сложные реакции: Последовательные: 2Ca+O2= 2CaO=>CaO+H2O=Ca(OH)2,Параллельные: Ca+Cl2=CaCl2иCa+F2=CaF2,Цепные: Сl2 = 2Cl*,Cl*+CH4=CH3*+HCl,CH3*+Cl2=CH3Cl+Cl*и т.д.
По стехиометрическому уравнению нельзя однозначно определить - сложная это реакция или простая, но если в реакцию вступают более трех частиц, то эта реакция сложная.
304.На скорость реакции влияют: природа взаимодействующих частиц, температура, давление, катализатор и др.
305. Кинетическое уравнение для простой и сложной реакции записывается как зависимость скорости реакции от концентрации взаимодействующих веществ. Однако, если для простой реакции кинетическое уравнение имеет относительно простой вид, то для сложных реакций кинетическое уравнение может записываться в виде системы уравнений. Константа скорости реакции - это скорость реакции при концентрации веществ равных единице. На константу скорости влияет температура, давление, природа веществ и не влияет концентрация веществ и объем системы.
306.а) 2HI=H2 +I2,V= К*Р2(HI) , после увеличения давления в 2 разаV/= К*(2Р(HI))2 , в результате скорость возрастет вV/ /V= 4 раза.
Б) N2O4 = 2NO2,V= К*Р (N2O4), после увеличения давления в 2 разаV/= К*(2Р(N2O4)), в результате скорость возрастет вV/ /V= 2 раза.
В) 2NO+H2=N2O+H2O,V= К*Р2(N2O) *P(H2), после увеличения давления в 2 разаV/ = К*(2Р(N2O)) 2 *2P(H2), в результате скорость возрастет в V/ / V = 8 раз.
307.a) 2NO+Cl2= 2NOCl,V= К*Р2(NO)*P(Cl2), после увеличения давления в 3 разаV/= К*(3Р(NO))2 * 3P(Cl2), в результате скорость возрастет вV/ /V= 27 раз.
Б) H2 +OH=H2O+H,V= К*Р(OH)*P(H2), после увеличения давления в 3 разаV/= К*3Р(OH)*3P(H2), в результате скорость возрастет вV/ /V= 9 раз.
В) Cl2= 2Cl,V= К*P(Cl2), после увеличения давления в 3 разаV/= К*3P(Cl2), в результате скорость возрастет вV/ /V= 3 раза.
308. а)O2+H=OH+O,V= К*Р(H) *P(O2), после увеличения давления в 4 разаV/= К*4Р(H) *4P(O2), в результате скорость возрастет вV/ /V= 16 раз.
Б) H2+Y2 = 2HY,V= К*Р(H2)*P(Y2), после увеличения давления в 4 разаV/= К*4Р(H2)*4P(Y2), в результате скорость возрастет вV/ /V= 16 раз.
В) 2NO+O2= 2NO2,V= К*Р2(NO2)*P(O2), после увеличения давления в 4 разаV/= К*(4Р(NO2) )2 *4P(O2), в результате скорость возрастет вV/ /V= 64 раза.
309.H2+Br2= 2HBr,V=K*[H2]*[Br2]1/2 .Молекулярность реакции равна1+1 =2, а порядок реакции 1+1/2=1,5. Поскольку молекулярность и порядок не совпадают, то данная реакция - сложная. А)V/=K*4[H2]*[Br2]1/2 , скорость реакции возрастает вV//V= 4 раза.
Б) V//=K*[H2]*(4[Br2])1/2 , скорость реакции возрастает вV///V= 2 раза.
В) V///=K*4[H2]*(4[Br2])1/2 , скорость реакции возрастает вV///V= 8 раз.
310.F2+ 2ClO2=2ClO2F, V=K*[F2]*[ClO2], Данная реакция является сложной, т.к. ее порядок (2) и молекулярность (3) не совпадают. При увеличении давления в 3 раза:V/=K*3[F2]*3[ClO2], скорость реакции возрастает вV//V= 9 раз.
311. 2NO+2H2 =N2+ 2H2O, а) фиксируем концентрацию [H2] = 0,12 моль/л. При увеличении [NO] в 2 раза, скорость реакции возрастает в 4 раза, т.е. порядок по[NO] равен 2. б) фиксируем [NO] = 1,12 моль/л. При увеличении [H2] в 2 раза, скорость возрастает в 2 раза - порядок по [H2] = 1. Т.о. кинетическое уравнение имеет вид:V=K*[H2]1 *[NO]2.
312.SO2+2H2=S+2H2O, а) фиксируем концентрацию [SO2]=200. При увеличении [H2] в 2 раза, скорость реакции возрастает в 2 раза, т.е. порядок по[H2] равен 1. б) фиксируем [H2]=200. При увеличении [SO2] в 2 раза, скорость возрастает в 2 раза - порядок по [SO2]=1. Т.о. кинетическое уравнение имеет вид:V=K*[H2]1 *[SO2]1.
313. 2Co+3 + Tl+ = 2Co+2 + Tl+3,
а) фиксируем концентрацию [Co+3] = 0,3моль/л. При увеличении [Tl+] в 2 раза, скорость реакции возрастает в 2 раза, т.е. порядок по [Tl+] равен 1.
б) фиксируем [Tl+] = 0,1 моль/л. При увеличении [Co+3] в 3 раза, скорость возрастает в 3 раза - порядок по [Co+3] = 1. Т.о. кинетическое уравнение имеет вид:V=K*[Co+3]1 *[Tl+]1.
314. CH3CHO = CH4+CO. При увеличении [CH3CHO] в 2 раза, скорость возрастает в 4 раза, т.е. порядок равен 2.V=K* [CH3CHO]2.
315. 2A+3B=A2B3. а) фиксируем концентрацию [A] = 0,20 моль/л. При увеличении [В] в 4 раза, скорость реакции возрастает в 4 раза, т.е. порядок по [В] равен 1. б) фиксируем [В] = 0,80 моль/л. Изменение [A] не приводит к изменению скорости. Т.о. кинетическое уравнение имеет вид:V=K*[В]1 . После увеличения давления в 2 разаV/ =K*2[В], скорость реакции возрастает в 2 раза:V//V= 2 раза.
316.2NO+O2 = 2NO2, Кинетическое уравнение:V=K*[NO]2*[O2]1. 1.2*10-3= К*0.32 *0.15, следовательно,К = 0,089 л2/моль2с.
317. H2+Y2 = 2HY, К = 0,16, [H2] = 0,04, [I2] = 0,05 моль/л. Vисх. = K*[H2]*[I2] = 0,16*0,04*0,05 = 3,2*10-4. Когда израсходовалась половина количества водорода, т.е. 0,02 моль/л, то израсходовалось столько же иода. Осталось 0,02 моль/л водорода и 0,03 моль/л иода.V/ = 0,16*0,02*0,03 = 9,6*10-5.
318. 2NO+Cl2 = 2NOCl, [NOисх.] = 0,4 моль/л, [Cl2 исх.] = 0,3 моль/л.V=K*[NO]2* [Cl2] = К*0,42*0,3 = 0,048К. Прореагировало 0,2 моль/лNO, следовательно, прореагировало 0,1 моль/лCl2. Осталось 0,2 моль/лNOи 0,2 моль/лCl2.V=K* 0,22* 0,2 = 0,008 К. Скорость уменьшилась в 0,048/0,008 = 6 раз.
319.Согласно правилу Вант-Гоффа, при повышении температуры на 100скорость реакции увеличивается в 2-4 раза. γ = 3, Т1 = 800С, Т2 = 1300С.V2/V1= γТ2 -Т1 / 10 = 3130-80 /10 = 243.
320. Температурный коэффициент показывает, во сколько раз увеличивается скорость химической реакции при увеличении температуры на 10 градусов. γ = 3, ∆Т = 40,V2/V1= γТ2 -Т1 / 10 = 340 /10 = 81.
321. Согласно правилу Вант-Гоффа, при повышении температуры на 100скорость реакции увеличивается в 2-4 раза. γ = 1.8,V2/V1= 50. ∆Т -?
V2/V1= γ∆Т/10, 50 = 1.8∆Т/10,ln50 = ∆Т/10 *ln1.8, ∆Т = 66.50C.
322. Правило Вант-Гоффа выведено не из фундаментальных законов, а опытным путем, поэтому оно называется эмпирическим. Оно справедливо для всех реакций, кроме ферментативных и реакций третьего порядка. Т1 = 1000, Т2 = 1500, К1 = 6*10-4, К2 = 7.2*10-2. К2/ К1= γ∆Т/ 10 , 7.2*10-2/ 6*10-4= γ(150-100)/10 , γ = 2.6.
323.Т1=1200, Т2=1700, К1=5,9*10-4, К2=6,7*10-2. К2/ К1= γ∆Т/ 10 , 6,7*10-2/ 5,9*10-4= γ170-120/10 , γ = 2,6.
324. γ1 = 3, γ2 = 4, при температуре Т1 : К1/= К2/. При температуре Т2: К2// / К1//= 5. ∆Т -?
К2/ К1= γ∆Т/ 10 . К1// / К1/ = γ1 ∆Т/ 10 (1) . К2// / К2/ = γ2 ∆Т/ 10(2). Разделим выражение (1) на выражение (2), получим: К1// / К2// = (γ1 ∆Т/ 10) / (γ2 ∆Т/ 10). 1/5 = (3∆Т/ 10 ) / (4∆Т/ 10). ln5 + (∆Т / 10) *ln3 = (∆Т / 10) *ln4, ∆Т = 560.
325. Уравнение Аррениуса определяет
зависимость константы скорости
химической реакции от температуры.![]() ,
К = К0* е-Е а / RT
.
,
К = К0* е-Е а / RT
.
Т1 = 288К, К1= 3,1*10-4. Т2= 313 К, К2= 8,2*10-3.
ln(K2/K1) = Ea/R * (1/T1 - 1/T2).
ln(8,2*10-3/ 3,1*10-4) = Еа/ 8,31 * (1/288 - 1/313), следовательно, Еа= 98,14 кДж/моль.
326.Дополнительная энергия, необходимая для протекания между частицами химической реакции, называется энергией активации. Т1 = 673К, К1 = 2,2*10-4. Т2= 973 К, К2 = 8,33.ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(8,33 / 2,2*10-4) = Еа/ 8,31 * (1/673 - 1/973), Еа= 191,4 кДж/моль.
327. Еа= 100 кДж/моль Т1 = 273К, К1 = 2,0*10-2. Т2 = 373 К, К2 = ?.ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2/ 2,0*10-2) = 100000 / 8,31 * (1/273 - 1/373), К2= 2712.
328.а) 2NO=N2+O2, Еа= 290 кДж/моль Т1=300К, Т2=310 К, К2 / К1= ?.ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2/ К1) = 290000 / 8,31 * (1/300 - 1/310), К2 /К1= 43.
Б) 2NO+O2 = 2NО2, Еа= 10 кДж/моль Т1=300К, Т2=310 К, К2 / К1= ?.ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2/ К1) = 10000 / 8,31 * (1/300 - 1/310), К2 /К1= 1,14.
Изменение скоростей данных реакций не согласуется с правилом Вант-Гоффа.
329. ЕА1= 184 кДж/моль, ЕА2= 107 кДж/моль, пусть Т=400 К. К1= К0* е-Е А1 / RT
, К2= К0* е-Е А2 / RT
,![]()
![]() ,
К2 / К1 =1,15*1010 раз.
,
К2 / К1 =1,15*1010 раз.
330.
-
Процесс
Катализаторы
Синтез аммиака из N2 и Н2
Fe + K2O, Al2O3, MgO
Синтез спиртов из СО и Н2
ZnO-Cr2O3, CuO-ZnO- Cr2O3
Синтез углеводородов из СО и Н2
Fe, Ni, Co+MgO
Риформинг
Pt/Al2O3
Гидратация олефинов
H3PO4на носителях
Производство серной кислоты
Оксид ванадия (V)
Производство азотной кислоты
Платинородиевые сетки
Гидратация этилена
H3PO4 и H2SO4
Производство полиэтилена
Al(C2H5)3иTiCl4
Катализаторы используют для увеличения скорости реакции, повышения ее селективности, конверсии и выхода целевого продукта.
ЕА1= 200 кДж/моль, ЕА2= 100
кДж/моль, Т=400 К. К1= К0* е-Е
А1 / RT , К2= К0* е-Е А2 / RT
,![]()
![]() ,
К2 / К1 = 1,16*1013 раз.
,
К2 / К1 = 1,16*1013 раз.
331.С точки зрения химической термодинамики, химическое равновесие характеризуется постоянством концентраций веществ во времени. Согласно химической кинетике, равновесие определяется равенством скоростей прямой и обратной реакций.
А) N2(г) + 3H2(г) = 2NH3(г),
Б) Fe3O4+ 4CO(г) = 3Fe(к) + 4CO2(г),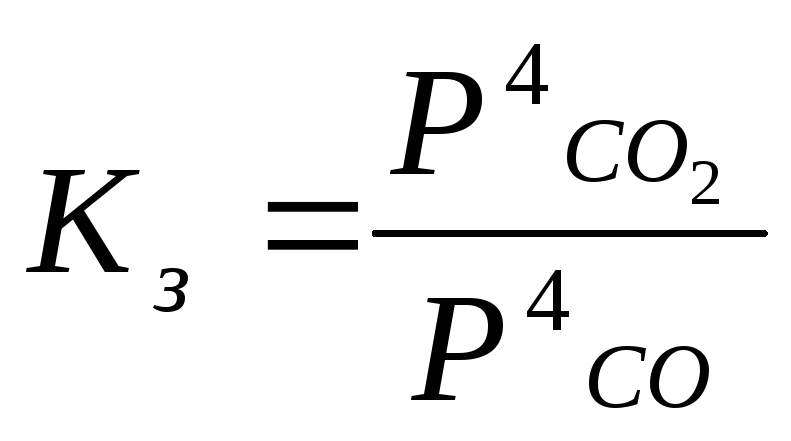
332. Константа химического равновесия - это отношение произведения концентраций продуктов химической реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
А) 4HCl+O2(г)= 2Cl2(г) + 2H2O(г),
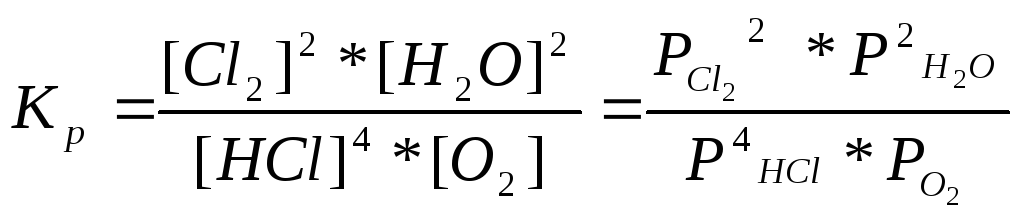
Б) CaO(k) +H2O(г) = Сa(OH)2(к),![]()
333.Состояние реакции, при котором концентрации веществ не изменяются во времени, называется равновесным. Основные признаки: если на реакцию, находящуюся в состоянии химического равновесия оказать воздействие, то система перейдет в новое равновесное состояние, уменьшающее это воздействие. Если воздействие снять, то реакция вернется к исходному состоянию.
А) CO(г) +H2O(г)
=CO2(г) +H2(г)![]()
Б) 2CuO(к) = 2Cu(к)
+O2(г)![]()
334.При истинном равновесии химическая реакция характеризуется постоянством концентраций всех веществ в течение сколь угодно долгого промежутка времени. При этом реакция подчиняется принципу Ле Шателье. При ложном химическом равновесии с течением времени концентрации веществ могут меняться, и реакция не подчиняется принципу Ле Шателье.
А) 3O2(г) = 2О3(г),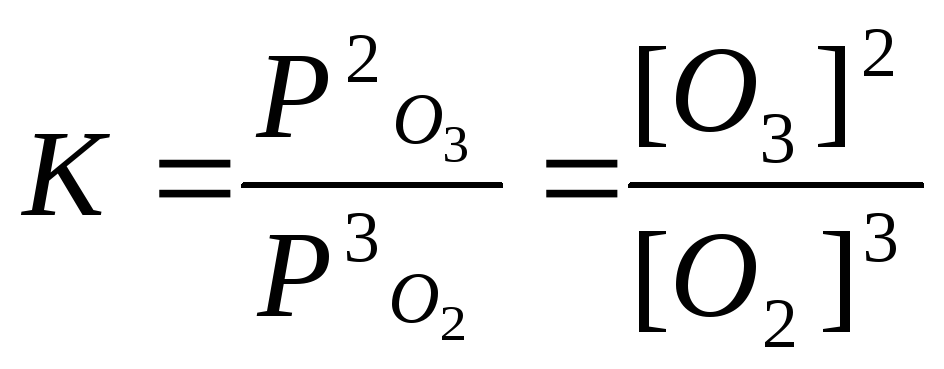
Б) Na2CO3(к) +CO2(г) +H2O(г)
= 2NaHCO3(к),![]()
335. Закон действующих масс: константа
равновесия химической реакции равна
отношению произведения концентраций
продуктов реакции к произведению
концентраций исходных веществ, взятых
в степенях, равных их стехиометрическим
коэффициентам: аА +bB=cC+dD,![]() .
.
А) N2(г) + О2(г) = 2NО(г),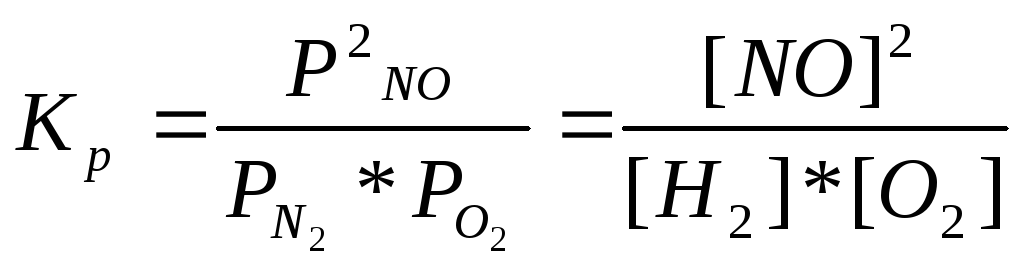 ,
,
Б) 3Fe(к) + 4H2O(г)
=Fe3O4(к)
+ 4H2(г),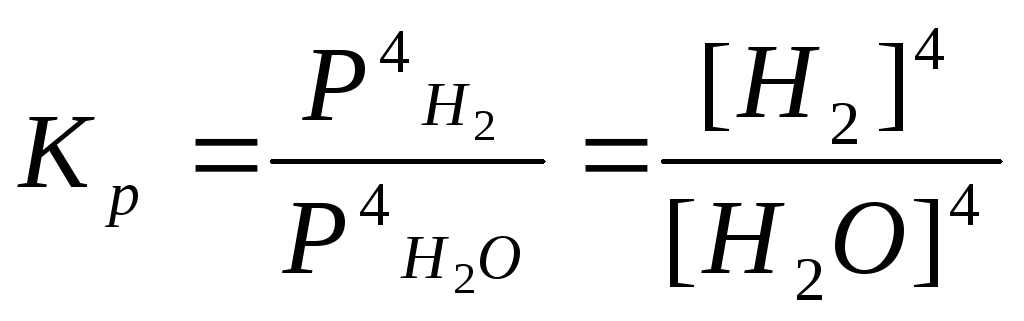 .
.
336.На величину константы химического равновесия влияют: природа реагирующих веществ, температура, давление.
А) Y2(г) +H2(г) = 2HY(г),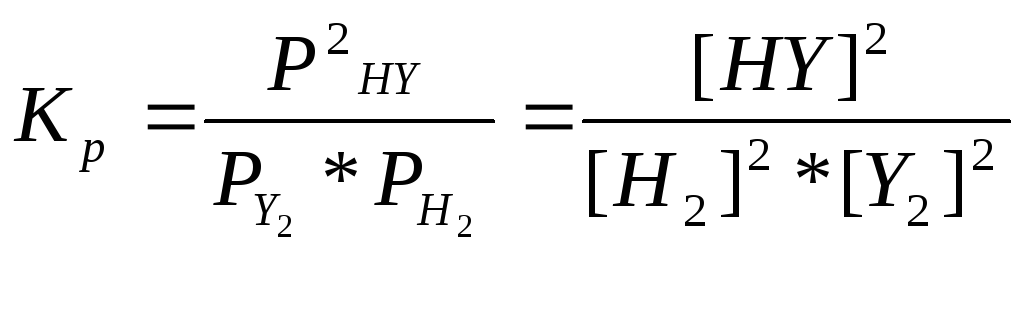 ,
,
Б) MgO(к) +CO2(г)
=MgCO3(к),![]() .
.
337.N2(г) + 3H2(г) = 2NH3(г),
-
Cисх.
х
у
0
Сравн.
3
9
4
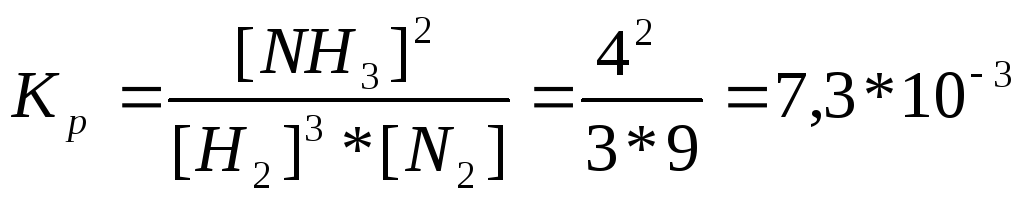 ,
Сисх. (N2) =
[N2] + 0,5[NH3]
= 3+ 0,5*4 = 5 моль/л.
,
Сисх. (N2) =
[N2] + 0,5[NH3]
= 3+ 0,5*4 = 5 моль/л.
Сисх(Н2) = [Н2] + 1,5[NH3] = 9 + 1,5*4 = 15 моль/л.
338. CO + Cl2 = COCl2
-
Cисх.
Х
у
0
Сравн.
0,2
0,3
1,2
![]() ,
Сисх. (Cl2) =
[Cl2] + [COCl2]
= 0,3 + 1,2 = 1,5 моль/л.
,
Сисх. (Cl2) =
[Cl2] + [COCl2]
= 0,3 + 1,2 = 1,5 моль/л.
Сисх(CO) = [CO] + [COCl2] = 0,2 + 1,2 = 1,4 моль/л.
339. CO + H2O = CO2 + H2
-
Cисх.
0,03
0,03
0
0
Сравн.
x
y
0,01
z
Согласно уравнению реакции, водорода
образуется столько же, сколько и СО2:
[CO2]=[H2]=0,01
моль/л. СО и Н2О израсходовалось
0,01 моль/л, следовательно [CO]=[H2O]=0,02
моль/л.![]()
![]() .
.
340. FeO(k) + CO = Fe(k) + CO2
-
Cисх.
-
0,05
-
0,01
Сравн.
-
0,05-x
-
0,01+x
![]() 0,01+x=0,025-0,5x,x=0,01.[CO] = 0,05 -
0,01 = 0,04 моль/л.
[CO2]
= 0,01 + 0,01 = 0,02 моль/л.
0,01+x=0,025-0,5x,x=0,01.[CO] = 0,05 -
0,01 = 0,04 моль/л.
[CO2]
= 0,01 + 0,01 = 0,02 моль/л.
341.Br2(г) +H2(г) = 2HBr(г),
-
Cисх.
3
1
0
Сравн.
3-x
1-x
2x
![]() ,
3x2+ 4x- 3 = 0,x= 0,54.
,
3x2+ 4x- 3 = 0,x= 0,54.
[H2] = 3-0.54 = 2.46 моль/л, [Br2] = 1-0.54 = 0.46 моль/л, [HBr] = 2*0.54=1.08 моль/л.
w(H2)=(2.46/4)*100 %=61.5%, w(Br2)=(0.46/4)*100%=11.5%, w(HBr)=(1.08/4)*100%=27%.
342.N2O4(г) = 2NO2(г),
-
Cисх.
0.08
0
Сравн.
50%
X
Прореагировало 0.08*0.5 = 0.04 моль/л N2O4. Следовательно, образовалось 2*0.04 = 0.08 моль/лNO2 .
![]() .
.
343.Y2(г) +H2(г) = 2HY(г),
-
Cисх.
0.01
0.01
0
Сравн.
0.01-x
0.01-x
2x
К=40
![]() х
= 0.0076, [HY]=2*0.0076=0.015моль/л.
х
= 0.0076, [HY]=2*0.0076=0.015моль/л.
В=(0.015*100)/(2*0.01)=76%
344.Y2(г) +H2(г) = 2HY(г),
-
Cисх.
1
2
0
Сравн.
1-x
2-x
2x
К=50
![]() 46х2-150х + 100=0, х = 0.57, Теоретически может
образоваться 2 мольHY,
образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2
= 57 %.
46х2-150х + 100=0, х = 0.57, Теоретически может
образоваться 2 мольHY,
образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2
= 57 %.
345.2HY(г) =Y2(г) +H2(г)
-
Cисх.
1
0
0
Сравн.
1-2x
x
x
К = 2*10-2
![]() х
= 0.11, разложилось 2*0.11 = 0.22мольHY,
степень разложения 22 %.
х
= 0.11, разложилось 2*0.11 = 0.22мольHY,
степень разложения 22 %.
346.Cl2(г) = 2Cl(г)
-
Cисх.
0.04
0
Сравн.
0.04-x
2x
К=4.2*10-4
![]() 4х2+ 4.2*10-4х -1.68*10-5= 0, х = 0.002,
степень атомизации хлора равна
(002/0.04)*100 % = 5 %.
4х2+ 4.2*10-4х -1.68*10-5= 0, х = 0.002,
степень атомизации хлора равна
(002/0.04)*100 % = 5 %.
347. CO + H2O = CO2 + H2
|
Cисх. |
1 |
1 |
0 |
0 |
|
Сравн. |
1-x |
1-х |
х |
х |
К=1.
348.PCl5 =PCl3+Cl2
-
Cисх.
0.3
0
0
Сравн.
0.3-x
х
х
К=125.
![]() ,
х2+ 125х - 37.5 = 0, х = 0.299. РазложилосьPCl5: (0.299/0.3)*100% = 99.76
%.
,
х2+ 125х - 37.5 = 0, х = 0.299. РазложилосьPCl5: (0.299/0.3)*100% = 99.76
%.
349. Принцип Ле Шателье: при оказании внешнего воздействия на реакцию, находящуюся в состоянии равновесия, ее равновесие смещается к состоянию, уменьшающему это воздействие. А) 2CO(г) + О2(г) = 2СО2 (г), ΔН0= -566 кДж/моль. Т.к. реакция экзотермическая, то при понижении температуры ее равновесие сместится вправо; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо. Б)N2(г) +O2(г) = 2NO(г), ΔН0= 180 кДж/моль. Т.к. реакция эндотермическая, то при понижении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции равно количеству газообразных исходных веществ, то повышение давления на равновесие не влияет.
350.При оказании внешнего воздействия на систему, находящуюся в состоянии равновесия, положение равновесия смещается к состоянию, уменьшающему это воздействие. А) 2H2(г) +O2(г) = 2H2O(г), ΔН0= - 483.6 кДж/моль. Т.к. реакция экзотермическая, то при повышении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при понижении давления равновесие сместится вправо. Б)CaCO3(k) =CaO(k) +CO2(г), ΔН0= 179,0 кДж/моль. Т.к. реакция эндотермическая, то при повышении температуры ее равновесие сместится вправо; т.к. газообразные вещества - продукты реакцииCO2 , то понижение давления сместит равновесие вправо.
351.N2(г) + 3H2(г) = 2NH3(г), ΔH0= -92.4 кДж/моль. а) реакция экзотермическая, поэтому при увеличении температуры равновесие сместится влево, а при понижении - вправо. Б) Т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо, а при понижении давления - влево. В) равновесие сместится вправо при повышении концентрации азота и водорода и понижении концентрации аммиака, при повышении концентрации аммиака и понижении концентрации азота и водорода равновесии сместится влево. Г) введение промоторов не смещает положение равновесия . д) Поглощение аммиака сместит равновесие вправо, а поглощение азота и водорода - влево. Е) введение инертного газа аналогично повышению давления.
352. 4HCl(г) +O2(г) = 2Cl2(г) + 2H2O(г), ΔH0= -116.4 кДж/моль. а) равновесие сместится в сторону исходных веществ при повышении температуры, уменьшении давления, увеличении концентрации хлора и воды, понижении концентрации кислорода и соляной кислоты. Б) равновесие сместится в сторону продуктов при понижении температуры, увеличении давления, уменьшении концентрации хлора и воды, увеличении концентрации кислорода и соляной кислоты.
353. 3Fe(к) + 4H2O(г) =Fe3O4(к) + 4H2(г), ΔH0= -49,9 кДж/моль. Для увеличения выхода водорода необходимо понизить температуру, т. к. реакция протекает с выделением тепла. Давление не влияет на положение равновесия, т.к. количество газообразных продуктов равно количеству газообразных исходных веществ.
354.MgO(k) +CO2(г) =MgCO3(к), ΔH0= -111,7 кДж/моль. ПоглощениеCO2будет происходить при понижении температуры и повышении давления. Восстановление поглотителя будет протекать при повышении температуры и понижении давления.
355. CaO + H2O = Ca(OH)2.
ΔH0 = -986.6+635.5+241.8 = -109.3 кДж/моль. ΔS0= 76.1-39.7-188.7 = -152.3 Дж/(K*моль)
ΔG0= ΔH0- Т * ΔS0. ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT
а) Т = 300 К. ΔG0= -109.3 + 300*152.3*10-3= -63.61 кДж/моль. Кр= 1.2*1011
б) Т = 1000 К. ΔG0= -109.3 + 1000*152.3*10-3= 43 кДж/моль. Кр= 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие экзотермической реакции смещается влево.
356. N2O3 = NO + NO2.
ΔH0= 90.2 + 33.5 - 83.3 = 40.4 кДж/моль. ΔS0= 210.6 + 240.2 - 178.2 = 272.6 Дж/(K*моль)
ΔG0= ΔH0- Т * ΔS0. ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT
а) Т = 00C= 273 К. ΔG0= 40.4 - 273*272.6*10-3= -34.0 кДж/моль. Кр= 3.3*106
б) Т = 373 К. ΔG0= 40.4 - 373*272.6*10-3= -61.3 кДж/моль. Кр= 3.9*108
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
357. 2H2O= 2H2 + О2.
ΔH0 = 2*241.8 = 483.6 кДж/моль. ΔS0= 2*130.5 - 205 - 2*188.7 = -321.4 Дж/(K*моль)
ΔG0= ΔH0- Т * ΔS0. ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT
а) Т = 500 К. ΔG0= 483.6 + 500*321.4*10-3= 644.3 кДж/моль. Кр= 4.5*10-68
б) Т = 1000 К. ΔG0= 483.6 + 1000*321.4*10-3= 805 кДж/моль. Кр= 8.5*10-43
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
358. ZnO + H2 = Zn + H2O.
ΔH0 = -241.8 + 350.6 = 108.8 кДж/моль. ΔS0= 41.6 + 188.7 - 43.6 - 130.5 = 56.2 Дж/K*моль
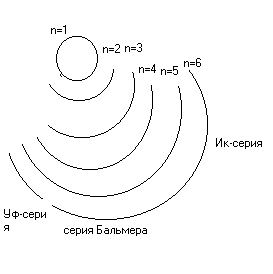
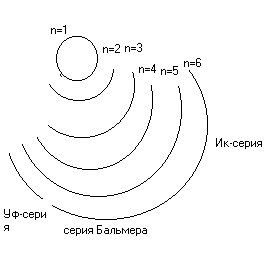
ΔG0= ΔH0- Т * ΔS0. ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT
а) Т = 300 К. ΔG0= 108.8 - 300*56.2*10-3= 91.94 кДж/моль. Кр= 9.6*10-17
б) Т = 1000 К. ΔG0= 108.8 - 1000*56.2*10-3= 52.6 кДж/моль. Кр= 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
359. FeO + H2 = Fe +H2О.
ΔH0 = -241.8 + 264.8 = 23 кДж/моль. ΔS0= 27.3 + 188.7 - 60.8 -130.5 = 24.7 Дж/(K*моль)
ΔG0= ΔH0- Т * ΔS0. ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT
а) Т = 500 К. ΔG0= 23 - 500*24.7*10-3= 10.65 кДж/моль. Кр= 0.077
б) Т = 1000 К. ΔG0= 23 - 1000*24.7*10-3= -1.7 кДж/моль. Кр= 1.23
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
360. 2HI = H2 + I2.
ΔH0 = 2*26.6 = 53.2 кДж/моль. ΔS0= 130.5 + 116.2 - 2*206.5 = -166.3 Дж/(K*моль)
ΔG0= ΔH0- Т * ΔS0.
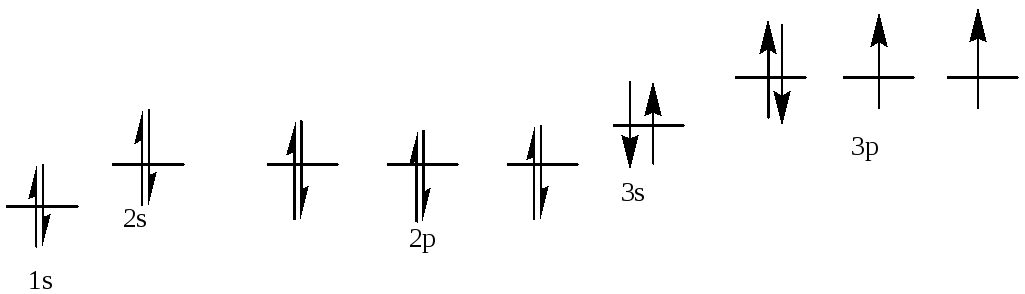
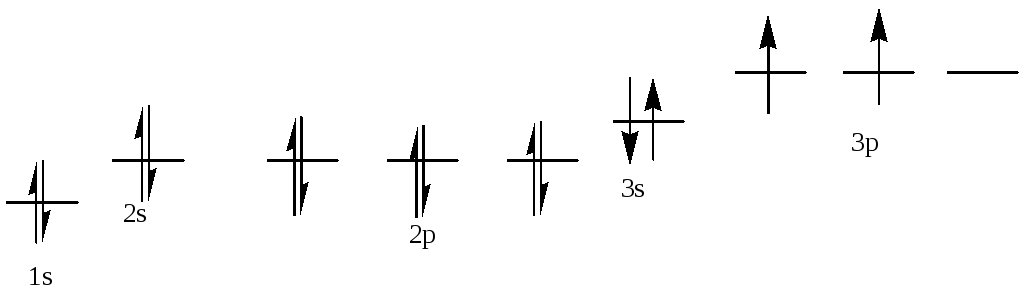
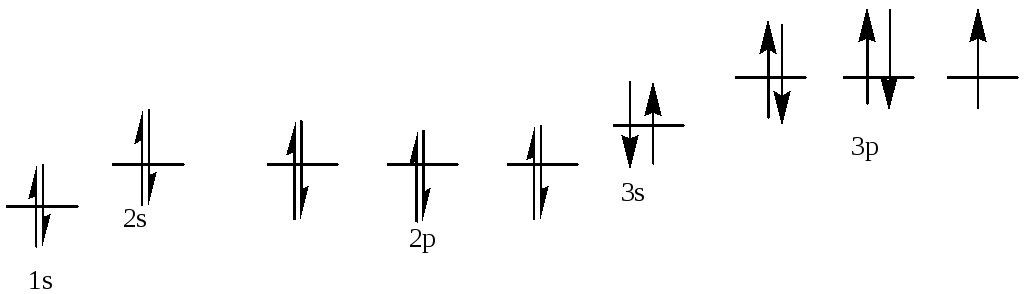
Т = 400 К. ΔG0= 53.2 + 400*166.3*10-3= 119.7 кДж/моль.
ΔG0= -R*T*lnKp=>Kp=e-ΔG/RT=> Кр= 2.2*10-16
Согласно закону Оствальда Кр=![]() .
Т.к. константа равновесия очень мала,
то можно пренебречь знаменателем. Тогда
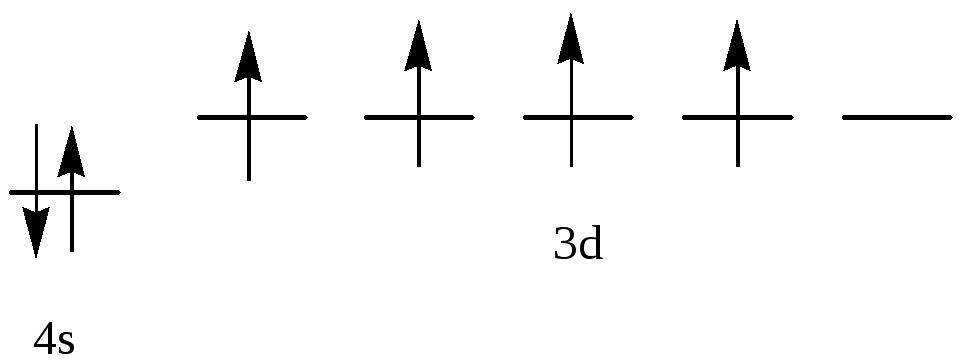
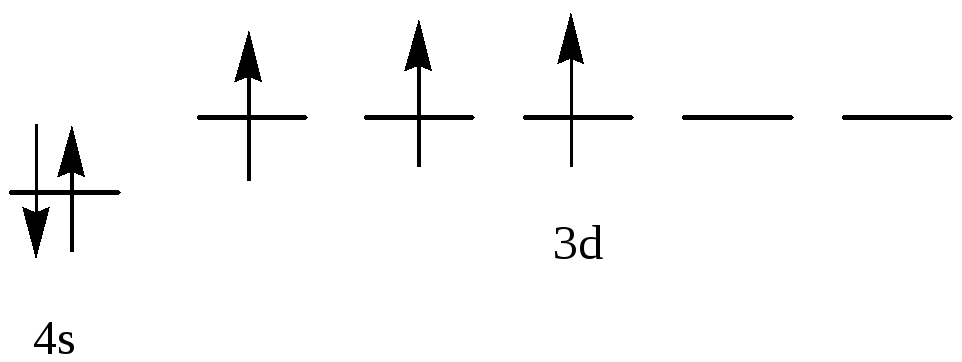
.
Т.к. константа равновесия очень мала,
то можно пренебречь знаменателем. Тогда![]() =
4.8*10-5 %. К данному расчету принцип
Ле-Шателье применить нельзя, т.к. не
рассматривается смещение равновесия.
=
4.8*10-5 %. К данному расчету принцип
Ле-Шателье применить нельзя, т.к. не
рассматривается смещение равновесия.
361. В состав атома входят протоны и нейтроны (они образуют ядро атома) и электроны. Протоны являются носителями положительного заряда, их количество определяет величину заряда ядра и атомный номер химического элемента, масса покоя протона: 1,673*10-27кг, заряд: 1,602*10-19Кл. Электроны - носители отрицательного заряда, масса покоя электрона: 9,109*10-31кг, заряд: 1,602*10-19Кл. Нейтроны - нейтральные частицы (заряд равен нулю), масса покоя: 1,675*10-27кг.
362.
|
Частица |
символ |
Масса покоя, кг |
Относительная масса, а.е.м. |
Заряд, Кл |
|
протон |
p |
1,673*10-27 |
1,007276 |
1,602*10-19 |
|
нейтрон |
n |
1,675*10-27 |
1,008665 |
0 |
|
электрон |
e |
9,109*10-31 |
0,000549 |
1,602*10-19 |
363.Согласно модели Резерфорда, атом состоит из ядра, в котором сосредоточена основная масса атома, и электронов, движущихся на относительно большом расстоянии от ядра. Однако эта модель противоречила факту устойчивого существования атомов: в результате движения электроны расходуют энергию притяжения с ядром, и через 10-8секунды они должны упасть на ядро. Кроме того, электроны теряют энергию за счет излучения, образующего сплошной спектр, что также противоречило фактам: все атомные спектры имеют линейчатый характер.
В 1913 г. Бор предложил теорию строения водородного атома. Основными отличиями от предыдущей теории были следующие: электроны двигаются по строго определенным орбитам, до тех пор пока электрон находится на этой орбите, он не излучает. При переходе электрона с одной орбиты на другую выделяется энергия, что объясняет происхождение атомных спектров. Однако, теория Бора не пригодна к описанию строения сложных атомов.
Современная теория строения атома включает в себя квантово-механические представления: наличие у электрона свойств волны и частицы, невозможность одновременного определения координаты и импульса микрочастицы, применение волновой функции ψ для описания свойств электрона.
365.Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса хлора равна А(Cl) = 35*75.53%/100% + 37*24.47%/100% = 35.49 а.е.м.
366.Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса меди равна А(Cu) = 63*73%/100% + 65*27%/100% = 63.54 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии.
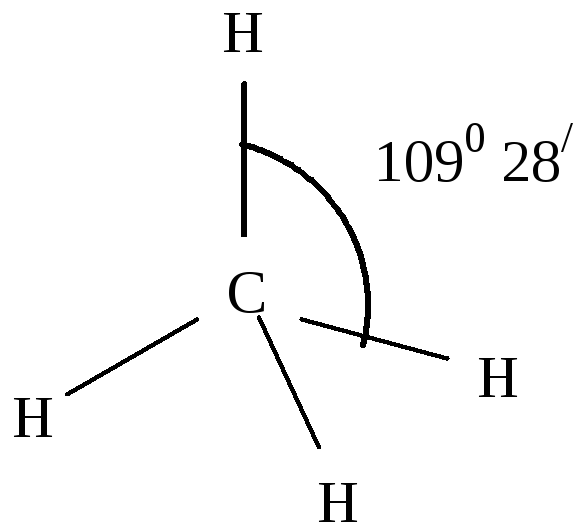
367. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса урана равна А(U) = 234*0.0058%/100% + 235*0.715%/100% + 238*99.28%/100% = 237.98 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии.
368. Процессы взаимодействия ядер
одних элементов с ядрами других элементов
или с элементарными частицами, при
которых образуются ядра новых элементов,
получили название ядерных реакций.
Ядерные реакции отличаются от химических
тем, что в химических реакциях не
происходит изменения ядерного состава.
На Солнце протекает много ядерных
реакций по суммарной схеме: 4р = α + 2е++ 565 млн. ккал. Искусственно впервые
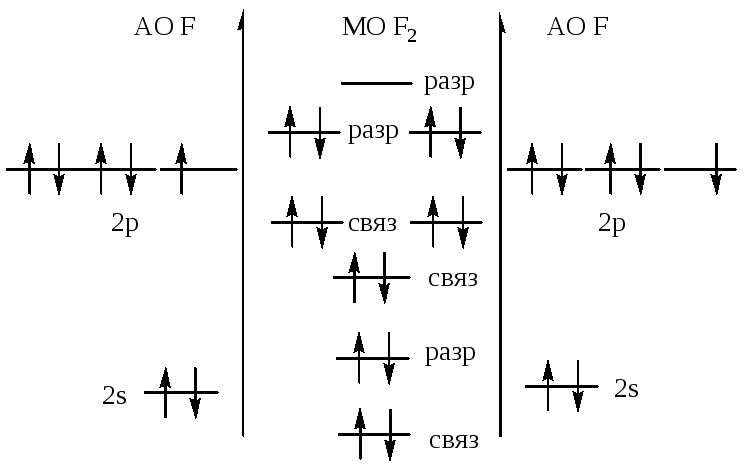
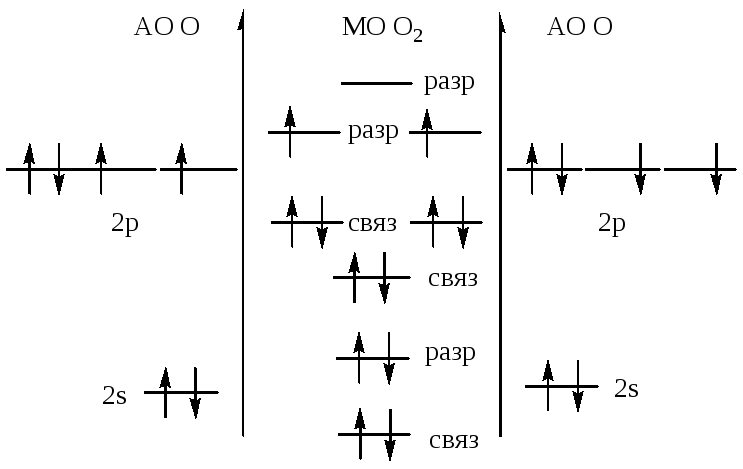
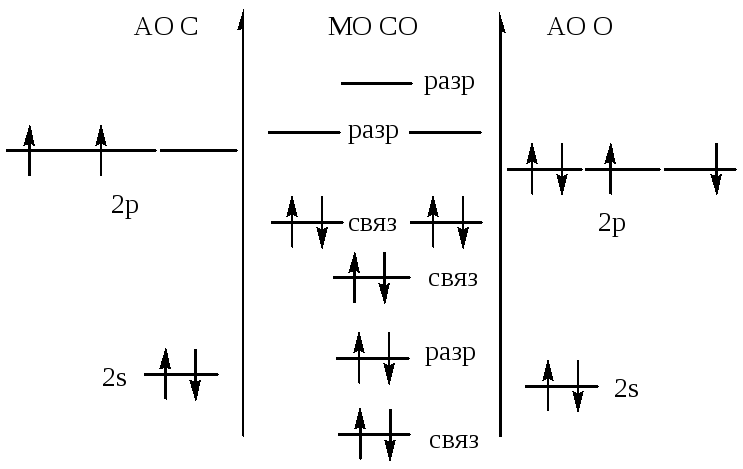
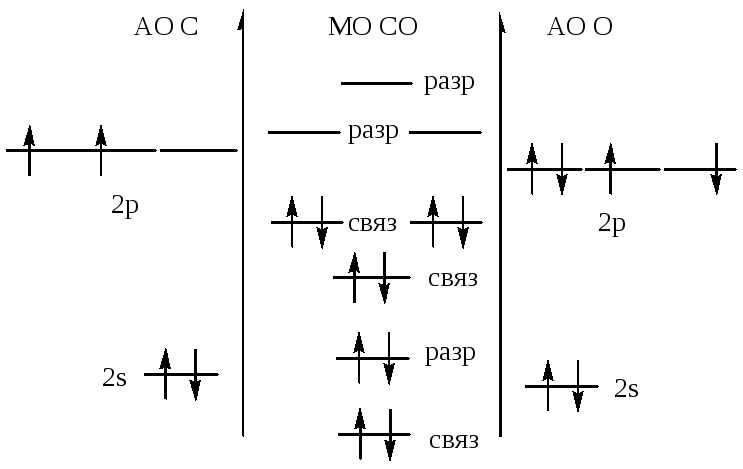
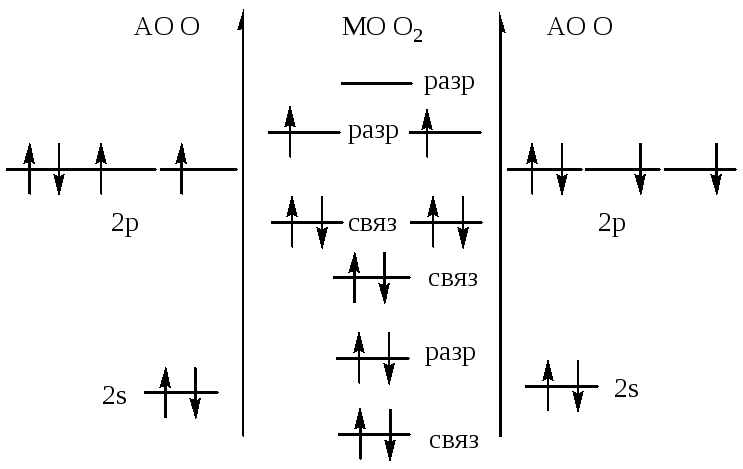
осуществил ядерную реакцию Резерфорд
(1919):![]() .
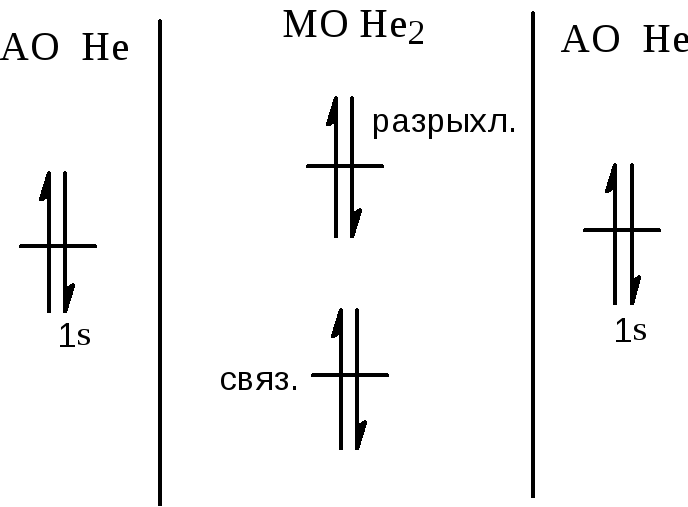
В 1933 году Ирен и Фредерик Жолио-Кюри
осуществили ядерную реакцию:
.
В 1933 году Ирен и Фредерик Жолио-Кюри
осуществили ядерную реакцию:![]()
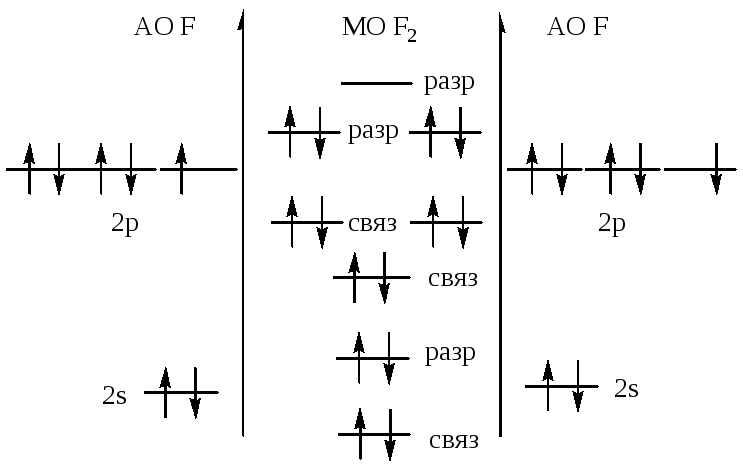
369.![]()
370. ![]()
371.Спектры химических элементов получают путем сообщения атомам энергии, например в виде квантов света. При этом происходит возбуждение и переход электронов на более удаленные орбитали, возвращаясь с которых, они излучают. Таким образом получается линейчатый спектр испускания. Спектры имеют линейчатый вид, поскольку все переходы электронов дискретны, т.е. прерывисты. Спектр водорода состоит из трех серий: УФ - серии, серии Бальмера (видимый спектр) и ИК - серии. Перескокам с удаленных орбит на орбиту сn=1 соответствуют линии серии, лежащей в УФ-области, перескокам на орбиту сn=2 - линии серии Бальмера, перескокам на орбиты сn=3, 4, 5
|
|
372.
|
|
Серим Лаймана соответствуют переходы с более удаленных орбиталей на орбиту с n=1. Серии Бальмера - переходы на n=2. Серии Пашена - переходы на орбиты с n=3,4,5. |
373.Для расчета энергии возбуждения
электрона с одного уровня на другой
используется уравнение:![]() .
Энергия перехода с 1 на 2 уровень равна
44 ккал/г-атом, Энергия перехода с 1 на 5
уровень равна 70 ккал/г-атом.
.
Энергия перехода с 1 на 2 уровень равна
44 ккал/г-атом, Энергия перехода с 1 на 5
уровень равна 70 ккал/г-атом.
374.а)Принцип квантования и дискретности энергии: электрон не изменяет энергию непрерывно, переходя с одной орбиты на другую, изменение энергии электрона происходит скачкообразно. Т.е. энергетические состояния электрона в атоме дискретны.
б) Корпускулярно-волновая двойственность: электрон имеет свойства как частицы, так и волны.
в) Принцип неопределенности: нельзя одновременно и точно определить скорость электрона и его координаты.
Таким образом, электрон в атоме вращается по определенным орбитам с дискретной энергией. Поглощение или выделение энергии происходит только при переходе электрона с одной орбиты на другую.
375.Квантовая механика изучает движения и взаимодействия микрочастиц. Она основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном методе описания микрообъектов. Основным уравнением квантовой механики является волновое уравнение Шредингера, которое связывает волновую функцию с потенциальной полной энергией электрона. Волновые функции, получаемые решением этого уравнения, описывают орбитали.
376.Совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел называют атомной орбиталью.

377. а)Главное квантовое число (n)соответствует номеру энергетического слоя, в котором находится электрон.
б) Орбитальное квантовое число (l)определяет форму орбитали, форму электронного облака.
в) Магнитное квантовое число (m)определяет пространственную ориентацию орбиталей.
г) Спиновое квантовое число (s)определяет направление собственного вращения электрона.
378.Энергию электрона определяют главное, спиновое и магнитное квантовые числа. Наиболее существенно зависит энергия электрона от главного квантового числа, наименее - от магнитного. Магнитное квантовое число влияет на энергию электронов в пределах одного подуровня.
379.Энергетический уровень - набор атомных орбиталей с одинаковым значением главного квантового числа (n). Энергетический подуровень - набор атомных орбиталей с одинаковым значением орбитального квантового числа (l) внутри данного энергетического уровня. Число энергетических подуровней для данного энергетического уровня равно 2n2. Если энергетический уровень расщеплен на 4 подуровня, тоn=2.
380. Электронный слой - это совокупность электронов с одинаковым значением главного квантового числаn. В электронном слое сn= 1 наибольшее количество содержащихся электронов - 2, вn= 2 - 8 электронов, вn= 3 - 18 электронов, вn= 4 - 32 электрона, вn= 5 - 50, вn= 6 - 72, вn= 7 - 98. Максимально теоретически допустимое количество электронов в слое равно 2n2.
381.Форму орбитали в пространстве
определяет побочное квантовое числоL.Lпринимает
значения от 0 до (n- 1).
ЗначениюL=0 отвечает
сферическая форма орбитали:![]() .
ЗначениюL=1 отвечает
гантелеобразная форма орбитали:
.
ЗначениюL=1 отвечает
гантелеобразная форма орбитали:![]() .
Расположение орбиталей в пространстве
определяет магнитное квантовое числоML.
Например: гантелеобразные р-облака
могут располагаться в пространстве
тремя видами:
.
Расположение орбиталей в пространстве
определяет магнитное квантовое числоML.
Например: гантелеобразные р-облака
могут располагаться в пространстве
тремя видами: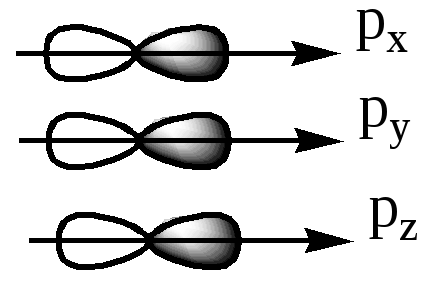
![]() .
Размер орбиталей определяется главным
квантовым числомn. Чем
большеn, тем дальше
внешние электроны находятся от ядра и
тем больше электронное облако.
.
Размер орбиталей определяется главным
квантовым числомn. Чем
большеn, тем дальше
внешние электроны находятся от ядра и
тем больше электронное облако.
382. Число атомных орбиталей (AO) определяется магнитным квантовым числомML., оно равно (2L+ 1). Так, наs-подуровне количествоAOравно 1, т.к. дляs-подуровняL=0. на р-подуровне числоAOравно 3, т.к.L=1. Наd-подуровне числоAOравно 5, т.к.L= 2.
383.S-электронное облако имеет форму шара. Оно обладает сферической симметрией. Р-облако имеет гантелеобразную форму и обладает осевой симметрией.D-облака имеют форму скрещенных гантелей и осевую симметрию.
384. Фосфор, № 15. 1s22s22p63s23p3. Атом фосфора имеет в нормальном состоянии 3 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s-подуровня распариваются, и один из них переходит на вакантную орбитальd-подуровня, образуя при этом 5 неспаренных электронов.
|
|
валентные электроны |
n |
L |
ML |
S |
|
3s |
3 |
0 |
0 |
+1/2 | |
|
3s |
3 |
0 |
0 |
-1/2 | |
|
3p |
3 |
1 |
+1 |
+1/2 | |
|
3p |
3 |
1 |
0 |
+1/2 | |
|
3p |
3 |
1 |
-1 |
+1/2 |
385. Сера, № 16. 1s22s22p63s23p4. Атом серы имеет в нормальном состоянии 2 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s- и 3р-подуровней могут распариваться, и переходить на вакантные орбиталиd-подуровня, образуя при этом 4 или 6 неспаренных электронов.
|
|
Элек-троны |
3s |
3p
| ||||||
|
Кв. числа | |||||||||
|
N |
3 |
3 |
3 |
3 |
3 |
|
3 |
| |
|
L |
0 |
0 |
1 |
1 |
1 |
|
1 |
| |
|
M |
0 |
0 |
-1 |
-1 |
0 |
|
+1 |
| |
|
S |
1/2 |
-1/2 |
1/2 |
-1/2 |
1/2 |
|
1/2 |
| |
386. Алюминий, № 13. 1s22s22p63s23p1. Атом алюминия имеет в нормальном состоянии 1 неспаренный электрон на 3р-подуровне. При возбуждении электрон с 3s-подуровня может распариться, и перейти на вакантную орбиталь 3d-подуровня, образуя при этом 3 неспаренных электрона.
|
|
Элек-троны |
3s |
3p
| ||||||
|
Кв. числа | |||||||||
|
N |
3 |
3 |
3 |
|
|
|
|
| |
|
L |
0 |
0 |
1 |
|
|
|
|
| |
|
M |
0 |
0 |
-1 |
|
|
|
|
| |
|
S |
1/2 |
-1/2 |
1/2 |
|
|
|
|
| |
387. Кремний, № 14. 1s22s22p63s23p2. Атом кремния имеет в нормальном состоянии 2 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s-подуровня могут распариваться, и переходить на вакантные орбиталиd-подуровня, образуя при этом 4 неспаренных электрона.
|
|
Элек-троны |
3s |
3p
| ||||||
|
Кв. числа | |||||||||
|
N |
3 |
3 |
3 |
|
3 |
|
|
| |
|
L |
0 |
0 |
1 |
|
1 |
|
|
| |
|
M |
0 |
0 |
-1 |
|
0 |
|
|
| |
|
S |
1/2 |
-1/2 |
1/2 |
|
1/2 |
|
|
| |
388. Хлор, № 17. 1s22s22p63s23p5. Атом хлора имеет в нормальном состоянии 1 неспаренный электрон на 3р-подуровне. При возбуждении электроны с 3s- и 3р-подуровней могут распариваться, и переходить на вакантные орбиталиd-подуровня, образуя при этом 3, 5 или 7 неспаренных электронов.
|
|
Элек-троны |
3s |
3p
| ||||||
|
Кв. числа | |||||||||
|
N |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
| |
|
L |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
| |
|
M |
0 |
0 |
-1 |
-1 |
0 |
0 |
+1 |
| |
|
S |
1/2 |
-1/2 |
1/2 |
-1/2 |
1/2 |
-1/2 |
1/2 |
| |
389. Хром, № 24. 1s22s22p63s23p64s23d4. Атом хрома имеет в нормальном состоянии 4 неспаренных электрона на 3d-подуровне. При возбуждении электроны с 4s-подуровня могут распариваться, и переходить на вакантные орбитали 3d-подуровня, образуя при этом 6 неспаренных электронов.
|
|
Электроны |
4s |
3d
| ||||||||||
|
Квантовые числа | |||||||||||||
|
N |
3 |
3 |
3 |
|
3 |
|
3 |
|
3 |
|
|
| |
|
L |
0 |
0 |
2 |
|
2 |
|
2 |
|
2 |
|
|
| |
|
M |
0 |
0 |
-2 |
|
-1 |
|
0 |
|
+1 |
|
|
| |
|
S |
0.5 |
-0.5 |
0.5 |
|
0.5 |
|
0.5 |
|
0.5 |
|
|
| |
390. Ванадий, № 23. 1s22s22p63s23p64s23d3. Атом ванадия имеет в нормальном состоянии 3 неспаренных электрона на 3d-подуровне. При возбуждении электроны с 4s-подуровня могут распариваться, и переходить на вакантные орбитали 3d-подуровня, образуя при этом 5 неспаренных электронов.
|
|
Электроны |
4s |
3d
| ||||||||||
|
Квантовые числа | |||||||||||||
|
N |
3 |
3 |
3 |
|
3 |
|
3 |
|
|
|
|
| |
|
L |
0 |
0 |
2 |
|
2 |
|
2 |
|
|
|
|
| |
|
M |
0 |
0 |
-2 |
|
-1 |
|
0 |
|
|
|
|
| |
|
S |
0.5 |
-0.5 |
0.5 |
|
0.5 |
|
0.5 |
|
|
|
|
| |
391.Современная формулировка: Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра элементов.Формулировка Менделеева: свойства элементов находятся в периодической зависимости от их атомных весов. Изменение формулировки произошло в связи с работами Мозли (1912 г.), который показал, что истинной основой закона являются не атомные веса, а положительные заряды ядер атомов, численно выражаемые (ве-единицах) атомными номерами соответствующих элементов.
392.Менделеев предсказал существование трех элементов: галлий, скандий, германий. Свойства элементов, предсказанные Менделеевым совпали очень точно, например, для германия:
|
Предсказано Менделеевым (1871) |
Найдено Винклером (1886) |
|
Атомный вес ~72 Удельный вес ~5,5 Металл не вытесняет водород из кислот Оксид ЭО2 Удельный вес оксида 4.7 и др. |
72.6 5.35 металл не растворяется в HCl,H2SO4 GeO2 4.70 и др. |
393.В 1869 году истинную природу периодического изменения свойств элементов предсказать было невозможно, т.к. еще не была раскрыта структура атома. В настоящее время периодичность изменения свойств элементов связывается с ростом положительных зарядов ядер атомов. Поскольку атом электронейтрален, с ростом положительного заряда ядра увеличивается количество электронов, окружающих атом. Электроны заполняют оболочку последовательно - при этом свойства элементов также периодически изменяются.
394.Атомный номер элемента совпадает с количеством протонов в ядре атома элемента. С ростом атомного номера увеличивается положительный заряд ядра. Соответственно, увеличивается количество электронов, окружающих ядро. Электроны заполняют оболочку вокруг ядра строго последовательно. В связи с этим свойства атомов изменяются периодически.
395.Периодическая система является по отношению к периодическому закону графической формой. ПС содержит в себе громадное количество информации как явной, так и скрытой. Каждый вариант ПС - это способ наглядно представить ту или иную группу периодических свойств элементов. Короткопериодный вариантудобен своей компактностью. В нем наглядно показано как и почему различные элементы объединены в главные и побочные подгруппы. Однако, в короткопериодном варианте периодической системы нелогично разнесены в разные части таблицыd-металлы, разделенные группой благородных газов. Длиннопериодный вариант ПСнаглядно представляет периоды, т.к.d-металлы находятся в логичном для них месте. Однако, в длиннопериодном варианте не ясно отражена связь между главными и побочными подгруппами элементов.
396.Короткопериодный вариантудобен своей компактностью. В нем наглядно показано как и почему различные элементы объединены в главные и побочные подгруппы. Однако, в короткопериодном варианте периодической системы нелогично разнесены в разные части таблицыd-металлы, разделенные группой благородных газов.
Длиннопериодный вариант ПСнаглядно представляет периоды, т.к.d-металлы находятся в логичном для них месте. Однако, в длиннопериодном варианте не ясно отражена связь между главными и побочными подгруппами элементов.
397.Являющаяся наглядным выражением периодического закона, система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Группы периодической системы объединяют входящие в них элементы по признаку химического сродства. Из них восьмая включает в себя инертные газы, а триады содержат только элементы, относящиеся к большим периодам. В каждой из остальных групп имеются по две подгруппы элементов больших периодов.
398.Элементы одного периода объединяет то, что их внешние (валентные) электроны находятся в одном электронном слое. Элементы одной группы сходны в количестве валентных электронов. Элементы одной группы, но разных подгрупп различаются тем, что они относятся к разным семействам. У элементов одного семейства общим является то, что последний электрон у атомов этих элементов находится на орбиталях с одинаковым орбитальным квантовым числом (l).
399.Периодическая система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Группы периодической системы объединяют входящие в них элементы по признаку химического сродства. Из них восьмая включает в себя инертные газы, а триады содержат только элементы, относящиеся к большим периодам. В каждой из остальных групп имеются по две подгруппы элементов больших периодов. Т.о. емкость уровня совпадает с его заполненостью только для первого и второго периодов. В случае третьего и последующих периодов емкость больше количества элементов. Это связано со следующим явлением: из-за разницы в энергииd- иf-орбитали выталкиваются в верхние электронные слои.
400.Периодическая система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Число электронов в электронном слое определяется принципом Паули (в одном атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел).
Емкость уровня совпадает с его заполненостью только для первого и второго периодов. В случае третьего и последующих периодов емкость больше количества элементов. Это связано со следующим явлением: из-за разницы в энергии d- иf-орбитали выталкиваются в верхние электронные слои.
401.Число элементов в периоде определяется значением главного квантового числа: 2n2. Т.е. в седьмом периоде должно содержаться 98 элементов. Последний элемент должен иметь порядковый номер 86+14+10+6 = 116. Он будет являться аналогом радона.
402.Водород и гелий помещают соответственно в первую и вторую группы, т.к. они являются электронными аналогами соответствующих элементов. Однако, физико-химические свойства водорода и гелия более сходны с элементами, соответственно, седьмой и восьмой групп. Водород схож с галогенами по следующим признакам: газообразный, в свободном состоянии - димер. Гелий, как и благородные газы, чрезвычайно инертен.
403. До 1963г. благородные газы помещали в т.н. «нулевую группу», которая располагалась перед группой щелочных металлов. после определения точного строения электронной оболочки благородных газов, было выяснено, что она является не началом электронного слоя, а его завершением. Поэтому сейчас группу благородных газов помещают в последнюю восьмую группу.
404.Атомный номер элемента совпадает как с количеством протонов в ядре его атома, так и с числом электронов. Поскольку последовательность заполнения электронами электронных слоев известна, то, зная количество электронов, можно легко определить положение элемента в ПС.
Элемент №20: электронная формула - 1s22s22p63s23p64s2. Этоs-элемент, активный металл. В соединениях имеет положительную степень окисления +2. Формула оксида МеО, гидроксида Ме(ОН)2. Оксид и гидроксид имеют основные свойства и т.д.
Элемент №34: электронная формула - 1s22s22p63s23p64s23d104p4. Этоp-элемент, неметалл. В соединениях может иметь степени окисления -2, +2, +4, +6. Наиболее устойчивой является СО = +4. Формула оксида ЭО2, гидроксида Э(ОН)4. Оксид и гидроксид имеют амфотерные свойства и т.д.
405.Элемент №19: электронная формула 1s22s22p63s23p64s1. Четвертый период, первая группа, главная подгруппа. Этоs-элемент, активный металл. В соединениях имеет положительную степень окисления +1. Формула оксида Ме2О, гидроксида МеОН. Оксид и гидроксид имеют основные свойства и т.д.Элемент №35: электронная формула 1s22s22p63s23p64s23d104p5. Четвертый период, 7 группа, главная подгруппа. Этоp-элемент, неметалл. В соединениях может иметь степени окисления -1, +1, +3, +5, +7. Наиболее устойчивой является СО = -1. Формула гидрида НЭ, гидроксида НЭО1,3,5,7. Оксиды и гидроксиды имеют кислотные свойства и т.д.
406.Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Соответственно наименьший радиус имеет атом гелия, а наибольший - атом франция. При увеличении радиуса атома усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
407.Орбитальный радиус- радиус атома измеряемый от центра ядра до положения главного максимума плотности внешних электронных облаков.Ковалентный радиус- радиус атома в молекуле, построенной по типу ковалентной связи.Металлический радиус - радиус атома в металлической решетке.Эффективный радиус - практический радиус атома, связанного с другими атомами. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. При увеличении радиуса атома усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
408.Изменение ионизационного потенциала обратно пропорционально изменению атомного радиуса. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. по периодам ионизационный потенциал увеличивается, а по группам - уменьшается. При уменьшении ионизационного потенциала усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
409.Ионизационный потенциал и энергия ионизации - это количественные характеристики энергии отрыва электрона от атома. Ионизационный потенциал (ИП) измеряется в эВ, а энергия ионизации (ЭИ) в кДж/моль. ИП(Li) = 5.19 эВ, следовательно, ЭИ(Li) = 5.19*96486 = 500 кДж/моль. ЭИ(О) = 1313.0 кДж/моль, следовательно, ИП(О) = 1313.0/96.486 = 13.6 эВ. Радиус атома кислорода значительно меньше радиуса атома лития. Соответственно, взаимодействие внешних электронов с ядром в атоме кислорода выше, а значит выше и ИП кислорода. Можно сделать следующий вывод: чем выше ИП, тем сильнее выражены неметаллические свойства элемента.
410.На внешней орбите у атома бериллия находятся два электрона, близкие по энергии. Соответственно ионизационные потенциалы для этих электронов близки. В противоположность этому, первый и второй электроны атома лития расположены в различных электронных слоях. И, если первый электрон отрывается относительно легко, то второй электрон, находящийся гораздо ближе к ядру, оторвать значительно сложнее. Отсюда и разница в ионизационных потенциалах.
411. Атомы типичных металлов отличаются от атомов типичных неметаллов значительно большими радиусами, а значит у металлов меньше энергия ионизации, электроотрицательность и сродство к электрону. Металлы в большинстве - твердые (при н.у.) вещества, проводники, ковкие, пластичные и т.п. В соединениях металлы имеют только положительные степени окисления, в то время как неметаллы имеют как отрицательные, так и положительные СО. Амфотерные металлы, в отличие от типичных металлов, могут проявлять основные и кислотные свойства как в свободном состоянии, так и в соединениях. Металлические свойства зависят от радиуса атома. Чем больше радиус атома, тем сильнее выражены металлические свойства элемента. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. с увеличением порядкового номера по периодам металличность уменьшается, а по группам увеличивается.Неметаллы -хлор, кислород, гелий, кремний, углерод.Металлы- франций, натрий, уран, магний.Амфотерные металлы- алюминий, германий, олово, цинк.
412. Металлические свойства зависят от радиуса атома. Чем больше радиус атома, тем сильнее выражены металлические свойства элемента. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. по периодам металличность уменьшается, а по группам увеличивается.
413.Сродством к электрону называется энергия, выделяющаяся при присоединении электрона к электронейтральному атому. С ростом порядкового номера элемента сродство к электрону по периодам растет, а по группам уменьшается. Минимальное сродство к электрону имеют щелочные металлы и благородные газы. Максимальное сродство к электрону у галогенов.
414.Относительная электроотрицательность (ОЭО) - условная оценка способности атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов в соединении. С ростом порядкового номера элемента ОЭО по периодам растет, а по группам уменьшается. Минимальную ОЭО имеет франций, а максимальная ОЭО у атома фтора.
415. Максимальная валентность химических элементов зависит то количества внешних электронов. По периоду число валентных электронов растет - соответственно увеличивается максимальная валентность. По группам значение максимальной валентности не изменяется, т.к. не добавляется валентные электроны.
416.Если иметь в виду толькоs- иp-элементы, то для их оксидов по группам сверху вниз и по периодам справа налево усиливаются основные свойства и ослабевают кислотные свойства. Это происходит вследствие соответствующего изменения радиусов атомов центральных элементов в оксидах: чем больше радиус элемента, тем сильнее выражены его металлические свойства, тем более основными свойствами обладает его оксид.
Пример №1 (по третьему периоду):
Na2O+ 2HCl= 2NaCl+H2O;Na2O+KOH= реакция не протекает.
Al2O3 + 6HCl = 2AlCl3 + 3H2O ; Al2O3 + 6KOH =2K3AlO3 + 3H2O
Cl2O7+HCl= реакция не протекает ; Cl2O7+ 2KOH= 2KClO4+H2O.
Пример №2 (по третьей группе):
B2O3+HCl= реакция не протекает;B2O3+ 6KOH= 2K3BO3+ 3H2O.
Al2O3 + 6HCl = 2AlCl3 + 3H2O ; Al2O3 + 6KOH =2K3AlO3 + 3H2O
In2O3 + 6HCl = 2InCl3 + 3H2O ; In2O3 + KOH = реакция не протекает.
417.Если иметь в виду толькоs- иp-элементы, то для их гидроксидов по группам сверху вниз и по периодам справа налево усиливаются основные свойства и ослабевают кислотные свойства. Это происходит вследствие соответствующего изменения радиусов атомов центральных элементов в оксидах: чем больше радиус элемента, тем сильнее выражены его металлические свойства, тем более основными свойствами обладает его гидроксид.
Пример №1 (по третьему периоду):
NaOH+HCl=NaCl+H2O;NaOH+KOH= реакция не протекает
Al(OH)3 + 3HCl = AlCl3 + 3H2O ; Al(OH)3 + 3KOH =K3[Al(OH)6]
HClO4 + HCl = реакция не протекает ; HClO4 + KOH = KClO4 + H2O
Пример №2 (по третьей группе):
B(OH)3+HCl= реакция не протекает;B(OH)3+ 3KOH=K3BO3+ 3H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O ; Al(OH)3 + 3KOH =K3[Al(OH)6]
In(OH)3 + 3HCl = InCl3 + 3H2O ; In(OH)3 + KOH = реакция не протекает.
Э2O3 + 6HCl = 2ЭCl3 + 3H2O.
418.При переходе от одного периода к другому свойства оксидов и гидроксидовd-элементов меняются незначительно, либо остаются практически неизменными. Так, в ряду оксидов и гидроксидов скандия - иттрия - лютеция наблюдаются основные свойства: Э2О3+ КОН = реакция не протекает. У соответствующих соединений цинка - кадмия - ртути свойства изменяются от амфотерных до основных. ВHCl= реакция не протекает ; Э2O7+ 2KOH= 2KЭO4+H2O.
419.Диагональным сходством называется сходные свойства элементов находящихся на одной ряду оксидов и гидроксидов марганца - технеция - рения наблюдаются кислотные свойства: Э2O7+ диагонали в периодической таблице. Причиной этого эффекта является приблизительное равенство радиусов атомов соответствующих элементов. Примером диагонального сходства может служить идентичность некоторых свойств лития и магния: металлы, относительно хорошие комплексообразователи, образуют одинаково белые соли со значительной степенью ионности связи и т.п.
420.Полными электронными аналогами называются элементы, которые в любой степени окисления имеют подобную структуру внешнего и предвнешнего электронного уровня. Неполные электронные аналоги имеют подобную структуру внешнего и предвнешнего электронного уровня только в максимальной степени окисления. Сходство: в максимальной степени окисления полные и неполные электронные аналоги образуют химические соединения подобного стехиометрического состава. Эти соединения имеют схожие химические свойства (кислотность, основность, активность). В промежуточных степенях окисления полные и неполные электронные аналоги образуют сильно отличающиеся друг от друга соединения.
Химические элементы называются типическими, если они обладают свойствами, позволяющими отнести их только к какому-либо одному классу элементов. Именно отсутствие двойственности свойств, амфотерности отличает типические элементы от нетипических.
421.Связь называется ковалентной неполярной, если она осуществляется между атомами с одинаковой относительной электроотрицательностью (ОЭО). Если ОЭО атомов, образующих связь различается менее, чем на 2.1, то такая связь называется ковалентной полярной. В случае, если разница в ОЭО больше, чем 2.1, то связь называется ионной. Связь, образованная атомами металлов называется металлической.
|
Азот (N2) |
Ковалентная неполярная |
|
Железо (Fe) |
Металлическая |
|
Углекислый газ (CO2) |
Ковалентная полярная |
|
Фторид калия (KF) |
Ионная |
|
Фосфин (PH3) |
Ковалентная полярная |
|
Сульфат натрия (Na2SO4) |
Ионная + полярная |
|
Кремний (Si) |
Неполярная |
422.Связь называется ковалентной неполярной, если она осуществляется между атомами с одинаковой относительной электроотрицательностью (ОЭО). Если ОЭО атомов, образующих связь различается менее, чем на 2.1, то такая связь называется ковалентной полярной. В случае, если разница в ОЭО больше, чем 2.1, то связь называется ионной. Связь, образованная атомами металлов называется металлической.
|
Иодоводород (HI) |
Ковалентная полярная |
|
Никель (Ni) |
Металлическая |
|
Оксид кремния (SiO2) |
Ковалентная полярная |
|
Оксид магния (MgO) |
Ковалентная полярная |
|
Нитрат калия (KNO3) |
Ионная + полярная |
|
Фтор (F2) |
Ковалентная неполярная |
423.Химическая связь - взаимодействие атомов, обусловливающее образование химически устойчивой двух- или многоатомной системы. Три основные типа химической связи: ковалентная, ионная, металлическая.
|
Тип химической связи |
Атомы каких элементов вступают в связь |
Процессы в электронных оболочках атомов |
Образующиеся частицы и вещества |
Примеры |
|
Ковалентная |
Любых |
Образование электронных пар. Незначительная деформация |
Молекулы, кристаллы |
N2, H2O, FeCl3 |
|
Ионная |
Любых |
Образование электронных пар, сильно притянутых к одному из атомов. Значительная деформация оболочек |
Молекулы, кристаллы имеющие на некоторых атомах частичные заряды ( + и -) |
NaF, KCl, CsF |
|
Металлическая |
Атомы металлов |
Делокализация валентных электронов. |
Металлическая решетка, в узлах которой находятся атомы металлов |
Fe, Ni, Cu. |
424.В рядуHF-HCl-HBr-HIпроисходит увеличение длины связи вследствие увеличения радиуса атомов галогенов в рядуF-Cl-Br-I, поскольку происходит добавление новых электронных слоев.
425.В рядуH2O-H2S-H2Se-H2Teпроисходит увеличение длины связи вследствие увеличения радиуса атомов элементов в 6 группе от кислорода к теллуру вследствие добавления электронных слоев.
426.В ряду С2Н6-С2Н4-С2Н2происходит уменьшение длины связи, т.к. между атомами углерода происходит увеличение кратности связи. Так, у этана кратность связи равна 1, у этилена -2, у ацетилена -3.
427.В рядуHF-HCl-HBr-HIпроисходит уменьшение энергии связи, поскольку увеличивается радиус атома галогенов от фтора к йоду. Чем больше радиус атома, тем меньше нужно затратить энергии, чтобы разрушить молекулу.
428.В ряду СF4- СCl4- СBr4- СI4происходит уменьшение энергии связи, поскольку увеличивается радиус атома галогенов от фтора к йоду. Чем больше радиус атома, тем меньше нужно затратить энергии, чтобы разрушить молекулу.
429.В ряду С2Н2 - С2Н4 - С2Н6 происходит уменьшение энергии связи, т.к. между атомами углерода происходит уменьшение кратности связи. Так, у этана кратность связи равна 1, у этилена -2, у ацетилена -3. Чем больше кратность связи, тем прочнее молекула, тем больше нужно затратить энергии для ее разрушения.
430.Валентным углом называется угол
между линиями связи (линия связи - линия,
проходящая через центры ядер атомов)![]() ,
, ,
, .
.
431.Теория валентных связей исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Т.е. химическая связь локализована между двумя атомами: она двуцентровая и двухэлектронная.
А том
хлора имеет один неспаренный электрон,
соответственно между двумя атомами
хлора и между хлором и водородом может
образоваться только одна связь за счет
образования одной обобществленной
электронной пары:Cl3s2
3p5,H1s1=>Сl-Cl,
H-Cl.Валентные возможности атома азота
ограничены тремя неспаренными
электронами, поэтому с атомами кислорода
в молекуле азотной кислоты азот связан
как бы полуторными связями. Стехиометрическая
валентность азота равна 5, степень
окисления = +5, электронная валентность
равна 4, кратность связей 1.5.
том
хлора имеет один неспаренный электрон,
соответственно между двумя атомами
хлора и между хлором и водородом может
образоваться только одна связь за счет
образования одной обобществленной
электронной пары:Cl3s2
3p5,H1s1=>Сl-Cl,
H-Cl.Валентные возможности атома азота
ограничены тремя неспаренными
электронами, поэтому с атомами кислорода
в молекуле азотной кислоты азот связан
как бы полуторными связями. Стехиометрическая
валентность азота равна 5, степень
окисления = +5, электронная валентность
равна 4, кратность связей 1.5.
432.Изменение валентности атома в большинстве случаев происходит за счет возбуждения, при котором распаривается электронная пара, образуя два неспаренных электрона. Т.е. валентность увеличивается на 2. Соответственно у р-элементов переменной валентности она различается на 2. Атом фтора имеет один неспаренный электрон на р-орбитали и не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 1. АтомClимеет подобную оболочку, однако у него есть возможность переходить в возбужденное состояние за счет перехода электронов на вакантныеd-орбитали. Соответственно,Clможет иметь валентность 1,3,5,7.F 2s22p5, Cl 3s2 3p53d0. ClF, ClF3, ClF5, ClF7.
433.Валентное состояние электронов, орбиталей и атома в целом означает возможность образования атомом химической связи. Атом фтора имеет один неспаренный электрон на р-орбитали и не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 1. F 2s22p5. Атом хлора имеет подобную оболочку, однако у него есть возможность переходить в возбужденное состояние за счет перехода электронов на вакантныеd-орбитали. Соответственно, хлор может иметь валентность 1,3,5,7.Cl 3s2 3p53d0. Атом кислорода имеет два неспаренных электрона на р-орбитали и подобно фтору не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 2. О 2s22p4. Сера, как и хлор, находится в третьем периоде, в котором есть вакантнаяd-орбиталь. Соответственно сера может быть 2-,4-,6-тивалентной.S 3s2 3p43d0. Для атома бериллия, валентные электроны которого находятся на 2sорбитали вакантной является 2р-орбиталь, на которую может происходить возбуждение электронов. Валентность всегда бериллия равна 2.Ве 2s22p0. Бор имеет на один электрон больше, чем бериллий, т.е. его валентность всегда равна 3 (поскольку 2s- и 2р-орбитали близки по энергии, возбуждение бериллия протекает очень легко и валентность 1 для него не характерна).В2s22p1.Углерод имеет на один электрон больше, чем бор; его валентность равна 4 (поскольку 2s- и 2р-орбитали близки по энергии, возбуждение углерода, как и бериллия, протекает очень легко и валентность 2 для С не характерна).С2s22p2.
434.Находясь в основном состоянии элементы обычно имеют немного неспаренных электронов, однако многие элементы способны переходить в возбужденное состояние, что приводит к появлению дополнительных неспаренных электронов, что увеличивает валентные возможности элементов. Основное состояние атома характеризуется минимумом энергии, в то время как возбужденное состояние характеризуется избыточной энергией. Когда атом находится в возбужденном состоянии его электроны могут распариваться и переходить на вакантные орбитали.PCl3, PCl5.Валентная конфигурация атома фосфора в основном состоянии: 3s23p3, т.е. валентность фосфора в основном состоянии равна 3. Следовательно в молекулеPCl3 фосфор находится в основном, а в PCl5- возбужденном состоянии.H2S, SO3.Валентная конфигурация атома серы в основном состоянии: 3s23p4, т.е. валентность серы в основном состоянии равна 2. Следовательно в молекулеH2Sсера находится в основном, а вSO3 - возбужденном состоянии.
435.Главной причиной образования химической связи между атомами является стремление к минимуму энергии: при образовании связи электронные облака перестраиваются так, что новая система энергетически более выигрышна, чем предыдущая, представляющая собой два отдельных атома (молекулы). О перекрывании электронных облаков при образовании молекулы водорода говорит тот факт, что линейный размер молекулы меньше суммы диаметров двух атомов водорода.
436. Образование одиночной связи (σ-связь) происходит вдоль линии связывания, при этом происходит наибольшее перекрывание, поэтому σ-связь наиболее прочная. Вторая и третья связь (π-связь) образуются над линией связи, при этом сильного перекрывания электронных облаков не происходит, поэтому энергия σ-связь + π-связь не равна удвоенной σ-связи.
|
Одинарная связь |
|
|
Двойная связь |
|
|
Тройная связь |
|
437. а) только σ-связь: СН4,NaCl,KF
б) одна σ-связь + одна π-связь: О2, СО2
в) одна σ-связь + две π-связи: N2,CO
438. SF6- шесть σ-связей ( ),SO3- три
σ-связи + три π-связи (
),SO3- три
σ-связи + три π-связи (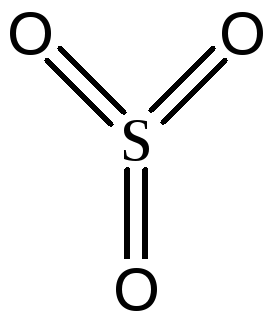 ),POCl3, - четыре
σ-связи + одна π-связь (
),POCl3, - четыре
σ-связи + одна π-связь (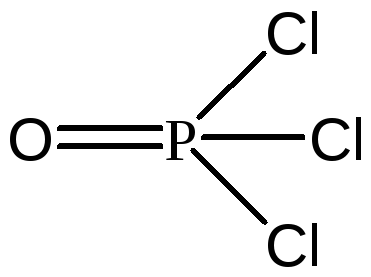 ),C2H2,
- три σ-связи + две π-связи (
),C2H2,
- три σ-связи + две π-связи (![]() ),C2H4,
- пять σ-связей + одна π-связь (
),C2H4,
- пять σ-связей + одна π-связь ( ),COCl2, - три
σ-связи + одна π-связь (
),COCl2, - три
σ-связи + одна π-связь (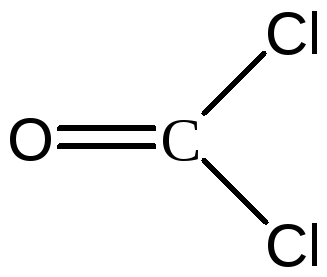 ),SO2Cl2.
- четыре σ-связи + две π-связи (
),SO2Cl2.
- четыре σ-связи + две π-связи (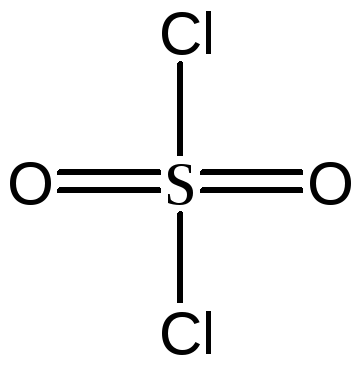 ).
).
439.Образование ковалентной связи по донорно-акцепторному механизму происходит следующим образом: один атом является донором электронной пары, а второй – имеет вакантную орбиталь и является акцептором. Например:Нٱ + :NH3 = [NH4]+. У водорода имеется вакантная орбиталь, а у азота – электронная пара. При образовании донорно-акцепторной связи стехиометрическая валентность азота увеличилась на 1, а степень окисления и электронная валентность не изменились. Стехиометрическая валентность и степень окисления водорода увеличились на 1, а электронная валентность не изменилась.
440. С2Н6- между атомами углерода образована одинарная связь, в то время как в молекуле С2Н4между атомами углерода образована двойная связь, в результате чего в С2Н4энергия связи между С-С выше. В бензоле - С6Н6- между атомами углерода формально двойная связь, однако она делокализована по всему углеродному кольцу, из-за чего энергия связи С-С ниже, чем в этилене.
441.
|
|
Молекула диамагнитна. KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4(πp2ру,2pz)4
Кратность связи =
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО. |
|
|
Молекула парамагнитна. KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4(πp2ру,2pz)2
Кратность связи =
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО. |
|
|
Молекула диамагнитна. KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4
Кратность связи =
При отрыве электрона энергия связи уменьшится, т.к. внешний электрон находится на связывающей МО. |
442. с
443.
|
|
Согласно теории Мо, молекула может существовать, если кратность связей (р) больше 0. А) р(Не2) = (2-2)/2 = 0 – молекула не существует Б) Отрыв одного электрона осуществляется с разрыхляющей МО: р = (2-1)/2 = 0.5 – молекула существует. В) He2-- не существует, т.к. 5 электронов не могут разместиться на двух МО. Г) НеFне может существовать, т.к. энергия АО Не иFсильно отличаются. Д) НеН. Р = (2-10/2 = 0.5 Молекула может существовать. |
444. с
445. Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей. Внешние электроны молекул водорода, углерода и азота находятся на связывающих МО, поэтому их легче оторвать от атомов, чем от молекул.
446.Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей. Внешние электроны молекул кислорода и азота находятся на разрыхляющих МО, поэтому их легче оторвать от молекул, чем от атомов.
|
|
|
447.Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей молекулы, чем со связывающих орбиталей. Энергия, затрачиваемая на отрыв электронов от атомов имеет промежуточное значение между энергией электронов связывающих и разрыхляющих МО. Внешние электроны молекулы СО находятся на связывающих МО, поэтому их легче оторвать от молекулы, чем от отдельных атомов С и О.
|
|
448. Согласно теории МО, чем больше кратность связи (р) молекулы, тем молекула устойчивее (больше Есв и меньше длина связи)
|
|
Добавление электрона к О2происходит на разрыхляющую МО: устойчивость уменьшается. Удаление электрона с разрыхляющей МО, наоборот, делает молекулу устойчивее:
р(О2) = р(О2-)
= |
449. а) – невозбужденная, т.к. на2р-связывающих орбиталях азота находятся спаренные электроны, на разрыхляющих2р-орбиталях азота неспаренных электронов нет.
б)-возбужденная
450.