
- •Качановский е.А., Ушаков в.Л.
- •Выделение днк.
- •В в е д е н и е
- •Исходный материал
- •Ткани животных
- •Эритроциты
- •Мягкие растительные ткани
- •Бактерии
- •Процедура выделения днк.
- •Контрольные вопросы.
- •Йодные часы.
- •Реакция Белоусова – Жаботинского.
- •Ртутное сердце (амеба).
- •Оптическая активность биомолекул.
- •R-аланин
- •Техника измерения.
- •1. Поляриметр круговой см-2.
- •2. Автоматический поляриметр фотоэлектронный а1-епо.
- •Нуклеозиды
- •Свойства нуклеозидов
- •Минорные нуклеозиды
- •1Ыйуровень упаковки в 6,7 раз 2ойуровень упаковки в 40 раз 3ийуровень упаковки (петельный) в 680 раз
D--аланин
L--аланин
S-аланин
[]D20
= 14,2 (10г в 100 мл 6н HCl)R-аланин
![]()
Существуют также и другие системы для обозначения пространственного строения молекул.
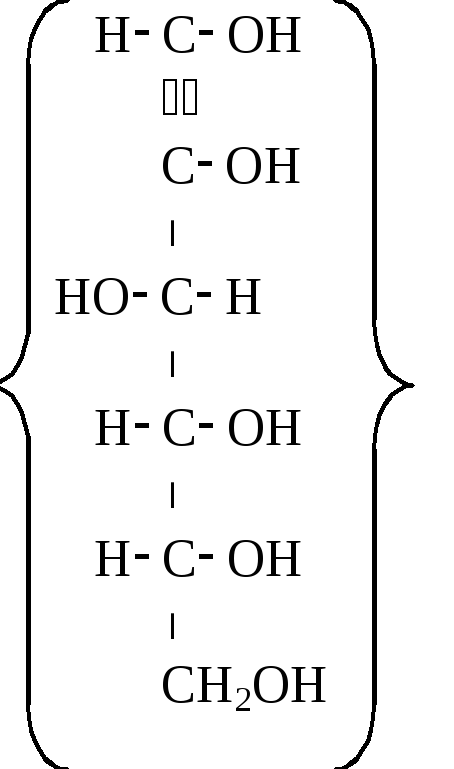
ГЛЮКОЗА
В природе встречается только D-глюкоза, которая выделена в виде двух анамеров-D- и-D-глюкопиранозы (соответственно формулы I и II). Первая кристаллизуется из воды при температуре ниже 30С в виде моногидрата,[]D20= +112,2.-аномер кристаллизуется из пиридина или некоторых других растворителей, []D20= +18,9.Растворение кристаллов сопровождается таутомерными превращениями, за протеканием которых можно следить по изменению во времени величины оптического вращения. В водном растворе устанавливается динамическое равновесие между несколькими таутомерами- и-формами D-глюкофуранозы (формулы соответственно III и IV) и D-глюкопиранозы, открытой альдегидной (V) и ее гидратной формой (VI). В равновесном состоянии присутствует 38%-формы (формула I) и 62%-формы (формула), содержание других таутомеров – менее 1%. Равновесное []D20= +52,7.
Самопроизвольное изменение величины оптического вращения свежеприготовленных растворов оптически активных соединений называется мутаротацией.
С
 амый
устойчивый таутомер --D-глюкопираноза
в конформации кресла.
амый
устойчивый таутомер --D-глюкопираноза
в конформации кресла.

Однако вышеприведенные процессы не ограничивают круг всех возможных процессов в растворе глюкозы.
Е



![]()
![]()
D-глюкоза D-маннозы D-фруктоза
Эти реакции протекают одновременно, но с различными скоростямиобычно самая быстрая – эпимеризация кетоз. Наиболее медленная реакция – превращение альдоз в кетозы. Основания – более эффективные катализаторы данных превращений, чем кислоты, причем действие гидроксидов Ва и Са более эффективно, чем гидроксидова или К, а Са(ОН)2оказывает более сильное каталитическое влияние, чем Ва(ОН)2. Предполагается, что эти реакции протекают через стадию образования енола (в фигурных скобках).
Углеродные атомы в молекулах моносахаридов нумеруют таким образом, чтобы атом углерода карбонильной группы имел наименьший номер. Для глюкозы это группа СНО. Соответственно D-ряд гексоз обусловлен положением группы ОН при 5С.
Сахароза
Примером более сложных молекул являются дисахариды. Среды них шире всего распространена сахароза (свекловичный или тростниковый сахар). Химическое название -D-глюкопиранозил--D-фруктофуранозид. Формула С12Н22О11, молекулярная масса 342,31, [D20= +66,5º. Химическая структура представляет собой шестичленный цикл глюкозы соединенный кислородным эфирным мостиком с пятичленным циклом фруктозы (невосстанавливающий дисахарид) (Рис. А).

 реди
крупных молекул встречаются и другие
случаи оптической изомерии (Рис.Б).
реди
крупных молекул встречаются и другие
случаи оптической изомерии (Рис.Б).
А Б
Лабораторная работа №14
Количественное определение белка методом Лоури
Цель работы ознакомление с наиболее распространенным методом количественного определения белка.
ВВЕДЕНИЕ.
Живые организмы имеют в своем составе свыше 70 микроэлементов. На долю углерода, водорода, кислорода, азота, фосфора, серы, кальция, натрия, калия, железа, йода приходится около 99.5 % всего массового содержания элементов в организме, на остальные более 60 элементов только 0.5 % и их называют микроэлементами. Химический состав живых организмов принципиально отличается от элементного состава неживых объектов, хотя иногда и удается теоретически проследить генетическую связь между живыми организмами и средой их обитания. Два щелочных иона Na+ и K+ и два щелочно-земельных иона Mg2+ и Ca2+ - все вместе составляют более 99% количества ионов металлов в теле человека. Все микроэлементы принимают участие в жизненно важных функциях, и их удаление приводит к нарушению гомеостаза организма. Среди одновалентных ионов особое внимание заслуживают натрий и калий, среди двухвалентных магний и кальций. Двухвалентные катионы в основном действуют, как вторичные мессенджеры или как кофакторы в различных биохимических реакциях. Около трети всех ферментов, как в клетках эукариот, так и прокариот, содержит ионы металлов в качестве кофакторов (киназ и др.), зачастую образуя инертный комплекс с тяжелым металлом, который и формирует активный центр фермента. Однако следует помнить что для функционирования практически всех биологических систем необходим определенный солевой фон (живые клетки поддерживают гомеостаз), то есть в живом организме почти все компоненты существуют в виде комплексов, обычно заряженных.
Существует специальная наука: бионеорганическая химия (неорганическая биохимия), которая изучает комплексы ионов металлов с белками, нуклеиновыми кислотами, липидами и низкомолекулярными природными веществами. Бионеорганическая химия исследует роль этих ионов в выполнении биологических функций металлоферментов и других комплексов. Данные, характеризующие среднее содержание ряда металлов в организме человека, приведены ниже (г на 70 кг):
|
Ca |
K |
Na |
Mg |
Fe |
Zn |
Cu |
Mn |
Mo |
Co |
Cr |
|
1050 |
245 |
105 |
35 |
4,25 |
1,9 |
0,15 |
0,020 |
0,015 |
0,003 |
0,0015 |
Избыток или недостаток таких микроэлементов, как переходные металлы и селен, приводит к тяжелым патологиям.[Химическая энциклопедия. т.1, с.287, М.: "Советская энциклопедия",1988].
С целью систематизации химических взаимодействий, приводящих к образованию комплексных соединений, применяют принцип «жестких» и «мягких» кислот и оснований (ЖМКО). Этот метод разработан на основе исследований комплексообразования между катионами переходных металлов с органическими и неорганическими лигандами, которое удалось рассмотреть с позиций кислотно-основные взаимодействий. В соответствии с ним кислотно-основные взаимодействия протекают таким образом, что «жесткие» кислоты предпочтительно связываются с «жесткими» основаниями, а «мягкие» кислоты – с «мягкими» основаниями. При оценке «жесткости» и «мягкости» кислот и оснований учитывают их химический состав и электронное строение, а также сравнительную устойчивость образуемых ими кислотно-основных комплексов: А + :В ↔ А:В, где А – кислота Льюиса, :В – основание, А:В – кислотно-основной комплекс. Например:
|
Кислота |
|
Основание |
|
Кислотно-основной комплекс |
|
Н+ |
+ |
ОН- |
↔ |
Н2О |
|
СО2 |
+ |
Н2О |
↔ |
Н2СО3 |
|
АlCl3 |
+ |
Cl- |
↔ |
[AlCl4]- |
|
BF3 |
+ |
(C2H5)2O |
↔ |
(C2H5)2O:BF3 |
|
Zn(OH)2 |
+ |
2 OH- |
↔ |
[Zn(OH)4]2- |
|
S |
+ |
S2- |
↔ |
[S2]2- |
|
Ag+ |
+ |
2 CN- |
↔ |
[Ag(CN)2]- |
«Жесткие» кислоты – акцепторы (принимают электроны) с низкой поляризуемостью, высокой электроотрицательностью, трудно восстанавливаются, их незаполненные граничные орбитали имеют низкую энергию; «мягкие» кислоты – акцепторы с высокой поляризуемостью, низкой электроотрицательностью, легко восстанавливаются, их свободные граничные орбитали имеют высокую энергию. «Жесткие» основания – доноры (отдают электроны) с низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются, их занятые граничные орбитали имеют низкую энергию; «мягкие» основания – доноры с высокой поляризуемостью, низкой электроотрицательностью, легко окисляются, их занятые граничные орбитали имеют высокую энергию. Самая «жесткая» кислота – протон, самая «мягкая» - CH3Hg+; наиболее «жесткие» основания F- и ОН- , наиболее «мягкие» I- и Н-. Сопоставление устойчивости кислотно-основных комплексов для различных оснований по отношению к Н+ и CH3Hg+, а также для кислот по отношению к F- и I- позволило разделить известные кислоты и основания на группы.
Группы кислот и основания.
|
«Жесткие» |
«Промежуточные» |
«Мягкие» |
|
|
Кислоты |
|
|
H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Sr2+, Al3+, Ga3+, Cr3+, Ln3+, Si4+, Ti4+, Zr4+, Th4+, BF3, AlCl3, AlH3, RCO+, CO2, NC+, Hhal. |
Fe2+, Co2+, Ni2+, Cu2+, Zn2+,Pb2+,Sn2+, Bi3+, Rh3+, B(CH3)3, SO2, NO+, R3C+, C6H5+ |
CH3Hg+, Cu+, Ag+, Au+, Hg+,Hg2+, Pt2+, Pt4+, BH3, Ga(CH3)3, R+, RSe+, RTe+, I+, Br+, RO+, I2, Br2, ICN, карбены, тринитробензол, хиноны. |
|
|
Основания |
|
|
H2O, OH-, CH3COO-, ROH, RO-, R2O, NH3, RNH2, N2H4, F-, Cl-, ClO4-, CO32-, PO43-, SO42-. |
C6H5NH2, C5H5N, N3-, NO2-, SO32-, Br-, |
H-, I-, CN-, CO, R3P, (RO)3P, R3As, R2S, RSH, RS-, SCN-, S2O32-, R-, C2H4, C6H6, |
Предпочтительное связывание «жестко-жестких» и «мягко-мягких» реагентов в рамках теории возмущения объясняется тем, что взаимодействие между орбиталями с близкой энергией более эффективно, чем между орбиталями, разнящимися по энергии, то есть подчеркивается преимущество электростатического («жестко-жесткого») или ковалентного (мягко-мягкого») взаимодействия.
Принцип ЖМКО используют для учета специфических взаимодействий и особенностей протекания конкурирующих процессов, для направленного создания экстрагентов, детоксикантов, лекарственных препаратов, а также объяснения связывания металлов в биохимических и геологических объектах.
Принцип сформулирован Р.Пирсоном в 1963 году.
Принцип ЖМКО позволяет описывать широкий круг реакций с позиций кислотно-основного взаимодействия, в том числе реакции комплексообразования и образования металлоорганических соединений (соединения содержащие связь Ме-С).
Однако следует знать, что принцип ЖМКО не является абсолютным, каждая пара веществ взаимодействует в соответствии со своими индивидуальными особенностями, что позволяет существовать применяемым в аналитической химии высокоспецифическим реагентам применяемым для селективного определения веществ (Fe2+ - о-фенантролин; Ni2+ - диметилглиоксим и др.)
Количественно стабильность комплексов описывается с помощью ступенчатых констант образования (устойчивости) – К.
М + А ↔ МА К1 = [МА]/[М][А]
МА + А ↔ МА2 К2 = [МА2]/[МА][А]
МАn-1 + А ↔ МАn Кn = [МАn]/[МАn-1][А]
Можно пользоваться полными константами образования – β:
М + А ↔ МА β1 = К1 = [МА]/[М][А]
М + 2А ↔ МА2 β2 = К1∙К2 = [МА2]/[М][А]2
М + nА ↔ МАn βn = К1∙К2 … Кn = [МАn]/[М][А]n
Константы βn и Кn – термодинамические характеристики устойчивости комплекса в растворе. Величины, обратные βn или Кn называются константами диссоциации или нестойкости.
Различают термодинамическую стабильность комплексных соединений – меру возможности образования комплекса или его превращения в другие соединения в равновесных условиях – и кинетическую, описывающую скорость реакций комплексов, ведущих к достижению равновесия. Термодинамическая стабильность комплекса характеризуется терминами «устойчивый», «неустойчивый», кинетическая – терминами «лабильный» и «инертный». Если при комнатной температуре реакция комплекса протекает за время смешения реагентов (около 1 минуты), комплекс относят к лабильным. Если реакция протекает с измеримой скоростью и половина времени жизни комплекса более двух минут, то такие комплексы называют инертными. Например наблюдается резкое различие в константах скорости изотопного обмена молекул воды во внутренней координационной сфере для инертного комплекса [Cr(H2O)6]3+и для лабильного [Ni(H2O)6]2+.
Работа практически всех ДНК-специфичных ферментов - рестриктазы, ДНК и РНК полимеразы, топоизомеразы и т.д. зависит от ионов Сa2+,Mg2+,Zn2+. Так в тимоцитах крыс существует 3 вида эндонуклеаз:α,β,γ. Из нихαиβ- эндонуклеазы не требуют для работы двухвалентных ионов. Дляγ- эндонуклеазы, играющей главную роль в процессах апоптоза, нужны ионы Сa2+(3 ммоль) иMg2+(3 ммоль), в то время как ионыZn2+(0.04 ммоль) ингибируют её деятельность. Известно семейство низкомолекулярных (6.5 кДа) металлосвязывающих белков металлотионеинов, локализованных, как правило, в цитоплазме и обнаруживаемых также в клеточном ядре. Особенностью их строения являются высокое содержание цистеина (20 из 61 аминокислоты), который является мягким основанием, и отсутствием ароматических аминокислот и гистидина. Металлотионеины осуществляют неспецифическую защиту, участвуя в метаболизме и детоксификации тяжёлых металлов, как необходимых организму (цинк, медь), например при средних концентрациях 10-7-10-8 М (для меди 10-12 М) для водорослей, так и токсичных при концентрациях металлов, превышающих в среднем на 2 порядка оптимальные для нормального развития организмов концентрации. Синтез металлотионеинов в клетках млекопитающих легко индуцируется различными воздействиями: ионами тяжёлых металлов (Zn2+, Cu2+,Cd2+,Be2+,Mn2+,Hg2+,Au+,Ag+,Co2+,Ni2+,Pt2+), стероидными гормонами, цитотоксическими химическими соединениями, цитокинами, липополисахаридами, факторами роста, ионизирующим излучением и т.д. В молекулах белка (или других биологических молекулах) имеются четыре главных типа донорных атомов в лигандах: кислород, алифатический азот, ароматический азот, сера. Все ионы щелочных, щелочноземельных и лантаноидных металлов,Mn2+, Be2+, Al3+,Cr3+, Fe3+(жесткие и промежуточные кислоты) предпочитают взаимодействовать с кислородом и алифатическим азотом; ионыZn2+,Pb3+,Cu2+,Ni2+,Co2+, Fe2+(промежуточные кислоты) с ароматическим азотом и с серой цистеина; ионыCd2+,Hg2+,Tl+,CH3Hg+(мягкие кислоты) с серой. Обратим внимание, что такая классификация условна и речь скорее идёт о предпочтении в связывании металлов с тем или иным донором в соответствии с принципом ЖМКО. Подобный подход справедлив и при рассмотрении биологически активных соединений.
Ионы натрия и калия участвуют в поддержании необходимого мембранного клеточного потенциала и осмотического давления клетки за счёт работы натрий-калиевого АТФ-азного насоса клетки. Магний Мg2+широко распространён в тканях и является фактором активации АТФаз, как для клеток эукариот, так и для клеток прокариот. После калия магний является следующим наиболее распространённым внутриклеточным неорганическим катионом, но в отличие от калия он осмотически не свободен, а связан влабильные комплексы. Магний является мембранным и рибосомным стабилизатором, играя роль противоиона для полианионов, таких как липиды или ДНК, имеющей отрицательно заряженные фосфатные группировки в каждом звене цепи. Его присутствие увеличивает вероятность правильного спаривания звеньев в молекуле ДНК, при этом магний способен сохранять часть гидратной оболочки, он также необходим для работы ДНК-полимеразы. Ион Мg2+участвует в работеNMDAрецептора нервных клеток. В больших дозах (2 мкМ) он блокирует некоторые типы К+каналов в сердечных и скелетных мышцах, яйцеклетках. В прокариотических клетках существует порядка трёх транспортных систем для ионов магния.
Цитоплазматический уровень ионов Ca2+в прокариотических и эукариотических клетках около 100 пМ, и увеличивается при стимуляции специфичных рецепторов. В эукариотических клетках показано два типа передачи сигналов с участием ионов Са2+. Первый относится к электрически активным клеткам и связан с секрецией нейромедиаторов при поглощении ионов Са2+нервными окончаниями при деполяризации плазматической мембраны. Второй, инозитолфосфатный, проявляется во всех клетках эукариот и связан с высвобождением Са2+из внутриклеточных хранилищ при взаимодействии сигнальной молекулы с рецептором клеточной мембраны. При его высвобождение из них, он в комплексе с кальмодулином активирует протеинкиназы, способные к фосфорилированию белков или влияет на механизмы действия другого внутриклеточного посредника цАМФ (циклический аденозинмонофосфат).
Ионы Zn2+являются необходимыми компонентами более 100 ферментов, например, таких как дегидрогеназа, карбоангидразы, щелочная фосфатаза. Они участвуют в метаболизме нуклеиновых кислот и клеточном делении, поскольку необходимы для работы ДНК-полимеразы, РНК-полимеразы, ревертазы, являются блокаторами эндонуклеаз и т.д.. Некоторые белки,, принимающие участие в регуляции генов, содержат образования, называемые “цинковыми пальцами”, в которых 30 аминокислот сложены в одну структурную единицу вокруг атома цинка, связывающего два остатка гистидина и два остатка цистеина.
В основе многих физиологических клеточных процессов, в особенности для нервных клеток, лежит работа ионных каналов биологических мембран. Ионные каналы – это интегральные белки (гликопротеиды), пронизывающие липидный бислой мембраны и способные при адекватных внешних воздействиях избирательно менять проницаемость мембран для определённых ионов - Na+,K+, Ca2+, Cl-. Поступление металлов зависит от перепада градиента концентрации через клеточные мембраны. Анионы в клетке представлены в основном ионами Сl-,HCO3-, Н2PO4- и НPO42-(при рН 7), белками, нуклеиновыми кислотами, метаболитами, несущими фосфатные и карбоксильные группы и т.д. Наличие хлорных каналов указывает на важную роль аниона хлора Cl-в жизнедеятельности животных клеток, при этом средняя концентрация ионов Cl-внутри животной клетки 5-15 мМ, вне 110 мМ. Формирование трансмембранных ионных градиентов используется клетками для осуществления различных транспортных процессов, например, сахаров и аминокислот, синтеза АТФ и т.д. У бактерий и растений большинство систем активного транспорта, приводящихся в действие ионными градиентами, используют в качестве котранспортируемого ионаH+, а неNa+, как клетки животных.
Как уже упоминалось, из всех катионов в клетке явно преобладают натрий, калий, кальций и магний (см. таблицу), причём поскольку ионы кальция Са2+служат внутриклеточным посредником в разнообразных клеточных реакциях, включая секреторные процессы и пролиферацию, то концентрация свободных ионов Са2+(активность) в цитозоле клетки очень низка (порядка 10-7 М), по сравнению с содержанием его во внутриклеточных компартментах и во внеклеточной жидкости 10-3 М для клеток эукариот. Внутриклеточная концентрация ионов Мg2+в животной клетке 0.5 мМ в свободном состоянии и 20 мМ в связанном с белками и другими веществами Что касается остальных микроэлементов в частности металлов, то большая их часть находится в связанном состоянии, например с белком, и количество свободных ионов всех остальных металлов незначительно.
Например в щитовидной железе человека накапливается йод, в виде йодсодержащей аминокислоты – тироксина. При недостатке этого элемента может развиваться кретинизм или зоб, которые раньше были широко распространены в некоторых континентальных районах Земли.
Селен необходим для зрения и накапливается в зрительных органах. Однако при избытке селена поступающего с пищей, он начинает замещать серу в метионине с образованием селенометионина.
Все микроэлементы в живых организмах можно рассматривать как образующие инертные комплексные или элементорганические соединения.
В свою очередь для качественного и количественного определения или выделения органических веществ из биологических сред широко применяют методы основанные на комплексообразовании исследуемых молекул со специально вводимыми катионами.
Для количественного определения белков широко используется метод Лоури. В основе двустадийной реакции, описанной Лоури, лежит восстановление реактива Фолина комплексом, образующимся при взаимодействии белка с ионами меди в щелочном растворе.
Реактив Фолина представляет собой кислый раствор гетерополикислоты. Гетерополикислоты получают в водных растворах, по реакции
H3PO4
+ 12Na2MoO4
+ 12H2SO4
![]() H3[PMo12O40]
+ 12Na2SO4
+ 12 H20
причем в состав гетерополикислоты
совместно входят Мо и W.
H3[PMo12O40]
+ 12Na2SO4
+ 12 H20
причем в состав гетерополикислоты
совместно входят Мо и W.
Гетерополикислоты и их некоторые соли хорошо растворяются в воде и кислородсодержащих органических растворителях. Из водных растворов выделяются в виде кристаллогидратов H3PO4·12(Mo,W)O3·nH2O, где n-порядка 30. Они сравнительно устойчивы в кислых и нейтральных водных растворах, однако разлагаются в щелочной среде.
Соли меди в щелочных растворах образуют осадки гидроокиси Cu(OH)2. Причем произведение растворимости для этого осадка [Cu2+][OH-]2 = 8,3·10-20. Чтобы удержать ионы меди в таком растворе следует применять специальные добавки: соли лимонной (цитрат) или винной (тартрат) кислот. Ионы меди в этих условиях образуют с цитрат-ионом заряженные комплексы при соотношении 1:1, с константой устойчивости lg К1= 5,90.
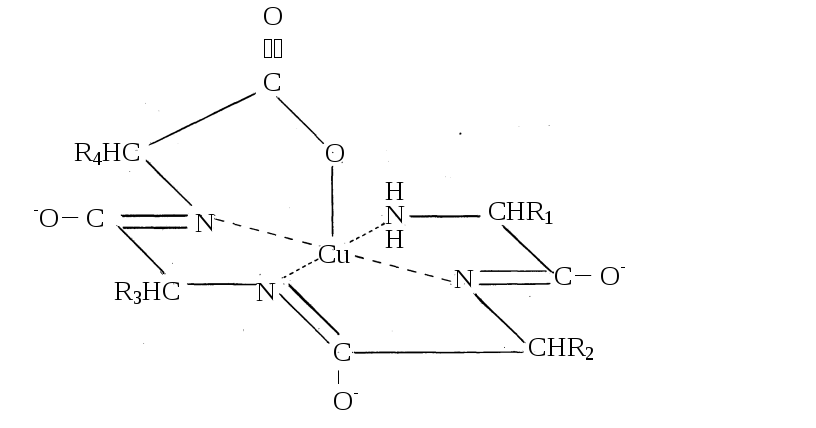
Щелочные медьсодержащие растворы способны вступать в химическую реакцию с растворенным белком с образованием окрашенных в синий цвет продуктов реакции (комплексные соединения меди с белком). Ниже приведена одна из возможных структур этих продуктов реакции. Гетероциклические аминокислоты типа гистидина и триптофана, а также тиоаминокислоты будут образовывать конечно структуры с другой координацией. Эта реакция называется биуретовой и может применяться для качественного и количественного определения белка в растворе. Предел обнаружения белка для этой реакции составляет (1 – 2) мг/мл.
Н2NCH(R1)CONHCH(R2)CONHCH(R3)CONHCH(R4)COOH
![]()
Н2NCH(R1)C(O-)=NCH(R2)C(O-)=NCH(R3)C(O-)=NCH(R4)COO-
![]()
Процесс взаимодействия реактива Фолина с белковым медьсодержащим комплексом распадается на две стадии. На первой быстропротекающей стадии при смешении кислого раствора реактива Фолина с щелочным белковым раствором наблюдается разрушение гетерополикислот и образование неких соединений содержащих Мо(VI), W(VI) и белок. На следующей, медленно протекающей стадии восстановления Мо(VI) и W(VI) за счет двойных связей белковой молекулы, наблюдается развитие окраски. (Бензольное кольцо тирозина по своей природе является восстановителем). Продукты восстановления окрашены в синий цвет за счет образования Мо(V) и W(V), например молибденовая синь Мо2О5·3МоО3. Интенсивность окраски, образующейся в результате завершения реакции Лоури, пропорциональна концентрации белка в пробе. Нижний предел обнаружения в этом случае снижается вплоть до 10 мкг/мл. Однако образующаяся окраска неустойчива и постепенно исчезает. Следует также принимать во внимание что наличие некоторых веществ препятствует применению реакции Лоури на практике. Например наличие сульфата аммония свыше 0,15 % мешает развитию окраски (на биуретовую реакцию не влияет), а присутствие соединений ЭДТА приводит к образованию окрашенных продуктов без всяких белков.
Любая пептидная связь обладает поглощением света, особенно в УФ диапазоне. Некоторые аминокислоты, особенно содержащие ароматические остатки, усиливают окраску пептида и сдвигают ее в видимую область. Полный гидролиз белков снижает окраску (например у альбумина) более чем на 2/3. К такому же эффекту приводит расщепление дисульфидных связей, например путем окисления надмуравьиной кислотой (в плазмине общая интенсивность окраски снижается примерно на 1/3).
За поглощение света в зависимости от длины волны отвечают разные участки белковой молекулы.
ПРИБОРЫ И ОБОРУДОВАНИЕ.
Спектрофотометр СФ-26 ("Спекол-10").
Термостат.
Колбы, пипетки и пр.
РАСТВОРЫ И РЕАКТИВЫ.
Реактив А: 2 % раствор Na2CO3 в 0,1 н растворе NaOH.
Реактив В: 0,5 % раствор CuSO4·5H2O в 1% растворе цитрата или тартрата натрия.
Реактив С: 50 мл реактива А смешивают с 1 мл реактива В (готовить непосредственно перед использованием).
Реактив Фолина: 100 г Na2WO4·2H2O и 25 г Na2МоO4·2H2O растворяют в 700 мл дистиллированной воды, добавляют 50 мл 85 %раствора ортофосфорной кислоты и 100 мл концентрированной HCl. Смесь кипятят с обратным холодильником в течение 10 часов. В охлажденную смесь добавляют 150 г Li2SO4, 50 мл воды и несколько капель брома. Избыток брома удаляют кипячением смеси в течение 15 минут. Полученный раствор охлаждают, фильтруют и разбавляют дистиллированной водой до 1 л. Реактив разводят водой так, чтобы его кислотность была равна 1 н ,и используют для проведения реакции.
Стандартный раствор альбумина - 200 мкг/мл.
Раствор белка неизвестной концентрации.
Раствор 0,01 ssc.
ХОД РАБОТЫ.
0,4 мл исследуемого раствора, содержащего от 20 до 80 мкг белка, смешивают с 2 мл реактива С и оставляют при комнатной температуре на 10 минут. Затем приливают 0,2 мл реактива Фолина, смесь энергично перемешивают и пробы оставляют при комнатной температуре на 40 минут в темноте. Интенсивность развившейся синей окраски измеряют при 750 нм относительно контрольной пробы. Одновременно с опытными образцами той же обработке подвергают стандартные пробы и контрольную пробу, содержащую вместо раствора белка равный объем дистиллированной воды (см. таблицу).
ТАБЛИЦА.
Состав проб:
|
№№ проб |
Содержание белка в пробе мкг |
Объем стандартного раствора белка, мл |
Объем воды, мл |
Объем реактива С, мл |
Объем реактива Фолина, мл |
Пока-зания СФ |
|
Конт. |
- |
- |
0,4 |
2,0 |
0,2 |
|
|
1 |
20 |
0,1 |
0,3 |
2,0 |
0,2 |
|
|
2 |
40 |
0,2 |
0,2 |
2,0 |
0,2 |
|
|
3 |
60 |
0,3 |
0,1 |
2,0 |
0,2 |
|
|
4 |
80 |
0,4 |
- |
2,0 |
0,2 |
|
|
5 |
Неизв. конц. |
0,4 |
- |
2,0 |
0,2 |
|
Построить по результатам измерений калибровочную кривую (зависимость оптической плотности от концентрации альбумина) и по ней определить неизвестную концентрацию белка.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
Методы определения концентрации белков, пределы их измерения и чем обусловлены эти ограничения?
Можно ли определять концентрации других белков по калибровочной кривой, полученной по раствору альбумина?
Почему полный гидролиз белков снижает окраску более, чем на 2/3?
Что такое координационная связь, координационное число? Как зависит координационное число от валентности атомов?
Что такое орбитали s, p, d, f и чем они отличаются друг от друга?
Эффект расщепления уровней. Зависимость магнитных (диамагнитнитизм или парамагнетизм) свойств, окраски соединений от характера координационной связи.
Для каких ионов наиболее характерно образование координационной связи? Что такое гибридизация? Гибридизация sp3, dsp2.
Лабильные и инертные комплексные соединения.
Какие элементы наиболее часто входят в состав ферментов? Приведите примеры.
Особенности биологических молекул выступающих в качестве лигандов.
Почему реакцию с реактивом Фолина следует проводить в темноте?
Для чего нужен реактив С? Что произойдет с окраской раствора, если реактив Фолина добавить без реактива С?
ЛИТЕРАТУРА.
Методы вирусологии и молекулярной биологии. - М.:Мир,1972.
Дж. Бейли. Методы химии белков. - М.:Мир,1965.
Р.Скоупс Методы очистки белков. - М.:Мир,1985.
Б.Албертс Молекулярная биология клетки. т.1 - М.:Мир,1993.
М.В.Волькенштейн Биофизика. - М.:Наука,1989.
А.Ленинджер Основы биохимии. - М.:Мир,1985.
Н.Л.Глинка Общая химия. – Л.:Химия,1988.
Н.Л.Глинка Задачи и упражнения по общей химии. М.Интеграл-пресс,1997.
Кварц
Любой кристалл можно рассматривать как одну большую молекулу. В частности окись кремния SiO2образует кристалл, сложенный из тетраэдровSiO4. Одна из возможных модификаций (кварц) обладает оптической активностью, несмотря на то, что их кристаллы сложены из совершенно одинаковых молекул.
П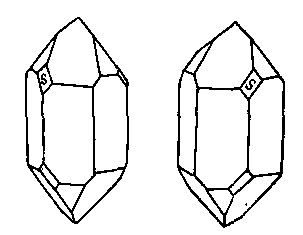 о
отношению к поляризованному свету
различают две разновидности кварца.
Кристаллы одной из них – правовращающего
кварца – вращают плоскость поляризованного
света вправо, когда свет проходит в
направлении главной кристаллографической
оси, а кристаллы другой разновидности
– левовращающего кварца – влево
(примерно на 22о/мм для желтого
цвета). Следовательно, кварц является
оптически активным веществом. Кристаллы
этих двух разновидностей кварца
различаются также по небольшим
трапезоидным площадкам (S), которые
появляются у правовращающего кварца
справа, а у левовращающего – слева.
Вследствие асимметрии этих площадок
кристалл правовращающего кварца не
совмещается с кристаллом левовращающего
кварца. Эти кристаллы относятся друг к
другу, как предмет к своему зеркальному
изображению (энантиоморфные формы).
о
отношению к поляризованному свету
различают две разновидности кварца.
Кристаллы одной из них – правовращающего
кварца – вращают плоскость поляризованного
света вправо, когда свет проходит в
направлении главной кристаллографической
оси, а кристаллы другой разновидности
– левовращающего кварца – влево
(примерно на 22о/мм для желтого
цвета). Следовательно, кварц является
оптически активным веществом. Кристаллы
этих двух разновидностей кварца
различаются также по небольшим
трапезоидным площадкам (S), которые
появляются у правовращающего кварца
справа, а у левовращающего – слева.
Вследствие асимметрии этих площадок
кристалл правовращающего кварца не
совмещается с кристаллом левовращающего
кварца. Эти кристаллы относятся друг к
другу, как предмет к своему зеркальному
изображению (энантиоморфные формы).
Получение энантиомеров.
Простейшим способом получения чистых антиподов является их выделение из реакционных смесей, даже рацемических - расщепление.
1. Из природных живых организмов сразу выделяются оптически активные соединения, поскольку живые организмы синтезируют и используют обычно только один из двух возможных энантиомеров.
2. Самым первым и простым способом расщепления является кристаллизация. Несмотря на одинаковые физические константы (кроме вращения плоскости поляризации) иногда, но достаточно редко, удается разделить при кристаллизации рацемат на энантиомеры. Например, кристаллизацией натрийаммонийтартрата удается получить смесь кристаллов двух видов, которую можно разделить вручную, получив чистые энантиомеры солей винной кислоты.
3. Другой подход заключается в селективном разрушении одного из компонентов рацемата. В частности, грибок Penicilliumglaucum, внесенный в смесь винных кислот, уничтожает только D-(+)-изомер.
4. Чаще всего расщепление рацемата проводят с помощью оптически активных реагентов, которые обычно выделяют из природного биологического сырья.
Действуя на рацемическую смесь (D,L)-изомеров соединением L', получаем продукты DL' и LL'. Эти соединения уже не являются зеркальными антиподами (ими были бы DL' и D'L). Поэтому физико-химические свойства DL' и LL' различаются, и можно разделить эти соединения, например, кристаллизацией. Существует стандартный подход к разделению рацемической кислоты (±)-НА с помощью сложных органических оснований (алкалоиды, выделяются из некоторых растений) - кокаин, морфин, стрихнин, хинин и т.п. При их взаимодействии с кислотой образуются хорошо кристаллизующиеся соли. Проведением фракционной кристаллизации можно выделить чистые оптически активные фракции, из которых с помощью сильных минеральных кислот осаждаются слабые органические кислоты в виде (+)- или (-)-изомера.
Для разделения рацемических оснований следует использовать оптически активную кислоту, например, молочную.
Для разделения спиртов приходится проводить их химическую модификацию, с образованием кислот. Например, реакция спирта с фталевым ангидридом, приводит к образованию алкилфталата, который уже и реагирует с алкалоидом.
5. Из природных оптически активных соединений можно получить другие оптически активные соединения. Примером может служить важный в промышленности многостадийный синтез L-аскорбиновой кислоты (витамина С) из D-глюкозы или L-сорбозы; в его ходе перед стадией окисления четыре группы ОН защищают, превращением в ацетали, реакцией с ацетоном. Ацеталь содержит группировку (СН3)2С(ОR)2. Ацетали устойчивы в щелочных средах и очень легко гидролизируются в кислых.
Поляризация света.
П лоскополяризованную
световую волну можно представить как
комбинацию левого и правого поляризованных
по кругу лучей с соответствующими
векторами Elи Er. Если
взаимодействие левого и правого
поляризованных по кругу лучей со средой
одинаково (это характерно для изотропных
сред), то векторы имеют одинаковые
величины (рис.a).
лоскополяризованную
световую волну можно представить как
комбинацию левого и правого поляризованных
по кругу лучей с соответствующими
векторами Elи Er. Если
взаимодействие левого и правого
поляризованных по кругу лучей со средой
одинаково (это характерно для изотропных
сред), то векторы имеют одинаковые
величины (рис.a).
Когда поляризованный свет проходит через анизотропную (хиральную) среду, то один из этих лучей распространяется быстрее другого, в результате чего суммарный вектор оказывается повернутым на некоторый угол , тем больший, чем больше разность скоростей распространения света в среде, то есть показателей преломления nl и nrлучей, поляризованных по кругу влево и вправо. Это явление называется двойным круговым (циркулярным) лучепреломлением.
Л евый
и правый поляризованные по кругу лучи
по-разному поглощаются средой, то естьlr,
гдеlиr- коэффициенты экстинции для лучей с
левой и правой круговой поляризацией.
Суммирование соответствующих им векторов
неравной величиныEl
иErдает результирующий вектор, конец
которого описывает эллипс (рис. в),то есть плоскополяризованный свет после
прохождения через хиральную среду
становится эллиптически поляризованным.
Это явление называется круговым
дихроизмом. Количественной мерой этого
явления служит угол эллиптичности,
тангенс которого равен отношению осей
эллипса.
евый
и правый поляризованные по кругу лучи
по-разному поглощаются средой, то естьlr,
гдеlиr- коэффициенты экстинции для лучей с
левой и правой круговой поляризацией.
Суммирование соответствующих им векторов
неравной величиныEl
иErдает результирующий вектор, конец
которого описывает эллипс (рис. в),то есть плоскополяризованный свет после
прохождения через хиральную среду
становится эллиптически поляризованным.
Это явление называется круговым
дихроизмом. Количественной мерой этого
явления служит угол эллиптичности,
тангенс которого равен отношению осей
эллипса.
Поскольку угол очень мал по величине, то принимают tgи, проводя преобразования, получают=·l/·(l-r) в радианах, где-длина волны падающего света в вакууме, l-толщина слоя в см. Так как оба явления - двойное круговое лучепреломление и круговой дихроизм происходят одновременно, то суммарный эффект прохождения плоско-поляризованного света через хиральную среду описывается эллипсом с вращающейся главной осью (рис.г).
Для характеристики оптически активных веществ методом поляриметрии используют величины удельного и молярного оптического вращения .Величины оптического вращения зависят от длины волны применяемого света. Эта зависимость называется дисперсией оптического вращения.
Поглощение и показатель преломления.
Предположим, что монохроматическое излучение направлено через тонкую пластинку толщиной у (Рис. 1). Здесь нас интересует амплитуда электрического поля прошедшей волны на расстоянии у от пластины. Поскольку наблюдаемое в моментtэлектрическое поле на расстоянии у образовалось ранее при колебаниях зарядов (электроны, протоны и т.п.) в пластине в момент [t-(y/c)] (где с - скорость света в вакууме), то очевидно, что если пластина никак не влияет на падающее излучение, то выражение для напряженности электрического поля (Е) на расстоянии у можно записать в виде:
Е(в точке у)= Еосоs[(t-y/c)] =Re{Eoexp[i(t-y/c)]}
Однако если скорость движения волны уменьшается при прохождении пластины, то из обычного определения показателя преломления n’
n=
скорость света в пластине
следует, что после прохождения пластины волна уже будет запаздывать на время t= (n- 1)(y) /cтак что выражение для электрического поля в точке у теперь примет вид:
Е(в точке у)= Еосоs{[t- (n- 1)(y)/c-y/c]} =Re{Eoexp{i[t- (n- 1)(y)/c-y/c]}} = =Re{exp[-i(n- 1)(y)/c]Eoexp[i(t-y/c)]}
влияние показателя электрическое полесоздаваемое волной
преломления n1 если пластина отсутствует.
Это уравнение показывает что с помощью комплексной системы обозначения легко выделить член описывающий поведение волны при отсутствии преломления и член определяющий уменьшение скорости света при прохождении через среду.
Во время прохождения волны через пластинку кроме уменьшения скорости будет наблюдаться уменьшение dIинтенсивностиI. Для достаточно тонкой пластины можно ожидатьчто изменение интенсивности пропорционально интенсивности падающего светатолщине пластиныdу и концентрации поглощающих молекулm(в молях на литр)
dI= -kImdy
где k- константа пропорциональностихарактерная для данного вещества. Это уравнение в интегральной форме известно как закон Бера
ln(I/Io) = -kmy
«Пропускание» = I/Io= 10-(k m y/2303)= 10- m y= 10-D=e-(2303 y N/N°)
где называют молярным коэффициентом погашения (молярным коэффициентом экстинкции)Io- интенсивность падающего на пластину светаD - поглощение или оптическая плотностьN- число молекул в 1 см3иNо- число Авогадро. Поскольку интенсивность электромагнитного излучения пропорциональна квадрату амплитуды электрического поля прошедшей через пластину волны и,кроме того,(е-х)½= е-х/2то уравнение можно теперь дополнить включением в него членаописывающего поглощение энергии:
Е(в точке у)=exp[-2303(y)N/2No] Еосоs{[t- (n- 1)(y)/c-y/c]} =
=Re {exp[-2303 (y) N/2No] exp[- i(n - 1)(y)/c] Eo exp[i (t - y/c)]
влияние показателя электрическое полесоздаваемое волной
преломления n1 если пластина отсутствует.
Рассмотрение первых двух множителей вышеприведенного уравнения показываетчто значительная экономия при записи может быть достигнута путем введения комплексного «показателя преломления»n, описывающего оптические свойства среды, в которой распространяется излучение:
n=n-in
Его вещественная часть nравна отношению скорости электромагнитного излучения в вакууме к фазовой скорости излучения в данной среде, мнимая частьn- показатель поглощения (часто обозначается как æ) – характеризует уменьшение интенсивности излучения в среде в результате поглощения.
Показатели преломления и поглощения среды являются функциями частоты, а в случае анизотропных сред они зависят и от направления распространения излучения. В этом случае они будут тензорами второго ранга
Тогда уравнение упрощается:
Е(в точке у) = Re{exp[-i (n - 1)(y)/c] Eo exp[i (t - y/c)]}
где n= 2303cN/2No
В этом модернизированном уравнении «мнимая» часть nкомплексного «показателя преломления»nпрямо пропорциональна молярному коэффициенту погашения для поглощения энергии веществом, в то время как «действительная» частьnкомплексного «показателя преломления» является обычным показателем преломления.
Вышеизложенное решение основано на допущении, что электромагнитная волна замедляется, и что ее энергия частично теряется при прохождении через тонкую пластину вещества. Если же мы теперь предположим, что заряды (электроны, протоны и т.п.) в веществе ведут себя подобно пружинкам под действием возбуждающих и тормозящих сил при внесении в переменное электрическое поле падающей электромагнитной волны, то легко понять, почему энергия поглощается веществом. Ответ заключается в том, что энергия растрачивается на преодоление сил трения при возбуждении колебаний пружины. Значительно труднее понять, почему падающая волна замедляется, и ответ на этот вопрос несколько выходит за рамки обсужденного материала. Для этого требуется провести расчет напряженности электрического поля, возникающего в месте нахождения отдаленного наблюдателя в результате одновременного когерентного вынужденного движения равномерно распределенных в пластине зарядов на пружинках при наличии тормозящих сил. Оказывается, что результирующее электрическое поле, образованное от всех этих пружин (в предельном случае очень тонкой бесконечной пластины) может быть записано очень просто в виде синусоидальной волны, которая на 90 не совпадает по фазе с падающей волной. Поэтому в результате суммирования электрического поля этой рассеянной волны и падающего (возбуждающего) электрического поля также должна образовываться синусоидальная волна, фаза которой в общем случае отличается от фазы падающей волны.
 Рис.1 Взаимосвязь
рассеяния вперед и преломления.
Рис.1 Взаимосвязь
рассеяния вперед и преломления.
Волна I после прохождения через тонкую пластинку вещества ослабляется и сопровождается рассеянной вперед волной S, которая смещена относительно нее по фазе на 90°. Эту рассеянную вперед волну можно рассматривать как сумму всех элементарных волн W, рассеянных частицами в пластинке. Результирующая волна R образуется при сложении падающей и рассеянной вперед волн. Она слегка отстает по фазе.
З десь
опущен математический аппарат, имеющий
отношение к предыдущим рассуждениям и
рисунку, поскольку он служит только для
нахождения константы пропорциональности
в уравнении:
десь
опущен математический аппарат, имеющий
отношение к предыдущим рассуждениям и
рисунку, поскольку он служит только для
нахождения константы пропорциональности
в уравнении:
Где ωо- собственная резонансная частота колебаний частиц пластинки, ω- циклическая частота поля падающей волны, f- коэффициент «трения» среды , q- заряд электрона, N- число молекул в единице объема, εо- диэлектрическая проницаемость и m- масса электрона (или иного заряда). Строго говоря, даже единичный атом может иметь много дискретных "собственных" частот ωо, так что на практике для оценки (n-1) необходимо в правую часть уравнения включить сумму многих членов, соответствующих разным ωо. Зависимость показателя преломления n' и молярного коэффициента погашения ε (который пропорционален n") от частоты приведена ниже на Рис.II.
Рис.2 Зависимость показателя поглощения n" и показателя преломления n' [отложена отрицательная величина -(n' - 1)] от длины волны падающего электромагнитного излучения
 Происхождение
терминов «поглощение» и «дисперсия»
теперь очевидны
n"-
пропорционален молярному коэффициенту
поглощения и n
- показателю преломления, изменение
которого приводит к «дисперсии»
(разложению) белого света на цветные
компоненты при прохождении через призму.
Большая часть применений показателя
преломления или оптической плотности
основаны либо на измерениях n'
и n"
(или чаще ε)
в зависимости от (возбуждающей) частоты
падающего света либо на использовании
n'
или n"
для измерения числа центров рассеяния
в единице объема
(или, чаще,концентрации поглощающих
молекул).
Происхождение
терминов «поглощение» и «дисперсия»
теперь очевидны
n"-
пропорционален молярному коэффициенту
поглощения и n
- показателю преломления, изменение
которого приводит к «дисперсии»
(разложению) белого света на цветные
компоненты при прохождении через призму.
Большая часть применений показателя
преломления или оптической плотности
основаны либо на измерениях n'
и n"
(или чаще ε)
в зависимости от (возбуждающей) частоты
падающего света либо на использовании
n'
или n"
для измерения числа центров рассеяния
в единице объема
(или, чаще,концентрации поглощающих
молекул).
