
Климанов Дозиметрическое планирование лучевой 2007
.pdf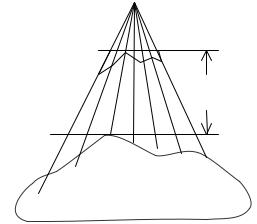
h’ 
d
h
Рис. 3.16. К расчету толщины компенсатора
Зависимость τ от параметров достаточно сложная, но если d ≥20 см, то в работе [6] рекомендуется брать среднее значение τ=0,7. Конечная толщина компенсатора определяется из формулы:
tc = TD (τ/ ρc ) ,
где tc – дефицит ткани; ρс– плотность материала компенсатора.
8. Позиционирование пациента
Современная техника лучевой терапии дает возможность достичь высокой точности в облучении пациентов при строгом соблюдении всех требований программы гарантии качества. Одним из слабых мест при этом является проблема точного позиционировании и иммобилизации пациентов.
Иммобилизация пациента является чаще всего весьма желательной, но иногда можно обойтись и без нее. Это зависит от позиции пациента и требований к точности отпускаемой дозы.
121
1,0
τ
0.9
0.8
0.7
0.6
0 |
5 |
10 |
15 |
20 |
25 |
30 d, см |
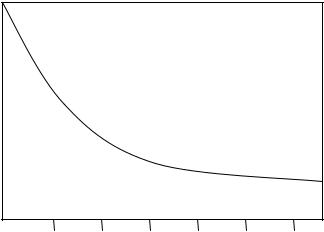
Рис. 3.17. Зависимость отношения τ от расстояния d между компенсатором и облучаемой поверхностью для пучка Co-60 размером 10х10 см2
Иммобилизационные устройства выполняют две фундаментальные функции:
-иммобилизацию (неподвижность) пациента во время облуче-
ния;
-предоставляют надежное средство для воспроизведения при облучении симуляционной позиции пациента и воспроизведения позиции пациента от сеанса к сеансу в процессе лучевого лечения.
Простейшие иммобилизационные устройства – это специальные ремни, эластичная тесьма, специальные ленты. В настоящее время многие фирмы наладили выпуск разнообразных иммобилизационных приспособлений, специализированных под конкретные локализации опухолей. Некоторые такие устройства показаны на рис. 3.18.
Пациенты редко облучаются в одной постоянной позиции. Обычно приходится перемещать пациента для облучения разными полями. Распространенной практикой для установки пучков в этом случае является использование меток, нанесенных на кожу. К сожалению эту методику по разным причинам нельзя считать надежной.
122

Рис.3.18. Иммобилизационные приспособления: наверху – подголовники; внизу – маска из термопластика
Вопросам точного позиционирования посвящено немало работ в литературе, но эта проблема остается областью большой вариации
123
при реальной лучевой обработке. Приведем некоторые общие рекомендации для корректного решения этой проблемы, сформулированные в работе [6].
·Если позволяет техника, то следует выбирать изоцентрический метод лучевого лечения, при котором пациент неподвижен.
·Изоцентрическую позицию достаточно просто установить и отрепетировать на симуляторе, используя переднюю и поперечную радиографию для определения мишени.
·Нельзя использовать на столах симулятора и облучателя подушки и матрацы. Голова должна находиться на твердой поверхности или на специальном подголовнике.
·По возможности пациента следует облучать в расслабленной позиции. Лазерную головную линию полезно использовать для выравнивания сагиттальной оси пациента относительно оси враще-
ния гантри.
·При определении локализации и границ полей лучше полагаться не на кожные метки, а на костные ориентиры, установленные при симуляции.
·При изоцентрической технике размеры поля должны определяться не на коже пациента, а в изоцентре.
·По возможности следует широко использовать иммобилизационные (фиксирующие) приспособления.
·Весьма желательно применение во время облучения средств контроля за неподвижностью пациента.
При изоцентрической технике изоцентр размещают внутри пациента, как правило, в центре объема мишени. Если эта точка локализована при симуляции, позиционирование при облучении проводится достаточно быстро и аккуратно. Рекомендуемые направле-
ния координатных осей при позиционировании показаны на рис. 3.19.
124
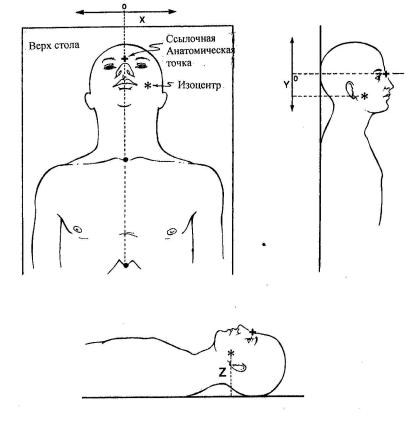
Рис. 3.19. Направления координатных осей, обычно применяемые при позиционировании
Контрольные вопросы к главе 3
1.Какие данные о пациенте требуются при проведении дозиметрического планирования?
2.Что необходимо учитывать при определении контура тела пациента?
3.В чем преимущества диагностики с помощью КТ перед традиционной рентгеновской диагностикой?
4.Как определяются числа Хаунсфильда?
5.Почему желательно предварительное симулирование облучения на специальных устройствах?
125
6.Что такое виртуальная симуляция?
7.В чем особенность “Beam’s eye view ”?
8.С какой целью используются контрольные снимки (пленочные порты) во время облучения?
9.Охарактеризуйте основные методы расчета поправок на нерегулярность контуров.
10.Какие методы считаются более точными при определении поправок на нерегулярность контуров?
11.В чем проявляется влияние негомогенностей?
12.Укажите области, где при наличии негомогенностей сильнее проявляется изменение потоков фотонов и где изменение потоков вторичных электронов.
13.Для каких спектров пучков влияние негомогенностей на величину дозы оказывается более значимым?
14.Охарактеризуйте достоинства и недостатки основных методов расчета поправок на негомогенности.
15.Что не учитывается при расчете поправки на негомогенности методом TAR?
16.В чем принципиальное отличие метода ETAR от других ме-
тодов?
17.Какие эффекты учитываются при расчете поправки на негомогенности методом DSAR?
18.Как изменяется доза внутри негомогенности по сравнению
сдозой в однородной тканеэквивалентной среде?
19.Как влияет спектр пучка на изменение дозы внутри негомогенности ?
20.В чем особенность дозового распределения вблизи границы раздела кость – ткань?
21.Как можно определить дозу в небольшом объеме ткани, находящегося внутри кости?
22.На какое расстояние вверх по пучку простирается влияние негомогенности на дозовое распределение?
23.В чем проявляется влияние воздушных полостей на изменение дозового распределения по сравнению с дозовым распределением в однородной тканеэквивалентной среде?
24.Что необходимо учитывать при расчете компенсаторов?
25.Что может являться причиной «перекомпенсации»?
26.Как проводится расчет толщины компенсатора?
126
27.Для чего используются иммобилизационные (фиксирующие) устройства?
28.Назовите наиболее важные рекомендации для правильного позиционирования пациентов.
29.Как рекомендуется направлять координатные оси при позиционировании пациентов?
127
Глава 4. Определение формы поля и дозы на кожу. Разделение полей
Основная трудность, возникающая при лучевой терапии опухолей, заключается в ограничении на максимальную дозу, которая может быть создана в опухолевом очаге. Причина этого ограничения связана с недопустимостью превышения толерантных доз для примыкающих к опухоли нормальных тканей и критических органов. Поэтому защита критических органов является одной из главных проблем радиотерапии. Для ее решения применяется в том числе и выбор подходящей формы полей. К этой проблеме примыкает и задача уменьшения дозы на кожу, являющейся одним из важных критических органов.
Другой важнейшей задачей лучевой терапии является подгонка и согласование (стыковка) смежных (примыкающих) полей. Такие ситуации возникают, когда имеющееся оборудование не позволяет создать поле, охватывающее весь объем мишени. В некоторых случаях объем мишени делится на две части и облучении второй части не начинается, пока не закончится курс облучения первой части. Такие схемы применяются, чтобы избежать интоксикации, связанной с облучением слишком большого объема ткани. Многопольное облучение смежными полями используется также в тех случаях, когда распределение опухоли или анатомия пациента не позволяют использовать компланарные поля.
Основная проблема в этой технике заключается в возможности появления экстремальной дозовой негомогенности в области перекрытия и сопряжения пучков. Из-за расходимости пучков сопрягаемые поля могут на некоторых глубинах перекрываться и тогда образуются районы с излишне высокой дозой или «горячие пятна».
1. Блокирование поля
Форма облучающих полей определяется, в первую очередь, формой опухоли и региональными метастазами. Для создания таких согласованных с формой опухолей полей может потребоваться сложная блокировка (экранирование части поля) с помощью защитных блоков.
128
1.1. Толщина блока
Защитные блоки часто делаются из свинца или его сплавов. Их толщина подбирается так, чтобы коэффициент прохождения первичного излучения через блок был не больше 5 %. В длинах слоев половинного ослабления (СПО) это составляет ~ 4,32 СПО. Для ортовольтового излучения тонкие слои из свинца или просвинцованной резины можно располагать прямо на коже, при облучении высокоэнергетическими пучками защитные блоки располагаются на специальных пластиковых подставках.
В идеале края блоков должны соответствовать дивергенции пучка. Однако опыт показывает, что такие блоки не имеют больших преимуществ перед обычными (с вертикальными стенками) в клинических условиях. Исключение представляют поля малых размеров.
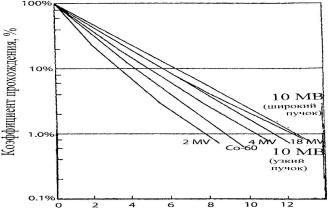
Толщина церробенда, см
Рис. 4.1. Зависимость коэффициента прохождения фотонов от толщины слоя церробенда для пучков разного спектра
1.2. Создание формы поля
Индивидуальные блоки сложной формы изготовляются из легкоплавких сплавов, например церробенда (температура плавления 70o, который заливается в формы из стирофома (англ. styrofoam). В
129
состав церробенда входят 13,3% олова, 50,0% висмута, 26,7% свинца и 10 % кадмия. Коэффициент прохождения фотонов через слой церробенда показан на рис. 4.1. Плотность церробенда при 20о равна 9,4 г/см3, в то время как у свинца она равна 11,3 г/см3. Многие фирмы выпускают автоматизированные установки, которые вырезают по заданной конфигурации 3-мерную форму из стирофома и заливают в нее легкоплавкий сплав.
1.3. Независимые коллимационные пластины
Для блокировки части поля без изменения позиции изоцентра часто используются асимметричные поля, которые достаточно легко создаются с помощью независимого движения шторок коллиматора (рис. 4.2.). Эта же техника применяется для сопряжения (стыковки) полей и расщепления пучка. Коллимационные пластины обеспечивают существенно большее ослабление излучения, чем церробендовые защитные блоки и легко управляются.
Глубинные дозовые распределения для асимметричных полей похожи на такие же для симметричных, если степень асимметрии не очень велика. Однако имеется заметное различие вблизи края поля между блокировкой с помощью защитных блоков и с помощью коллимационных пластин. Связано это с тем, что блоки и пластины коллиматора размещаются на разных расстояниях от пациента, что приводит к изменению размера полутени и поля рассеянного излучения. К сожалению, в большинстве систем планирования этот эффект не учитывается, и дозовые распределения от асимметричных полей рассчитываются так, как если бы они создавались с помощью защитных блоков.
Другой эффект асимметричной коллимации заключается в наклоне изодозовых кривых вперед к краю пластин в результате отсутствия рассеяния фотонов и электронов из блокированной части поля.
1.4. Многолепестковый коллиматор (МЛК)
Многолепестковый коллиматор (МЛК) впервые появился в Японии в 1960 г. В настоящее время МЛК получил широкое распространение и фактически заменил защитные блоки в современных онкологических клиниках. Многие фирмы разработали и вы-
130
