
5 и 6 группы
.pdf
В этой слабой четырёхосновной кислоте атомы фосфора имеют степень окисления +4 и непосредственно связаны друг с другом:
H H
O O
H O O H
P P
O O
Рис. 9. Строение молекул фосфорноватой и изофосфорноватой кислот
Н4Р2О6 − кислота средней силы (Ка1 = 6 10−2, Ка2 = 2 10−3, Ка3 = 5 10−8, Ка4 = 9 10-11). Сама фосфорноватая кислота и её средние и кислые соли устойчивы, для них характерны восстановительные свойства. В кристаллическомвидекислотуполучаютобменнойреакциейизгипофосфатасвинца(II):
Pb2P2O6 + 2H2S = H4P2O6 + 2PbS↓.
Раствор фосфорноватой кислоты можно получить осторожным окислением водной суспензии красного фосфора хлоритом натрия:
2P + NaClO2 + 2H2O = NaCl + H4P2O6 .
Высшие фосфорные кислоты существуют в виде большого числа форм: мономера (H3PO4) и полимеров, состоящих из тетраэдров РО4, связанных через общие вершины в цепочки или циклы. Все кислоты растворимы в воде. При разбавлении растворов полимерные формы разрушаются с постепенным отщеплением молекул Н3РО4. Так, при взаимодействии фосфорного ангидрида с водой на первой стадии в молекуле Р4О10 происходит разрыв двух кислородных мостиков с образованием четырёх связей Р−ОН:
Р4О10 + 2Н2О (НО)4Р4О8 ≡ Н4Р4О12 или (НРО3)4.
Тетраметафосфорная кислота (НРО3)4 имеет циклическое строе-
ние (рис. 10а).
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
P |
O |
P |
|
OH |
O |
HO |
O |
|
|
OH |
HO |
O |
|
O |
OH |
|||
|
O |
|
|
P |
P |
P |
P |
||
|
|
O |
|
|
|||||
HO |
|
|
|
|
|
O |
O |
|
|
|
O |
OH |
|
O |
HO |
|
|
||
|
P |
P |
|
|
|
HO |
|
||
|
|
|
|
|
|
|
|
||
|
O |
|
O |
|
|
|
|
|
|
Рис. 10. Строение молекул тетраметафосфорной и тетрафосфорной кислот
31
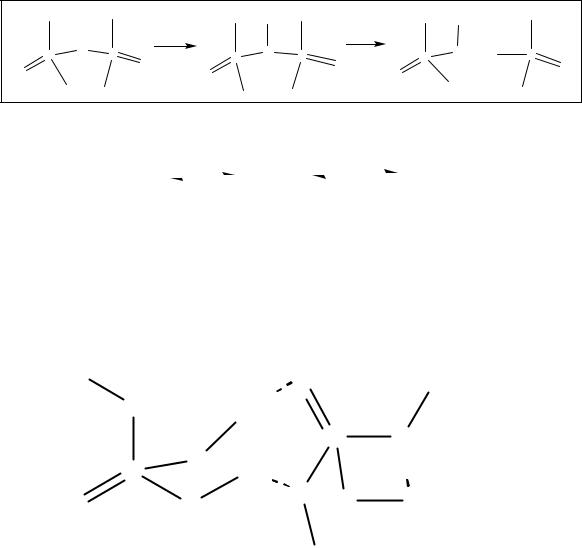
Дальнейшая гидратация тетраметафосфорной кислоты протекает с разрывом цикла с образованием шестиосновной тетрафосфорной ки-
слоты:
Н4Р4О12 + Н2О Н6Р4О13.
Далее гидратация идёт через стадии последовательного отщепления мономеров Н3РО4:
Н6Р4О13 + Н2О Н3РО4 + Н5Р3О10 (трифосфорная кислота),
Н5Р3О10 + Н2О Н3РО4 + Н4Р2О7 (дифосфорная кислота), с образованием в конечном итоге ортофосфорной кислоты:
Н4Р2О7 + Н2О 2Н3РО4.
Описанная гидратация полифосфорных кислот ускоряется при кипячении раствора, а также в присутствии сильных кислот, так как кислородные мостики Р–О–Р после протонирования разрываются легче:
|
|
|
|
+H+ |
H+ |
|
H |
|
|
|
|
|
|
|
|
|
+ |
||
|
O |
P |
|
|
O P |
|
P O |
||
P |
O |
P |
O |
P |
|||||
|
|||||||||
O |
|
|
O |
|
O |
O |
|||
|
|
|
|
|
|
При обезвоживании ортофосфорной кислоты (например, при нагревании) превращения протекают в обратном направлении:
|
|
- H2O |
|
- H2O |
|||||
H PO |
4 |
|
|
|
H4P2O7 |
|
|
|
(HPO3)n |
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
|
|
|
|||||||
3 |
|
|
|
|
|
|
|
|
|
Поликонденсация завершается образованием полиметафосфорных кислот, представляющих собой линейные полимеры, циклы и разветвлённые структуры.
Ортофосфорная кислота Н3РО4 (обычно ее называют просто фосфорной кислотой) − снегообразное, очень гигроскопичное вещество (tпл. = 42 °С). В воде хорошо растворяется с большим выделением теплоты. Молекулы Н3РО4 в водном растворе имеют форму искажённых тетраэдров, которые объединеныводороднымисвязями(рис. 11).
H O H
O H

P O P O H 

O O O O H
H
Рис. 11. Схема образования водородных связей между молекулами ортофосфорной кислоты
32
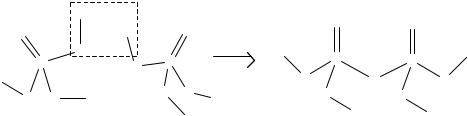
Это обстоятельство объясняет высокую вязкость концентрированных растворов Н3РО4. Получают ортофосфорную кислоту обработкой природных фосфатов серной кислотой:
Ca3(PO4)2 + 3H2SO4 3CaSO4↓ + 2H3PO4
или сжиганием фосфора в избытке воздуха с последующим поглощением Р4О10 разбавленной фосфорной кислотой или горячей водой (водяным паром). Потребителям кислота поставляется в виде сиропообразного 75÷85%-го раствора.
В отличие от многих других производных фосфора Н3РО4 не ядовита, но при попадании на кожу вызывает ожоги. Ортофосфорная кислота является
электролитом средней силы (Кa1 = 7,6 10−3, Кa2 = 6,2 10−8, Кa3 = 4,4 10−13) и образует средние соли (М3РО4) и два ряда кислых солей: М2НРО4 и МН2РО4.
Практически все ортофосфаты малорастворимы, исключение составляют соли щелочных металлов и аммония. Средние соли щелочных металлов в водныхрастворахсильногидролизованы:
РО43− + Н2О НРО42− + ОН− Кгидр.≈ 0,02.
рН одномолярных растворов равен 13. Гидрофосфаты гидролизуются гораздо в меньшей степени:
НРО42− + Н2О Н2РО4− + ОН− |
Кгидр.≈ 10−6. |
В растворах дигидрофосфатов среда кислая, так как кислотная дис- |
|
социация иона доминирует в сравнении с его гидролизом: |
|
Н2РО4− Н+ + НРО42− |
|
Н2РО4− + Н2О Н3РО4 |
+ ОН− |
(Ка2≈10−7 > Кгидр.≈ 10−12). |
|
Ортофосфорная кислота при обычных условиях мало активна и реа- |
|
гирует лишь с гидроксидами и карбонатами. Большинство металлов холодная Н3РО4 не растворяет, так как при взаимодействии на их поверхности образуется защитная фосфатная плёнка (солевая пассивация). Горячие растворы (t > 80 °C) ортофосфорной кислоты способны растворять даже неактивные оксиды (Al2O3, SiO2 и др.), стекло и силикаты. Однако, поскольку степень окисления +5 для фосфора очень устойчива, то даже концентрированная Н3РО4 не проявляет окислительных свойств.
Дифосфорная кислота Н4Р2О7 − белое вещество, по физическим свойствам похоже на ортофосфорную кислоту (tпл. = 61 °С). Эта кислота может быть получена нагреванием ортофосфорной кислоты при температуре ≈ 300 °С:
|
H |
|
|
|
|
|
|
O |
O |
|
|
|
O |
|
H |
|
O |
|
|
||||
|
|
|
|
|
|
|
|||||
|
O |
|
|
P |
|
|
H |
P |
P |
H |
+ H2O |
H |
P |
+ |
O |
|
|
O |
|
||||
|
|
|
|||||||||
|
|
|
|
O |
|
O |
|
||||
|
|
|
|
|
|
|
|
||||
|
O O H |
|
|
O |
O H |
O |
O |
|
|
||
|
|
|
|
|
H |
H |
|
H |
|
||
|
|
|
|
|
33 |
|
|
|
|
||
Дифосфорная кислота более сильный электролит, чем Н3РО4 (Кa1 =
= 3 10−2, Кa2 = 4,4 10−3, Кa3 = 2,5 10−7, Кa4 = 5,6 10−10). Так как констан-
ты диссоциации первой и второй ступени близки, то дифосфорная кислота наряду со средними солями М4Р2О7 образует только два типа кислых
солей: М2Н2Р2О7 и М3НР2О7.
Средние ортофосфаты устойчивы при нагревании до температур плавления (свыше 1000 °С). Исключение составляют Hg3(PO4)2 и (NH4)3PO4:
(NH4)3PO4 = 3NH3↑+ H3PO4.
Кислые фосфаты при нагревании в результате реакции конденсации переходят в менее протонированные или средние соли:
2Na2HPO4 = H2O + Na4P2O7 |
(при 200 °С), |
|
nNaH2PO4 = nH2O + (NaPO3)n |
(при t ≥ 400 |
°C). |
Полифосфаты цепочечного строения при плавлении образуют смешанные полифосфаты. Циклические полифосфаты при прокаливании от-
щепляют Р2О5:
2Ca3(P3O9)2 = 3P2O5 + 3Ca2P2O7, 3Ca2P2O7 = P2O5 + 2Ca3(PO4)2.
Качественные реакции на фосфат-ионы. Орто- и гидрофосфат-ионы образуют желтые осадки с нитратом серебра и «молибденовой жидкостью»:
3AgNO3 + Na2HPO4 = Ag3PO4↓+ HNO3 + 3NaNO3,
12(NH4)2MoO4 + 23HNO3 + Na2HPO4 = (NH4)3H4[P(Mo2O7)6]↓ + 21NH4NO3 + + 2NaNO3 + 10H2O.
Дифосфат- и гидродифосфат-ионы, в отличие от других фосфатов, реагируют с ацетатом цинка с образованием белого осадка дифосфата цинка:
2Zn(CH3COO)2 + Na2H2P2O7 = Zn2P2O7↓+ 2CH3COONa + 2CH3COOH.
Полиметафосфорная кислота и её соли − MIPO3 − обладают свойством свертывать белки, а также образуют белый осадок с хлоридом бария в
3М HCl:
BaCl2 + 2NaPO3 = Ba(PO3)2↓+ 2NaCl.
Кислородсодержащие соединения мышьяка, сурьмы и висмута
У мышьяка, сурьмы и висмута существуют оксиды As2O3, As2O5, Sb2O3, Sb2O4, Sb2O5, Bi2O3, Bi2O5. Высшие оксиды имеют кислотный характер, а характер оксидов Э2О3 при движении по группе вниз изменяется от кислотного к основному. Для оксидов, гидроксидов и солей As(III), Sb(III), Bi(III) окислительно-восстановительные свойства не характерны, однако в этом ряду медленно нарастают окислительные свойства. В ряду кислородсодержащих соединений As(V), Sb(V), Bi(V) окислительные свойства возрастают очень сильно – производные Bi(V) относятся к сильнейшим окислителям.
34

Оксид мышьяка (III) As2O3 − твёрдое вещество белого цвета («белый мышьяк»), легко возгоняется (tвозг. = 218 °С). В газообразной и твёрдой фазах состоит из молекул As4O6 (кубическая модификация, tпл. = 274 °С). Существуют и менее летучие модификации − моноклинная (tпл. = 315 °С) и стеклообразная (tкип. = 460 °С), представляющие собой слоистые полимеры, состоящие из пирамид [AsO3]. As2O3 растворяется в воде (2 г на 100 г воды при 20 °С), ещё лучше − в щелочах и в галогенводородных кислотах:
As2O3 + 3H2O = 2H3AsO3,
As2O3 + 6KOH = 2K3AsO3 + 3H2O,
As2O3 + 2KOH + 3H2O = K[As(OH)4] (в избытке щёлочи), As2O3 + 8HCl 2H[AsCl4] + 3H2O.
Однако с кислородсодержащими кислотами As2O3 не реагирует, поэтому этот оксид относят к кислотным оксидам.
Несмотря на то, что оксид мышьяка(III) легко образуется при сгорании мышьяка и его сульфидов в кислороде воздуха:
4As + 3O2 = 2As2O3,
на практике его получают гидролизом AsCl3 в кипящей воде: AsCl3 + 3H2O As2O3↓ + HCl↑.
Мышьяковистая кислота H3AsO3 − существует |
|
|
лишь в водных растворах. Её молекулы имеют форму пи- |
|
|
рамиды, что свидетельствует об sp3-гибридизации атом- |
|
As |
ных орбиталей мышьяка и наличии у него неподеленной |
|
|
электронной пары. Мышьяковистая кислота − очень сла- |
HO |
OH |
бый электролит (Кa1 = 6 10−10), слабее угольной кислоты. |
HO |
|
При взаимодействии с растворами щелочей образует со- |
|
|
ли − ортоарсениты: |
|
|
H3AsO3 + 3NaOH = Na3AsO3 + 3H2O
Растворимы в воде только арсениты щелочных металлов. Метаформа мышьяковистой кислоты HAsO2 не выделена, однако ее производные − метаарсениты − известны. Это полимерные вещества, состоящие из цепочек пирамид AsO3, связанных через общие атомы кислорода. Метаарсениты щелочных и щелочно-земельных металлов легко получаются
при дегидратации гидроксокомплексов: |
|
Na[As(OH)4] = NaAsO2 + 2H2O |
(при нагревании). |
Мышьяковистая кислота проявляет очень слабые амфотерные свойства (Кb = 10−14) с концентрированными галогенводородными кислотами:
H3AsO3 + 3HCl AsCl3 + 3H3O,
AsCl3 + HCl H[AsCl4].
H3AsO3 и арсениты проявляют слабые восстановительные свойства и могут быть окислены до соединений мышьяка(V):
H3AsO3 + Br2 + H2O H3AsO4 + 2HBr ;
35

( Е0реакц.= Е0(Br2/Br−) − E0(H3AsO4/H3AsO3) = +1,09−0,56 = +0,53 B).
Получают растворы мышьяковистой кислоты растворением в воде «белого мышьяка» (см. свойства As2O3).
Оксид мышьяка (V) As2O5 − гигроскопичное белое стекловидное вещество, похожее на оксид фосфора(V). При нагревании выше 315 °С разлагается:
As2O5 = As2O3 + O2.
Это кислотный оксид и при растворении в воде образует ортомышьяковую кислоту:
As2O5 + 3H2O = 2H3AsO4.
Получают мышьяковый ангидрид из H3AsO4 осторожным нагреванием при температуре 280−300 °С:
2H3AsO4 = As2O5 + 3H2O.
Ортомышьяковая кислота H3AsO4 − кристаллическое вещество белого цвета (tпл. = 35,5 °С), очень гигроскопичное и хорошо растворимое в воде: Кa1 = 6,3 10−3, Кa2 = 1,2 10−7, Кa3 = 3,2 10−12. H3AsO4 образует три ряда солей − ортоарсенатов − изоморфных соответствующим ортофосфатам, например, Na3AsO4, Na2HAsO4, NaH2AsO4. По поведению в водных растворах (гидролиз, реакции осаждения) средние и кислые соли мышьяковой кислоты аналогичны фосфатам.При нагревании, по мере повышения температуры, H3AsO4 превращается в димышьяковую кислоту, затем в полимерную метамышьяковую кислоту, с образованием в конечном итоге
As2O5:
-H2O -H2O -H2O
H3AsO4---------->H4As2O7------------->(HAsO3)n------------->As2O5
Ортомышьяковая кислота, в отличие от H3PO4, проявляет слабые окислительные свойства (Е0(H3AsO4/H3AsO3) = +0,56 В):
H3AsO4 + 2KI + H2SO4 H3AsO3 + I2 + K2SO4 + H2O.
Это одна из немногих обратимых окислительно-восстановительных реакций − в щелочной среде она протекает справа налево.
H3AsO4 получают следующим образом: As2O3 + 2HNO3 + 2H2O = NO2 + NO + 2H3AsO4.
Оксид сурьмы (III) − твердое вещество (tпл. = 655 °С) белого цвета, малорастворимое в воде (0,002 г в 100 мл Н2О при 17 °С). В газообразном и твёрдом содержит молекулы Sb4O6 и подобен кубической модификации As2O3. В отличие от последнего, Sb2O3 проявляет ярко выраженные амфотерные свойства:
Sb2O3 + 3H2SO4 (конц.) = Sb2(SO4)3 + 3H2O,
Sb2O3 + 2NaOH + 3H2O = 2Na[Sb(OH)4].
В галогенводородных кислотах оксид сурьмы (III), так же как и As2O3, растворяется с образованием комплексов:
В разбавленных растворах кислот образуются основные соли. 36
Sb2O3 + 12HCl = 2H3[SbCl6] + 3H2O.
Гидроксид сурьмы (III) образуется в виде белого осадка неопределённого состава Sb2O3 nH2O при действии растворов щелочей на соли сурьмы (III) или трихлорид сурьмы:
2SbCl3 + 6NaOH +(n-3)H2O = Sb2O3 nH2O↓ + 6NaCl.
Он проявляет амфотерные свойства, легко растворяясь в кислотах и щелочах.
Соли Sb3+ в водных растворах неустойчивы и гидролизуются с образованием смеси основных солей, содержащих оксо- и гидроксогрупы, например, Sb2O4(OH)2(NO3)2, Sb6O7(SO4)2 и др. Эти полиядерные соединения состоят из пирамид [SbO3], соединённых мостиковыми атомами кислорода, нитратными и сульфатными группами, для простоты формулы таких солей условно записывают как соли стибила SbO+: (SbO)NO3, (SbO)2SO4.
Оксид сурьмы (V) Sb2O5 – бледно-жёлтый порошок, малорастворимый в воде (0,2 г в 100 мл H2O при 20 °С). Это кислотный оксид – его водный раствор имеет кислую реакцию. При нагревании (t > 350 °C) оксид сурьмы (V) разлагается с образованием смешанного оксида сурьмы
(III,V) – Sb2O4:
2Sb2O5 = 2Sb2O4 + O2.
При растворении Sb2O5 в растворах щелочей образуются гидроксокомплексы:
Sb2O5 + 2NaOH + 5H2O = 2Na[Sb(OH)6].
Соединения сурьмы(V) проявляют окислительные свойства, поэтому при взаимодействии Sb2O5 c концентрированной соляной кислотой протекает обратимая окислительно-восстановительная реакция:
Sb2O5 + 16HCl 2H3[SbCl6] + 2Cl2 + 5H2O.
Сплавлением Sb2O5 с оксидами металлов получаются соли стибаты (антимонаты) как мета-, так и орто-форм, например, NaSbO3, AlSbO4.
Получают Sb2O5 обезвоживанием сурьмяной кислоты: 2H3SbO4 = Sb2O5 + 3H2O.
Сурьмяная кислота Sb2O5 nH2O (условная формула: H3SbO4) – плохо растворимый в воде белый порошок, который получают по реакции:
2Sb + 2nHNO3(конц.) = Sb2O5 nH2O↓ + 2nNO2,
либо гидролизом SbCl5 при нагревании:
2SbCl5 + (5+n)H2O = Sb2O5 nH2O↓ + 10HCl.
При нагревании (t < 400 °C) кислота переходит в оксид сурьмы (V). Растворением сурьмяной кислоты в концентрированных растворах щёлочи получают стибаты (антимонаты), которые существуют в форме гекса- гидроксостибат-ионов [Sb(OH)6]–:
Sb2O5 nH2O + 2NaOH +(5–n)H2O 2Na[Sb(OH)6].
37
В слабощелочной среде в результате реакций поликонденсации образуются многоядерные оксогидроксокомплексы сложного состава.
Оксид висмута Bi2O3 − бледно-жёлтое кристаллическое вещество, существует в четырех модификациях. При комнатной температуре устой-
чива α-модификация (tпл. = 824 °С, tкип. = 1890 °С, летуч при t > 950 °C). Bi2O3 не растворяется в воде, но растворим в сильных кислотах:
Bi2O3 + 6HNO3 = 2Bi(NO3)3 + 3H2O.
Оксид висмута(III) относят к основным оксидам. Однако расплавленный Bi2O3 реагирует с основными оксидами, образуя висмутиты:
Bi2O3 + 3Li2O = 2Li3BiO3.
Висмутиты щелочных металлов полностью разлагаются водой до гидроксида висмута (III):
Li3BiO3 + 3H2O = Bi(OH)3↓ + 3LiOH.
В очень концентрированных растворах щелочей Bi2O3 растворяется, образуя гидроксокомплексы:
Bi2O3 + 6NaOH + 3H2O = 2Na3[Bi(OH)6].
Гидроксокомплексы висмута(III) являются димерами –
Na6[Bi2O2(OH)6](OH)2.
Получают Bi2O3 термическим разложением нитрата висмута(III):
2Bi(NO3)3 = 2Bi2O3 + 2NO2 + O2.
Гидроксид висмута (III) имеет переменный состав, но ему обычно приписывают формулу Bi(OH)3. Это белое малорастворимое в воде вещество при нагревании отщепляет воду, превращаясь в оксид. Гидроксид висмута (III) является основанием с очень слабо выраженными амфотерными свойствами.
В растворах соли Bi3+ устойчивы только в присутствии избытка соответствующих кислот. При рН 2−4 они гидролизуются, образуя основные соли, содержащие многоядерные катионы:
6Bi3+ + 8H2O [Bi6O4(OH)4]6+ + 12H+.
Соли оксо-гидроксокомплекса висмута (III) могут быть выделены в твёрдом виде, например, нитрат − [Bi6O4(OH)4](NO3)6 H2O, которому ранее приписывали формулу (BiO)NO3 0,5H2O.
В присутствии галогенид-ионов соли Bi3+ гидролизуются с образованием малорастворимых осадков оксогалогенидов висмута(III):
Bi3+ + Cl− + H2O BiOCl↓+ 2H+.
Гидроксид висмута (III), в отличие от гидроксида сурьмы (III), проявляет слабые окислительные свойства и может быть восстановлен соединениями олова(II):
2Bi(OH)3 + 3Na2[Sn(OH)4] = 2Bi↓+ 3Na2[Sn(OH)6].
38
Эта реакция используется в аналитической химии для обнаружения ионов висмута (III). Кроме того, ионы Bi3+ можно определить по образо-
ванию растворимого комплекса желтого цвета с тиомочевиной: Bi3+ + 3SC(NH2) = [Bi(SC(NH2))3]3+.
Гидроксид висмута (III) получают приливанием раствора нитрата висмута(III) к раствору щелочи:
3NaOH + Bi(NO3)3 = Bi(OH)3↓+ 3NaNO3.
При обратном порядке сливания растворов осаждается малорастворимая основная соль:
Bi(NO3)3 + 2NaOH = (BiO)NO3↓ + 2NaNO3 + H2O.
Оксид висмута (V) Bi2O5 – красно-коричневое твердое вещество, можно получить взаимодействием Bi2O3 с озоном. Bi2O5 очень плохо растворяется в воде, при нагревании разлагается с постепенным отщеплением кислорода:
2Bi2O5 = 2Bi2O4 + O2, 2Bi2O4 = 2Bi2O3 + O2.
Достоверные данные о существовании гидроксида висмута (V) отсутствуют. Однако окислением соединений висмута (III) в щелочной среде сильными окислителями можно получить соединения висмута (V) неопределенного состава – висмутаты, которым для простоты приписывают условную формулу MIBiO3:
Bi2O3 + 2Na2O2 = 2NaBiO3 + Na2O,
Bi2O3 + 6NaOH + 2Br2 = 2NaBiO3↓+ 4NaBr + 3H2O.
Оксид висмута (V) и висмутаты – сильные окислители. Стандартный окислительно-восстановительный потенциал в кислой среде NaBiO3→Bi3+ составляет +1,8 В. Висмутаты в лабораторной практике широко используются в качестве эффективных окислителей. Например, для качественного обнаружения ионов Mn2+ в растворе применяют реакцию:
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O.
1.2.3. Галогениды
Соединения азота с галогенами
Трифторид азота NF3 − бесцветный нерастворимый в воде газ (tкип. = −129 °C). Являясь формально фторангидридом азотистой кислоты, при обычных условиях он не реагирует ни с водой, ни с щелочами. Реакции начинают протекать при активации электрическим разрядом или температуре выше 100 °С.
В обычных условиях хлор и бром энергично окисляют аммиак до азота: 8NH3 + 3Cl2 = 6NH4Cl + N2.
39

Однако при отрицательных температурах хлор в газообразном или жидком аммиаке диспропорционирует с образованием хлорамина и хло-
рида аммония:
2NH3 + Cl20 = Cl+1NH2 + NH4Cl–1.
Хлорамин ClNH2 − жидкое вещество (tпл. = −70 °С), хорошо растворимое в воде и в эфире. Чистый хлорамин при температурах выше −40 °С разлагается с взрывом. ClNH2 проявляет окислительные свойства, т.к. содержит хлор в степени окисления +1:
ClNH2 + 2KI + H2O = I2 + NH3 + KOH + KCl.
При действии иода на водный раствор аммиака выделяется чёрный кристаллический осадок трииодида азота (нитрид иода(I)):
4NH3 + 3I2 = I3N ↓ + 3NH4I.
Влажный I3N безопасен, однако в сухом виде взрывается даже при перепаде давления воздуха. Аналогичное соединение аммиак образует и с хлором – Cl3N.
Трихлорид азота (нитрид хлора(I)) Cl3N − чрезвычайно взрывчатое вещество. Его разбавленные растворы в CCl4, CHCl3 или бензоле безопасны. Получают Cl3N, пропуская хлор в водный раствор соли аммония в присутствии CCl4:
NH4Cl + 3Cl2 = Cl3N + 4HCl.
Нитрид хлора(I) в воде медленно разлагается с образованием хлорноватистой кислоты:
Cl3N + 3H2O = 2HClO + NH4ClO.
Соединения фосфора с галогенами
Фосфор образует простые галогениды – PHal3, PHal5, оксогалогени- |
||
ды – POHal3 и комплексные галогениды – [PHal6]–. |
|
|
Тригалогениды фосфора: PF3 – газ (tкип. = –101,5 °С), |
|
|
PCl3 – жидкость (tкип. = 75,3 °С, tпл. = –90,3 °С), PBr3 – жид- |
|
P |
кость (tкип. = 175,3 °С, tпл. = –40,5 °С), PI3 – твёрдое вещество |
|
|
(tпл. = 61 °С). Молекулы имеет форму тригональной пирами- |
F |
F |
ды (sp3-гибридизация атомных орбиталей фосфора). |
|
F |
Наличие электронной пары на атоме фосфора обуслов- |
|
|
|
|
|
ливает их донорные свойства:
:PCl3 + BCl3 = Cl3P→BCl3,
в том числе способность выступать лигандами в комплексных соединениях. Тригалогениды фосфора легко окисляются галогенами и кислородом:
PCl3 + Cl2 = PCl5,
2PCl3 + O2 = 2POCl3.
Как типичные галогенангидриды, тригалогениды фосфора разлагаются водой, образуя фосфористую кислоту:
PCl3 + 3H2O = 3HCl + H2[HPO3].
40
