
- •Физико-химические методы исследования лекарственных препаратов Одесса – 2010 Содержание:
- •Адитивность свойств органических соединений
- •Методы установления частоты и индивидуальности. Хроматографические методы
- •Классификация хроматографий
- •Плоскостная или тонкослойная хроматография (тсх).
- •Газожидкостная хроматография
- •Принципиальная схема газового хроматографа:
- •Параметры газовой хроматограммы
- •Спектральные методы анализа
- •Уф – спектроскопия
- •Спектры и их связи со структурой вещества
- •Сущность поглощения
- •Поглощение различных классов
- •Ненасыщенные углеводороды
- •Карбонильные соединения
- •Ароматические соединения
- •Ик-спектроскопия
- •Виды колебаний
- •Ик-спектрограф
- •Интерпретация ик-спектра
- •Ямр – спектроскопия
- •Пмр – спектроскопия
- •Процессы релаксации
- •Химический сдвиг
- •Классификация спиновых систем
- •Методы упрощения спектров
- •Гетероядерная спектроскопия
Спектры и их связи со структурой вещества
Было замечено, что вещества обладающие одинаковой структурой имеют различные спектры.
1. Тестостерон

2. Окись визидила


Из приведённого примера следует, что поскольку для веществ обладающих различной структурой содержащий один и тот же структурный фрагмент вид УФ спектров одинаков, то очевидно, что наличие именно этого фрагмента и определяет поглощение молекулой энергии в УФ области. Такие фрагменты называются хромофорами или хромофорными группировками. Как правило они представляют собой ковалентные насыщенные фрагменты. На ряду с хромофорными группировками в молекуле могут присутствовать ауксохромные группировки (Hal, OH, NH2), которые сами не поглощают излучение, но оказывают влияние на положение λmax или значение оптической плотности.
Таким образом УФ спектроскопия – является спектроскопией функциональных групп.
Поскольку положение λmax зависит от наличия ауксохромных группировок, то его значения может сдвигаться при введении заместителя в сторону больше или меньше длин волн. Сдвиг λmax в сторону меньших длин волн называется гипсохромным или синим сдвигом. Увеличение оптической плотности раствора называется гиперхромным эффектом.
Уменьшение оптической плотности раствора под влиянием заместителя называется гипохромным эффектом.
Сущность поглощения
Как уже отмечалось ранее поглощение излучения находящихся на внешних молекулярных орбиталях. Молекулярные орбитали возникают в результате линейной комбинации атомных орбиталей. При этом каждой связывающей орбитали отвечает своя разрыхляющая. Все эти орбитали имеют различную энергию и в соответствии с ее величиной располагаются следующим образом.
Энергетическая диаграмма
Е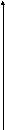









 σ*
σ*
π*
n
π
σ
При поглощении излучения в УФ области электроны находящиеся на нижних связывающих орбиталях возбуждаются и переходят на верхние разрыхляющие. Такой переход обозначают стрелочкой и записывают σ→σ*, π→π*. Для того чтобы такой переход произошел необходимо сообщить электрону строго определенную порцию энергии равную разности энергий уровней между которыми происходит переход. А значит излучение своей строго определенной длины волны.
Поглощение различных классов
Предельные углеводороды
У предельных углеводородов есть только связи, а соответственно возможен только * переход (→*). Для такого перехода требуется относительно большое количество энергии, что соответствует коротким длинам волн излучений. Можно предположить, что эти вещества будут поглощать в коротковолновой части спектра. И действительно метан (CH4) поглощает при 125 нм, этан – при 135 нм.
Введение гетероатомов, содержащих неподеленные электронные пары приводить к возможности перехода, который требует меньше энергии, а значит поглощение должно наблюдаться при большей длинах волн. И действительно, метанол (CH3OH) поглощает при 177 нм, хлористый метил (CH3Cl) – 173 нм, йодистый метил (CH3I) – 253 нм.
