
- •Экзаменационный билет №19
- •2. В аптеку поступил рецепт на изготовление порошков.
- •4. Дайте характеристику природному растительному источнику кодеина и папаверина:
- •5. На фармацевтическом производстве выпуск представленных лекарственных препаратов (таблеток фенобарбитала и бензонала) осуществляется в соответствии с пр.
- •6. Как можно масштабировать получение аминокислот в условиях биотехнологического производства?
Экзаменационный билет №19
1. Фармацевтическая фирма-дистрибьютер закупила таблетки фенобарбитала и бензонала. В целях исключения возможной фальсификации Вам необходимо установить подлинность действующих веществ в таблетках и оценить их качество.
Приведите химические формулы фенобарбитала и бензонала, охарактеризуйте химическое строение каждого из них.
Обоснуйте возможность использования физико-химических свойств для оценки качества, приведите нормативные показатели. Предложите групповые и дифференцирующие реагенты для установления подлинности каждого из них, обоснуйте условия проведения реакций.
Обоснуйте возможные методы количественного определения в субстанции и таблетках, приведите расчетные формулы.
Ответ
Фенобарбитал (Phenobarbitalum ,Phenobarbital)
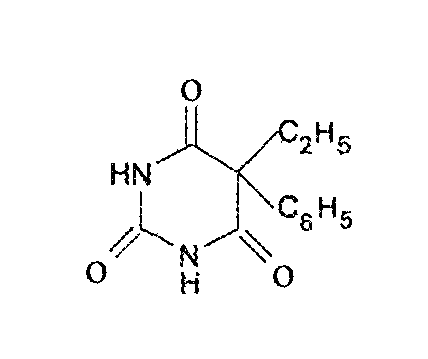
Функц Гр: основа – лактамная форма барбитуровой к—ты, 2 имидных группы
Бел крист порошок без запаха, горького вкуса, р-рим в эфире, 95% спирте, р-рах щелочей, очень мало в холодной воде, трудно в горячей воде, хлороформе.
Бензонал (Benzonalum, Benzonal)
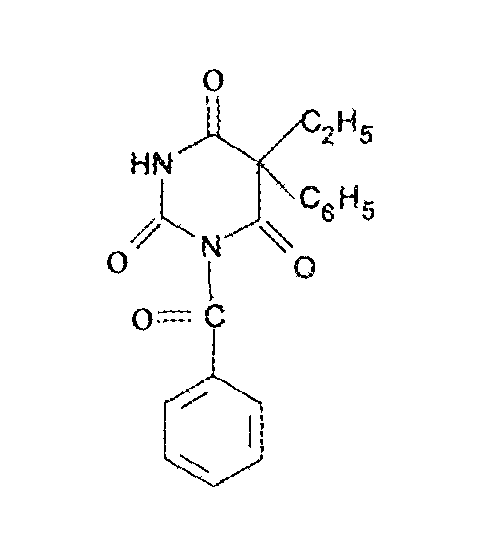
Функц Гр: Функц Гр: основа – лактамная форма барбитуровой к—ты, имидная и амидная группы Белый крист порошок, очень мало р-рим в воде, легко в хлороформе, р-рим в эфире, трудно р-рим в спирте
2. Фенобарбитал: ПОДЛИННОСТЬ: 1.ИК 2. Tпл=174-178 3. Хим р-ции. 1. Общей гр реакцией на все барбитураты является р-я комплексообразования с солями кобальта (кроме тиопентала-натрия). 0,05 препарата р-ряют в 2 мл 95% спирта, прибавляют 1 каплю кальция хлорида, 2 капли р-ра нитрата кобальта, 2 капли NaOH, появляется сине-фиолетовое окрашивание. Реакция основана на образовании комплексных соли.
2. Реакция комплексообразования с меди сульфатом в присутствии карбоната и гидрокарюоната калия. Барбитураты образубт комплексные соединения, имеющие различную окраску: 0,1 препарата взбалтывают с 1мл 1% NaOH, прибавляют 0,2 мл р-ра карбоната и гидрокарбоната калия, 0,1 мл сульфата меди, образуется осадок бледно-сиреневого цвета, не изменяющийся при стоянии, засчет образования комплексной соли.
Примеси: хлориды, сульфаты, фенилбарбитуровая к-та (с метиловым красным), орг примеси, сульфатная зола, тяжелые металлы. (см по ГФ)
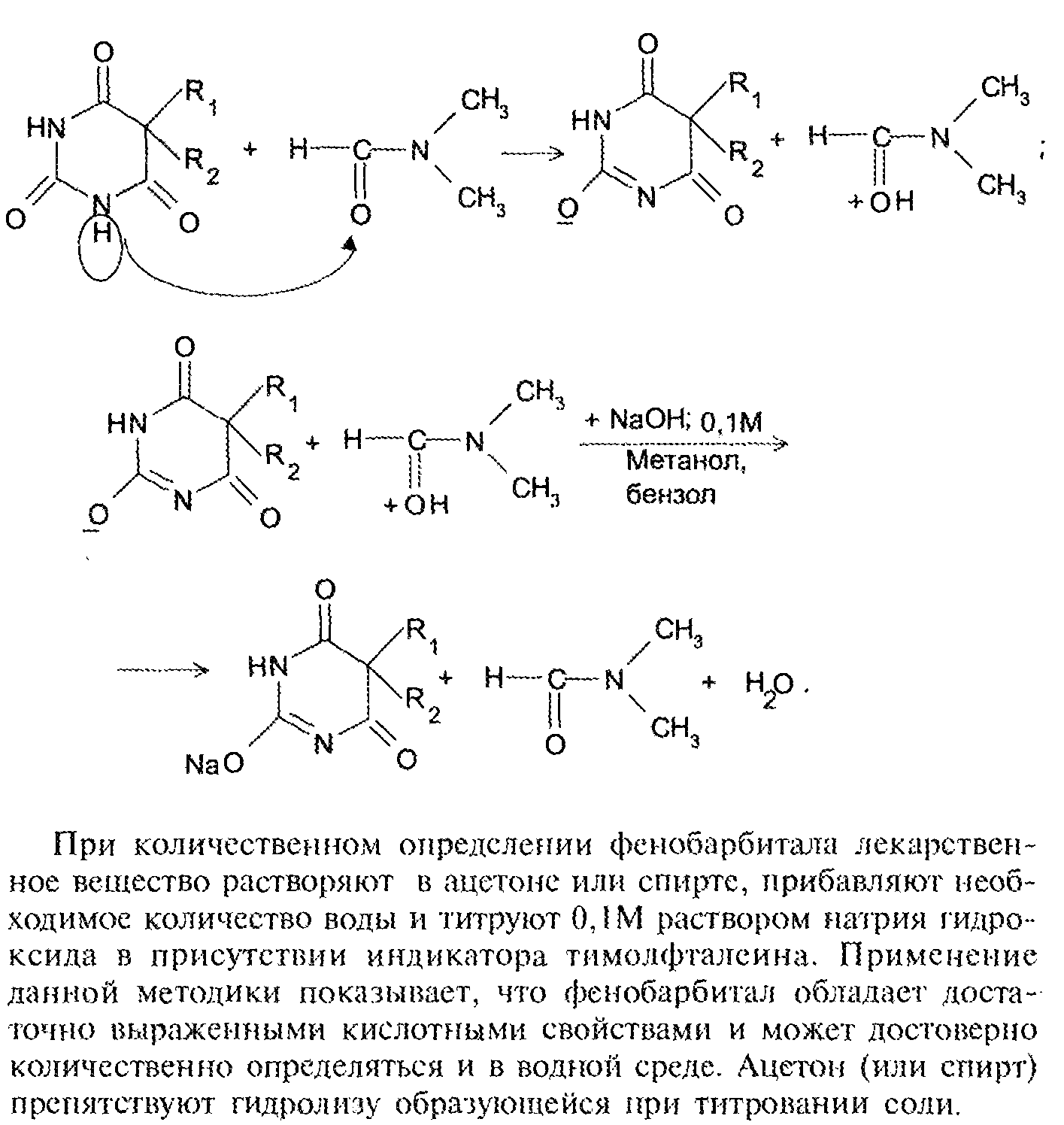
Количественное определение:
Препараты лактамной (кислотной) формы количественно определяют методом КО-титрования. В качестве протофильного растворителя исполбзуют ДМФА. Титрант – 0,1 М р-р натрия гидроксида в смеси метанола и бензола. Индикатор – тимоловый синий.
Fэкв=1
В ТЭ р-р приобретает синее окрашивание.
При количественном определении фенобарбитала лекарственное вещество растворяют в ацетоне или спирте, прибавляют необходимое количественное воды и титруют 0,1М раствором натрия гидроксида в присутствии индикатора тимолфталеина. Применение данной методики показывает, что фенобарбитал обладает достаточно выраженными кислотными свойствами и может достоверно количественно определяться и в водной среде. Ацетон (или спирт) препятствуют гидролизу образующейся при титровании соли.
Бензонал: ПОДЛИННОСТЬ: 1. ИК. 2. Тпл=134-138, 3. Хим р-ции 1) аналогична 1ой р-ции фенобарбитала. 2) к 0,2 преп + 10 кап 1% р-ра NaOH, 0,2 мл р-ра карбоната и гидрокарбоната калия, 0,1 мл сульфата меди, появл серо-голубое окрашивание.
Остальное аналогично фенобарбиталу.
Дифференцирующие реагенты:
Конденсация с ароматическими альдегидами
Барбитураты способны к конденсации с альдегидами в присутствии концентрированной
серной кислоты как водоотнимающего и окислительного реагента. При выборе соответствующего альдегида и условий можно получить специфически окрашенный продукты, позволяющие идентифицировать отдельный лекарственные вещества.
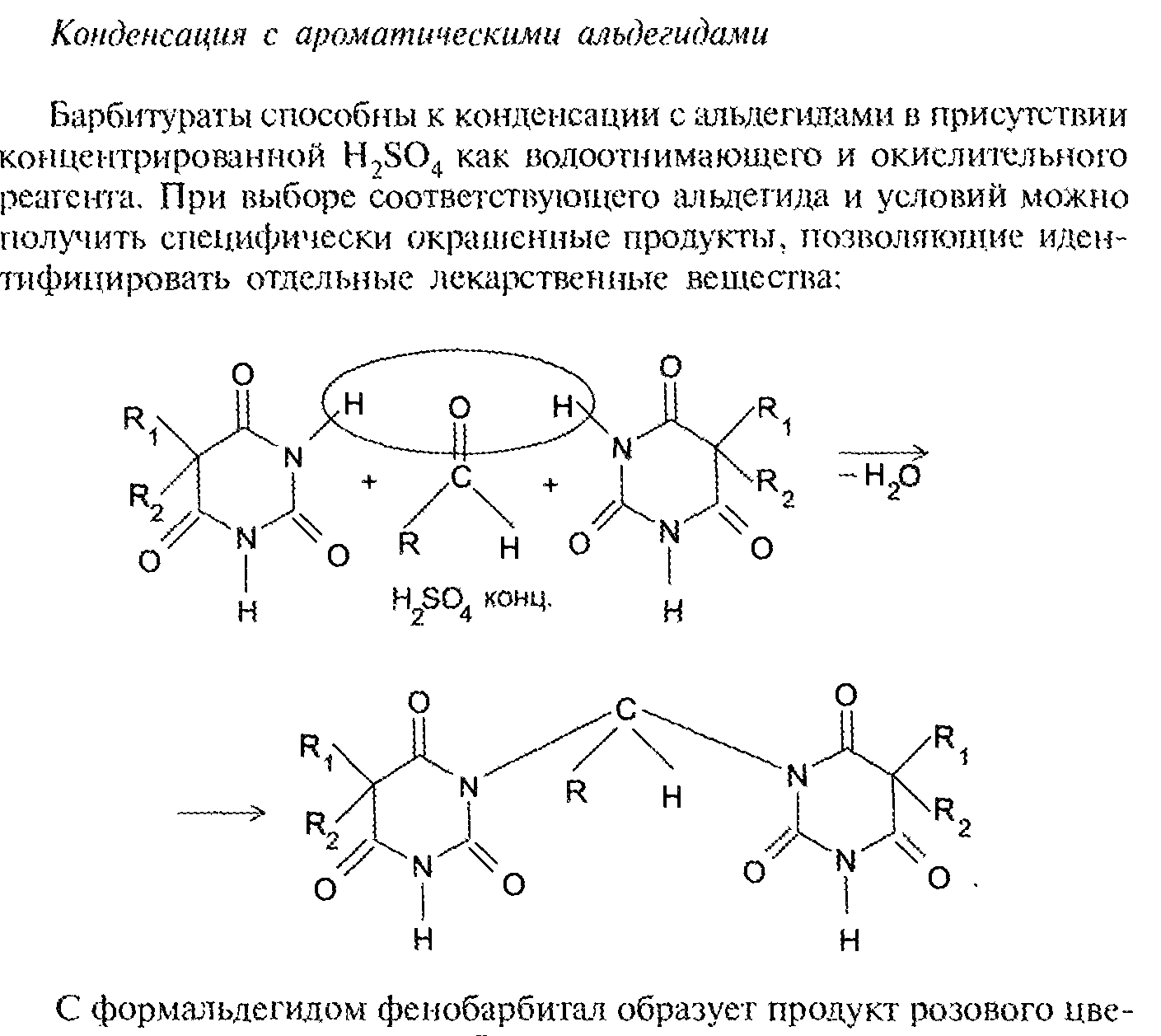

Фенобарбитал имеет в 5-м положении фенильный радикал, по которому возможны Se-реакции, например нитрование с последующим восстановлением нитрогруппы, диазотированием и азосочетанием
Фрагмент бензойной кислоты в бензонале открывают после гидролиза взаимодействием с солями трехвалентного железа (появляется осадок оранжево-желтого цвета). По амидной группе препарат вступает в реакцию гидроксамовой пробы.
Гидроксаматы железа представляют собой растворы красно-фиолетового цвета, а гидроксаматы меди – осадок бирюзового цвета.
Количественное определение индивидуальных препаратов, особенно для их ЛФ применяют физико-химические методы анализа, такие как ВЭЖХ, ТСХ, ГЖХ, спектрофотомерия. Также можно использовать гравиметрию и аргентометрию в прямом и обратном вариантах.

