
методичка по Химии
.pdf
рицательном электроде-аноде (А) происходит реакция окисления, а освободившиеся за счет этого электроны переходят по внешней цепи на положительный электрод-катод (К), где происходит реакция восстановления.
Работа гальванического элемента, протекающая обычно в изотермических условиях, т.е. при постоянном давлении и температуре, является самопроизвольным процессом. Поэтому в ходе его происходит уменьшение энер-
гии Гиббса ( G), равное максимальной работе элемента (Ам) |
|
|
Ам = nFE0, |
(6) |
|
где Е0 – стандартная ЭДС гальванического элемента. |
|
|
Ам = – |
G, |
(7) |
где G0 – энергия Гиббса в стандартных условиях. |
|
|
– G0 = nFE0, тогда |
(8) |
|
Е0 = – |
G0/nF . |
(9) |
Используя табличные значения G0 для веществ - участников реакций, можно рассчитать энергию Гиббса и ЭДС для любой окислительновосстановительной системы.
Например, для элемента ГРЕНЭ (1856 г.) токообразующая реакция в ионной форме имеет вид
|
3 Zn0 + Cr2O72– + 14H+= 2Cr3+ + 3 Zn2+ + 7H2O. |
(10) |
|||||||
Согласно |
справочнику |
“Термические |
константы |
|
веществ”, |
||||
(вып. 6 - 1972 г.; вып. 7 - 1974 г.) |
G0 (кДж/моль) имеют значения: для |
||||||||
Cr2O72– - (-1306,3); для Сr3+ - |
(-222,8); |
для |
Zn2+ - |
(- 147,02); для Н2О – |
|||||
(-237). |
|
|
G0 продуктов реакции |
- G0 |
|
|
|||
Тогда |
G реакции |
= |
исходных ве- |
||||||
ществ: |
|
|
|
|
|
|
|
|
|
(-2·222,8) |
+ (-3·147,2) |
+ |
(-7·237) |
– |
(-1306,3) = -1239,3 |
кДж/моль = |
|||
= - 1239,3 кВт.С/моль.
Согласно уравнению (9), стандартное значение ЭДС этого элемента Е0 равно (в реакции участвуют 6 электронов)
Е0 = -1239,300 Вт с/моль = 2,1 В. 6е 96484Л с/моль
С другой стороны, Е элемента определяется величинами электродных потенциалов анода (ЕА), катода (ЕК) и равна в стандартных условиях
70
|
Е0 = Е0к(+) – ЕА(–) , |
(11) |
где Е0 к(+) = +1,33В, Е0 |
A(–) = - 0,76В. |
|
Помимо теоретического расчета Е элемента можно измерить практически высокоомным вольтметром, имеющим высокое входное сопротивление.
4. Электрохимическая коррозия
Электрохимическая коррозия как работа гальванического элемента является самопроизвольным процессом, поэтому протекает с уменьшением энергии Гиббса системы. Результат ее определяется работой короткозамкнутого коррозионного элемента (коррозионной пары электродов: анод, А (–); катод, К (+)). Коррозионная пара возникает в результате какой-либо неоднородности поверхности металлической детали или конструкции, находящейся в контакте с электролитом.
За счет разности потенциалов Е = ЕК(+) – ЕА(–) возникает внутренний коррозионный ток. При прохождении его через границу металл - электролит на аноде – отрицательном электроде происходит процесс окисления металла до ионов с переходом их в коррозионную среду или с образованием нерастворимых продуктов коррозии (оксидов, гидроксидов, солей).
На катоде – положительном электроде - происходит восстановление ионов водорода в кислой среде (коррозия с водородной деполяризацией) или восстановление кислорода в нейтральной и щелочной средах (коррозия с кислородной деполяризацией).
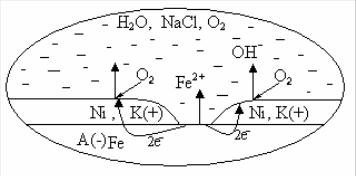
Для защиты металлов от коррозии часто применяют металлические защитные покрытия. По своему защитному действию они подразделяются на анодные и катодные. Рассмотрим, например, поведение системы – сталь, покрытую никелем, находящуюся в контакте с нейтральным раствором NaCl, с растворенным в нем кислородом.
Рис. Образование коррозионного элемента
В случае целостности покрытия основной металл – сталь - защищен механически от электролита и от коррозии более стойким металлом-никелем. При нарушении сплошности покрытия открывается доступ электролита к основному металлу и возникает коррозионный элемент (см. рис.). Его можно
71
показать электрохимической схемой, подобной схеме гальванического элемента,
Е0 = - 0,44В Е0= -0,24В А (–) Fe | NaCl, O2, H2O | Ni (+) K .
Так как стандартный потенциал (Е0) железа более отрицателен (-0,44В), чем у никеля, то железо будет легче окисляться и будет служить отрицательным электродом-анодом, с протекающей на нем реакцией окисления
А (–) Fe – 2e → Fe2+.
Ионы железа Fe2+ переходят в электролит. Электроны, освободившиеся в анодной реакции, переходят с поверхности анода на поверхность катода.
Потенциал никеля более положителен (Е0 = – 0,24В), чем у основного металла. Поэтому в процессе коррозии покрытие служит положительным электродом – катодом и называется катодным покрытием. На его поверхности в данном примере будет происходить восстановление кислорода
К (+) О2 + 4е + 2Н2О = 4ОН–.
Появившиеся гидроксогруппы будут соединяться с ионами железа. Суммарная реакция в коррозионном процессе имеет вид
2Fe + O2 + 2 H2O = 2Fe(OH) 2.
Под действием кислорода гидроксид (Fe2+) окисляется до гидроксида (Fe3+) и в дальнейшем превращается в гидратированную окись железа
4Fe(OH) 2 + O2 + 2H2O = Fe(OH) 3, 2Fe(OH) 3 → Fe2O3 ·3H2O.
Как видно, при нарушении целостности катодного покрытия его защитные свойства не сохраняются, и оно не только не защищает сталь от коррозии, но даже способствует ее протеканию.
Аналогично можно показать защитные свойства анодного покрытия и их сохранение при нарушении покрытия.
5. Электролиз
Электролизом называется совокупность гетерогенных окислительновосстановительных реакций, происходящих на электродах при прохождении электрического тока через границу электрод/электролит от внешнего источника тока (ИТ).
72
Электролиз является вынужденным электрохимическим процессом в отличие от электрохимической коррозии – самопроизвольного процесса.
Электрод, присоединенный к положительному полюсу ИТ, является положительным электродом - анодом А(+).
Электрод, присоединенный к отрицательному полюсу ИТ, является отрицательным электродом – катодом К(–).
Электролит диссоциирует на ионы. Положительно заряженные ионы переходят под действием электрического поля источника тока к отрицательно заряженному электроду катоду, поэтому называются катионами. Отрицательно заряженные ионы – к положительно заряженному электроду, аноду и называются анионами.
На аноде происходит отдача электронов химическими частицами: молекулами, атомами, ионами, то есть окисление веществ.
Электроны, освободившиеся в анодной реакции, с поверхности анода по внешней цепи, через ИТ поступают на поверхность катода.
На катоде происходит присоединение электронов восстанавливающимся веществом, окислителем, то есть идет реакция восстановления.
Очередность возможных на электродах реакций определяется соотношением их потенциалов.
На аноде в первую очередь или с наибольшей скоростью происходит реакция окисления восстановителя с более отрицательным потенциалом, когда легче отнять электроны.
На катоде в первую очередь будет происходить реакция восстановления окислителя, которой соответствует более положительный потенциал.
Если электролизу подвергаются растворы солей очень активных металлов, расположенных в ряду активности от калия до циркония, то на катоде происходит восстановление молекул воды; при электролизе растворов солей металлов, расположенных правее циркония, восстанавливаются катионы металла взятой соли.
Различают электролиз с растворимым и нерастворимым анодом.
Вслучае электролиза с растворимым анодом (медь, никель, цинк и др. металлы) материал анода, выполняя роль токоподвода с электронной проводимостью, подвергается электрохимическому окислению под действием электрического тока: в виде ионов переходит в раствор. Масса анода убывает.
Вслучае нерастворимых анодов (уголь, графит, платина) материал анода не подвергается электрохимическому окислению, масса анода не убы-
вает. Тогда окисляются анионы бескислородных кислот в следующем порядке: I–, Br–, Cl–, затем гидроксогруппы ОН– и молекулы воды.
Анионы кислородсодержащих кислот: SO42–, PO43–, CO32– и др. переносят ток, подходят к аноду, но не окисляются. Вместо них на нерастворимом аноде окисляются молекулы воду, если отсутствуют другие анионы.
73
ПРАКТИЧЕСКАЯ ЧАСТЬ
1. Ряд стандартных электродных потенциалов
В пробирки налейте растворы нитрата свинца Pb(NO3)2, сульфата меди CuSO4, хлорида железа FeCl3.
Опустите в пробирки кусочки (или проволочки) металлов в следующем
порядке: |
|
|
1. |
Нитрат свинца |
- железо |
2. |
Нитрат свинца |
- цинк |
3. |
Сульфат меди |
- железо |
4. |
Сульфат меди |
- цинк |
5. |
Хлорид железа |
- медь |
6. |
Сульфат меди |
- алюминий |
Через 1-2 мин наблюдайте выделение металла из раствора соли. Пробирку с раствором нитрата свинца и опущенным в него кусочком железа следует нагревать в течение 2-х минут, после чего можно заметить, что блестящая поверхность железа покрылась серым матовым налетом металлического свинца.
Установите, какой из взятых металлов является более активным. Напишите молекулярные и ионные уравнения реакций. Расположите
взятые металлы в ряд по активности, указав значения их СЭП. Подсчитайте Е0 реакции.
2. Гальванический элемент ГРЕНЭ
Исследуйте гальванический элемент со следующей электрохимической схемой
цинковый электрод | |
0,01 М раствор серной |
| угольный электрод |
(–)А Zn |
кислоты с добавкой |
С К(+) |
|
К2Cr2O7 |
|
|
(деполяризатор) |
|
Присоедините провода от пластин гальванического элемента к гальванометру. Наблюдайте наличие электрического тока. Дайте объяснение, какие окислительно-восстановительные процессы протекают на электродах гальванического элемента?
74
Напишите молекулярное и ионное уравнения суммарной реакции, протекающей при работе данного гальванического элемента. Измерьте напряжение на клеммах элемента, сравните его с теоретическим значением ЭДС в стандартных условиях.
3. Электрохимическая коррозия
3.1. Образование коррозионной пары при атмосферной коррозии
Опустите хорошо очищенный от окиси кусок алюминия на 1-2 минуты в раствор азотнокислой ртути Hg(NO3)2, после чего промойте водой и оставьте лежать на воздухе. Через некоторое время наблюдайте образование продукта коррозии – рыхлых хлопьев гидроокиси алюминия. Дайте объяснение процессу образования коррозионной пары. Покажите рисунком, электрохимической схемой, напишите ионные уравнения электродных реакций и суммарное уравнение процесса атмосферной коррозии.
3.2. Защитные свойства металлических покрытий
Налейте в два стаканчика до метки раствора серной кислоты и по две капли раствора красной кровяной соли K3 [Fe(CN) 6]. В один из стаканчиков опустите пластинку оцинкованного железа, в другой – луженого железа, предварительно нанеся на эти пластины царапины.
В каком стаканчике наблюдается через несколько минут интенсивное синее окрашивание (присутствие иона 2-валентного железа)? Объясните защитные свойства анодного и катодного видов покрытий с помощью рисунков. Напишите электродные и суммарные уравнения реакций.
4. Электролиз
4.1.Электролиз с нерастворимым анодом
ВU-образную трубку налейте до метки раствора йодистого калия KI, добавив в одно колено 1-2 капли крахмала, в другое – 2-3 капли раствора фенолфталеина.
Вставив в оба колена трубки угольные электроды, причем, электрод, опущенный в раствор йодистого калия с добавкой крахмала, сделайте анодом (положительный электрод), а другой электрод – катодом (отрицательный электрод). Включите постоянный электрический ток. Наблюдайте через 2-3 минуты окрашивание раствора у катода, анода. Дайте объяснение с помощью рисунков. Составьте схему электролиза водного раствора KI. Напишите реакции на электродах.
75
4.2. Электролиз с нерастворимым анодом
В U-образную трубку налейте до метки раствор сернокислой меди CuSO4. Вставьте в оба колена трубки угольные электроды и включите постоянный электрический ток. Пропускайте ток в течение 4-5 минут.
Что выделяется на электродах? Дайте объяснение. Составьте схему электролиза раствора сернокислой меди. Напишите реакции на электродах.
4.3. Электролиз с растворимым анодом
Присоедините электрод с отложившейся в предыдущем опыте медью к положительному полюсу источника тока, а другой электрод – к отрицательному полюсу. Пропускайте постоянный электрический ток. Составьте схему электролиза водного раствора сернокислой меди при медном аноде. Напишите реакции на аноде и катоде.
По результатам экспериментов составьте отчет. Опишите сущность электрохимических процессов, ответьте на контрольные вопросы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какие известны электрохимические свойства металлов и электрохимические процессы?
2.В чем сущность явления возникновения потенциалов на границе металл - электролит?
3.Как возникает и протекает процесс электрохимической коррозии в опытах?
4.Как организуется и протекает процесс электролиза с нерастворимым и растворимым анодами? В чем отличие электролиза от коррозии?
5.В чем сущность работы химического источника тока на примере элемента Гренэ?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Коровин Н.В. Курс общей химии. - М.: Высшая школа, 2001. –
С. 260-278, 310-338.
2.Глинка Н.Л. Общая химия.//Под ред. А.И. Ермакова. – М.:
Интеграл-Пресс, 2003. –С.268-288, 677-693.
76
ЛАБОРАТОРНАЯ РАБОТА №27
ОПРЕДЕЛЕНИЕ ХИМИЧЕСКИХ ХАРАКТЕРИСТИК КИСЛОТНЫХ И ЩЕЛОЧНЫХ АККУМУЛЯТОРОВ
Цель работы: изучить особенности процессов разряда и заряда основных промышленных аккумуляторов, научиться снимать электрохимические характеристики и давать оценку их работоспособности.
Рабочее задание: измерить ЭДС, равновесные и стационарные потенциалы электродов, получить вольтамперную характеристику и диаграммы поляризации при разряде и заряде аккумулятора, определить область рабочих разрядных токов, емкость и внутреннее сопротивление.
СВЕДЕНИЯ ИЗ ТЕОРИИ
1. Классификация аккумуляторов
Аккумуляторы – это вторичные химические источники тока, (ХИТ) которые допускают многократное использование. Будучи разряженными, они способны восстанавливаться (заряжаться) от внешнего источника постоянного тока. Активные массы электродов регенерируются. Классифицируются аккумуляторы по типу электролита: кислотные, щелочные, с твердым и расплавленным электролитом. Наиболее широкое применение на практике получили кислотные (свинцовые) и щелочные (никель–кадмивый, никель– железный и серебряно–цинковый) аккумуляторы.
1.1. Кислотные (свинцовые) аккумуляторы
В основе работы свинцового заряженного аккумулятора находится электрохимическая схема
(-) Рв| H2SO4|РвО2 (+).
Конструктивно оба электрода представляют собой свинцовые решетки. Отрицательная заполнена губчатым свинцом, положительная двуокисью свинца. Полярность электродов при разряде и заряде не меняется.
Электролитом служит 28 – 40% - ный раствор серной кислоты (плотность d = 1,21 – 1,30 г/см3). Наибольшая электропроводность у 30 % H2SO4 (d = 1,22 г/см3). В зимний период концентрация кислоты выше, чем летом.
В основе механизма токообразующего процесса лежит процесс двойной сульфатации, согласно которому, при разряде активные вещества обоих
77
электродов переходят в кристаллический сульфат свинца, при заряде идет обратный процесс
|
2– |
разряд |
|
0 |
|
(-) Pb m 2e + SO4 |
→ PbSO4 |
E Pb= – 0,36B |
|||
|
|
← |
|
|
|
|
|
заряд |
|
|
|
2– |
+ |
разряд |
+ 2H2O |
0 |
= 1,68B. |
(+) PbO2 + 2e + SO4 |
+ 4H |
→ PbSO4 |
PbPbO2 |
||
←заряд
Е0Pb и Е0PbO2 – стандартные электродные потенциалы отрицательного и положительного электрода (при активности всех компонентов, равной единице и температуре 25 0С.)
Суммарное уравнение токообразующего процесса
разряд |
0 |
Pb + PbO2 + 2H2SO4 → |
2PbSO4 + 2H2O E ЭДС = 2,04B. |
← |
|
заряд |
|
В реальных условиях ЭДС свежезаряженного аккумулятора может достигать 2,6В (из-за электрохимического разложения при перезарядке). Через некоторое время это значение снижается до 2,1В. При разряде не рекомендуется снижать напряжение меньше 1,85В во избежание порчи аккумулятора.
Как следует из суммарного уравнения, при заряде концентрация кислоты увеличивается, а при разряде уменьшается (в конце примерно в два раза до d = 1,08 - 1,17 г/см 3). Поэтому концентрация (плотность) электролита может служить критерием заряженности аккумулятора. Заряд ведут до постоянной плотности электролита. Кроме того, часто для получения полного заряда аккумулятору после скачка напряжения до 2,4 – 2,5В (при этом наблюдается «кипение» электролита, т.е. выделение на отрицательном электроде Н2 и на положительном О2) сообщают еще примерно 10% емкости. Сила зарядного тока в амперах обычно составляет 0,1 долю от емкости.
Основной недостаток свинцового аккумулятора - сравнительно небольшой срок службы, главным образом, из-за постепенной сульфатации электродов. Сульфатация – это переход сульфата свинца из мелкокристаллического, растворимого состояния в крупнокристаллический, нерастворимый, неэлектропроводный слой (нет полного превращения PbSO4 в Pb и PbO2 при заряде). Внешним проявлением необратимой сульфатации является наличие жесткой, песчанистой поверхности на электродах (на отрицательном электроде отсутствует характерный металлический оттенок Рb, на положительном происходит осветление окраски PbO2). Зарядить такие электроды практически невозможно.
Во избежание сульфатации необходимо хранить свинцовый аккумулятор с электролитом только в заряженном состоянии и регулярно подзаряжать его. Кроме того, свинцовые аккумуляторы не выдерживают сильных вибра-
78
ций, боятся больших перезарядов, длительных коротких замыканий. Идет осыпание активных масс, особенно положительного электрода.
Основное преимущество свинцового аккумулятора перед другими источниками тока – способность вырабатывать большие разрядные токи (более 200А). Поэтому они незаменимы как стартерные батареи для запуска двигателей внутреннего сгорания.
В зависимости от назначения батареи специально маркируются. Например, 6-СТ-60 (стартерная, 6 банок по 2В на 12В и на 60 А·ч). Стартерные батареи используются в тепловозах, автомобилях. Кроме того, на железнодорожном транспорте применяют аккумуляторы типа АБН для автоблокировки; ТН - тяговые; в ПМЦ – для освещения вагонов.
1.2. Щелочные аккумуляторы
Наибольшее распространение получили никель–кадмиевые (НК) и ни- кель–железные (НЖ) аккумуляторы. Их электрохимические схемы были предложены в 1900-1901 г.:
(–)Сd| KOH или NaOH|NiOOH (+),
(–)Fe| KOH или NaOH|NiOOH (+).
Активное вещество положительного электрода состоит из смеси графита и гидратированного оксида Ni (III). Активной массой отрицательного электрода служит порошкообразные кадмий или железо. В аккумуляторах большой емкости активные массы заключены в стальные ламели: перфорированные пакеты, которые служат токоотводом. Электролит − 23% КОН (d=1,21 г/см3) или NaOH (КОН обладает лучшей электропроводностью при низких температурах).
Электродные реакции при разряде и заряде:
– |
разряд |
|
0 |
(–) Cd m 2e + 2OH |
→ Cd(OH)2 |
E Cd = – 0,81B |
|
|
← |
|
|
|
заряд |
|
|
– |
разряд |
|
0 |
(–) Fe m2e + 2OH |
→ Fe(OH)2 |
E Fe = – 0,87B |
|
|
← |
|
|
|
заряд |
|
|
разряд |
– |
0 |
|
(+) NiOOH + e + H2O → Ni(OH)2 + OH |
E NiOOH = 0,49B. |
||
← |
|
|
|
|
заряд |
|
|
Суммарная токообразующая реакция: |
|
|
|
разряд |
+ 2Ni(OH)2 |
0 |
|
Cd + 2 NiOOH + 2H2O → Cd(OH)2 |
E ЭДС = 1,30В |
||
← |
|
|
|
заряд |
|
|
|
разряд |
+ 2Ni(OH)2 |
0 |
|
Fe + 2 NiOOH + 2H2O → Fe(OH)2 |
E ЭДС = 1,36В. |
||
← |
|
|
|
заряд |
|
|
|
79
