
методичка по Химии
.pdf1. Зависимость скорости реакции от концентрации раствора
Целью опыта является изучение, подтверждение закона действия масс на примере реакции между серной кислотой и тиосульфатом натрия
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3 ,
H2S2O3 = H2O + SO2↑ + S↓.
Нерастворимую серу можно наблюдать в виде помутнения раствора. Время от начала реакции до появления первых следов мути зависит от концентрации реагирующих веществ и температуры.
Три бюретки порознь заполнить водой, раствором тиосульфата натрия
ираствором серной кислоты. В четыре пробирки налить указанное число миллилитров раствора тиосульфата натрия и воды (по таблице). В другие четыре пробирки отмерить из бюретки по 6 мл раствора серной кислоты. Влить
впробирку № 1 отмеченное количество серной кислоты, быстро перемешать
иотсчитать по секундомеру число секунд от момента слива до первых следов мути.
Скорость реакции определить как величину, обратно пропорциональную найденному времени V= 1/t.
Форма записи наблюдений
|
Объем, мл |
|
Относительная |
Время, |
Скорость |
|
Пробирки, |
Раствор |
|
|
концентрация |
с. |
реакции: |
№ |
Na2S2O3 |
|
H2O |
|
|
V= 1/t, с-1 |
1 |
6 |
|
0 |
1 |
|
|
2 |
4 |
|
2 |
2/3 |
|
|
3 |
3 |
|
3 |
1/2 |
|
|
4 |
2 |
|
4 |
1/3 |
|
|
|
|
|
|
|
|
|
Произвести такие же опыты со всеми другими пробирками. Зависимость между изменением концентрации раствора и скоростью реакции показать графически.
График удобно строить на миллиметровой бумаге: на оси ОХ отложить концентрацию, на оси ОУ – скорость реакции (рекомендуется величины скорости выразить десятичными дробями до второй значащей цифры, а затем умножить на 100). Удобный масштаб: минимальная концентрация – 3 см, максимальная скорость – 3 см.
Какой линией выражается данная зависимость? Проходит ли через начало координат? Если да, то почему?
30
2. Смещение химического равновесия
При реакции хлористого железа с роданистым калием
FeCl3 + 3KSCN ↔3KCl + Fe(SCN)3,
получающаяся кроваво-красная окраска раствора обусловлена образованием роданистого железа Fe(SCN)3. Изменяя концентрации участвующих в реакции веществ, можно по изменению окраски судить о направлении смещения химического равновесия.
Впробирку налейте 20 мл воды и добавьте 2 капли насыщенных рас-
творов FeCl3 и KSCN, перемешайте. Окрашенный в красный цвет раствор разлейте поровну в четыре пробирки.
Составьте уравнение обратимой реакции и уравнение константы рав-
новесия. В одну пробирку добавьте 1 каплю насыщенного раствора FeCl3. Что наблюдается? Дайте объяснение, исходя из уравнения константы равновесия.
Вдругую пробирку прилейте 1 каплю насыщенного раствора KSCN. Дайте объяснение наблюдаемому изменению. Чем объяснить, что изменение концентрации KSCN вызывает более эффективное смещение равновесия вправо или влево, чем FeCl3?
Втретью пробирку поместите немного твердого хлористого калия, сильно взболтайте. Сравните цвета растворов в 3 и 4 пробирках. Дайте объяснение. Как изменить концентрацию вещества, чтобы сместить равновесие вправо или влево?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Чем измеряется скорость реакции и от каких факторов она зависит?
2.Каков физический смысл константы скорости?
3.Составить уравнение скорости образования воды из водорода и кислорода и показать, как изменится скорость, если концентрацию водорода увеличить в три раза?
4.Как изменяется скорость реакции с течением времени?
5.Какие реакции называются обратимыми?
6.При каких условиях наступает химическое равновесие?
7.Что такое константа равновесия?
8.Что называется смещением химического равновесия, принцип ЛеШателье?
9.Определить исходные концентрации водорода и брома, если при
равновесии реакции H2 + Br2 ↔ 2HBr концентрации всех веществ в системе оказались следующими:
[ H2] = 0,31 моль/л, [ Br2 ] = 1,25 моль/л, [ HBr ] = 0,8 моль/л.
31
10.Константа равновесия системы при некоторой температуре равня-
ется 1. Если исходные концентрации [СО] = 1; [Н2О] = 3, то каковы будут концентрации всех веществ в момент равновесия?
11.Как следует изменить (увеличить или уменьшить) температуру и концентрацию веществ в равновесной системе
СО + Н2О ↔ СО2 + Н2 + 42,63 кДж, чтобы получить возможно больше водорода?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Коровин Н.В. Курс общей химии. – М.: Высшая школа, 2001. –
С.142-167.
2.Глинка Н.Л. Общая химия – М.: Интеграл-Пресс, 2003. – 728 с.
3.Глинка Н.Л., Задачи и упражнения по общей химии. – Л.: Химия, 1983. – С. 96-115.
32
ЛАБОРАТОРНАЯ РАБОТА № 5
ЭЛЕКТРОЛИТЫ
Цель работы: закрепить теоретические знания, умения писать ионномолекулярные реакции обмена в растворах электролитов с учетом силы электролита и фазового состава химической системы.
Рабочее задание: с помощью эксперимента и теоретических знаний объяснить письменно и устно сущность происходящих реакций. Оформить и сдать отчет.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Электролиты – это вещества, растворы которых проводят электрический ток.
В настоящей работе рассматриваются водные растворы электролитов. Электролиты являются проводниками второго рода. Переносчиками тока являются ионы, полученные в результате процесса электролитической диссоциации.
Электролитической диссоциацией называется процесс распада молекул кислот, оснований и солей на заряженные частицы – ионы - под воздействием полярных молекул воды.
Электролиты, которые полностью распадаются на ионы, называются сильными. Электролиты, которые частично распадаются на ионы, называются слабыми.
Об относительной силе электролитов (электролитической силе) можно
судить по степени диссоциации (α), по электропроводности их растворов, а также по химической активности в реакциях.
Процесс диссоциации для слабых электролитов является процессом обратимым, и поэтому к нему применим закон действия масс и принцип ЛеШателье. (Повторите тему: закон действия масс и химическое равновесие.)
Константа химического равновесия, примененная к процессу диссоциации слабого электролита, называется константой электролитической диссоциации. Константа диссоциации характеризует силу электролита. Чем больше величина константы, тем сильнее электролит.
Изменение концентрации ионов в растворе вызывает смещение равновесия. Для того, чтобы сместить равновесие в растворе слабого электролита в сторону недиссоциированных молекул, т.е. влево, следует добавить сильный электролит, образующий ион одноименный с ионом слабого электролита.
33
Уменьшение концентрации одного из ионов слабого электролита сместит равновесие в сторону образования этих ионов. Сформулируйте применение принципа Ле-Шателье в данном случае.
Реакции между электролитами в растворах являются реакциями обмена их ионами. Реакции обмена протекают в направлении образования слабых электролитов, трудно растворимых веществ или летучих соединений. При образовании слабых электролитов реакция обмена может протекать обратимо (см. опыт 3.3) вследствие обратимости диссоциации образующихся слабых электролитов.
Правила написания реакции обмена
1.Реакция пишется в молекулярной форме и уравнивается.
2.При написании уравнения реакции в полной ионной форме сильные электролиты пишутся в виде ионов, слабые электролиты, трудно растворимые и летучие вещества пишутся в виде молекул.
3.Одни и те же ионы в правой и левой частях уравнения, как не участвующие в реакции, сокращают, и еще раз переписывают уравнение в сокращенной ионной форме, раскрывающей механизм реакции.
При известном навыке реакцию в сокращенной ионной форме можно написать сразу.
ПРАКТИЧЕСКАЯ ЧАСТЬ
1. Различие в скорости химической реакции сильных и слабых электролитов
Опыт 1.
Задача опыта: путем наблюдения и умозаключения определить сильный и слабый электролит.
В две пробирки поместите одинаковое по объему количество (в ложечке) мелко истолченного мрамора и налейте 1-2 мл разбавленных растворов кислот (0,1н): в одну – соляной (HCl), в другую – уксусной (CH3COOH). Наблюдайте, одинаково ли быстро растворяется мрамор во взятых кислотах.
Напишите реакции обмена в молекулярной и сокращенной ионной формах. В какой кислоте концентрация ионов водорода больше, почему? С помощью закона действия масс для сокращенной ионной формы объясните, какая кислота является более сильной.
Опыт 2.
В одну из двух пробирок налейте 1-2 мл разбавленной соляной кислоты, во вторую – уксусной. Добавьте в каждую пробирку по 2 капли метило-
34
ранжа. Сравните окраску обоих растворов. Поместите в каждую пробирку по кусочку цинка. Что наблюдается?
Сопоставьте интенсивность действия растворов кислот на металл с изменением в нем окраски индикатора.
Опишите наблюдаемое явление аналогично опыту 1.
Напишите реакции взаимодействия кислот с цинком в сокращенной ионной форме. В чем различие механизмов реакции в опытах 1 и 2?
2. Смещение ионного равновесия в растворах слабых электролитов
Опыт 3.
Напишите уравнения диссоциации уксусной кислоты и константы диссоциации.
Налейте в пробирку 3-4 мл 0,1н раствора уксусной кислоты и 2 капли метилоранжа. Какую окраску принимает раствор и почему?
Разлейте раствор пополам и к одной части ложечкой или шпателем добавьте несколько кристалликов ацетата натрия (CH3COONa), взболтайте и сравните окраску растворов в обеих пробирках. Объясните изменение окраски. Сделайте вывод о направлении сдвига химического равновесия, применив принцип Ле-Шателье и закон действия масс.
3. Ионно–молекулярные реакции обмена в растворах электролитов (ИМРО)
Опыт 4.
Налейте в две пробирки по 1-2 мл раствора ацетата свинца Pb(CH3COO)2. Прилейте в первую пробирку раствор хлористого натрия NaCl, во вторую – раствор хромата калия K2CrO4. Опишите цвет осадка в каждой пробирке. Напишите молекулярные и полные, сокращенные ионные уравнения реакции.
Опыт 5.
Подействуйте раствором хлорида бария BaCl2 или нитрата бария Ba(NO3)2 на растворы различных солей серной кислоты (NiSO4, Na2SO4,
CuSO4).
Каков цвет полученных осадков? Напишите молекулярные уравнения реакций и общее для всех реакций ионное уравнение.
Опыт 6.
Налейте в пробирку 1-2 мл концентрированного раствора хлористого аммония NH4Cl и добавьте раствор щелочи, тщательно взболтайте. Установите по запаху выделяющееся летучее вещество.
Напишите молекулярное и ионное уравнения.
35
Опыт 7.
Налейте в пробирку 1-2 мл насыщенного раствора карбоната натрия Na2CO3 и прилейте раствор разбавленной серной кислоты H2SO4.
Что при этом наблюдается?
Напишите молекулярное и полное, сокращенное ионное уравнения реакции.
Опыт 8.
Получите в пробирке осадок Mg(OH)2, действуя разбавленной щелочью на небольшое количество раствора соответствующей соли.
Подействуйте на осадок разбавленной соляной кислотой. Что при этом происходит?
Напишите молекулярные, полные и сокращенные ионные уравнения проведенных реакций. Ответьте на контрольные вопросы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какие вещества называются электролитами?
2.Какова сущность процесса электролитической диссоциации?
3.Как различаются сильные и слабые электролиты?
4.В чем отличие диссоциации сильных и слабых электролитов?
5.Что такое константа диссоциации слабых электролитов и как применяется принцип Ле-Шателье к диссоциации слабых электролитов?
6.Что такое ионно-молекулярные реакции обмена в растворах электролитов и как они записываются?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Глинка Н.Л. Общая химия. - Л.: Химия, 1985. – С. 231-246.
2.Коровин Н.В. Курс общей химии. - М.: Высшая школа, 2001. –
С.204-218.
3.Глинка Н.Л. Общая химия – М.: Интеграл-Пресс, 2003. – 728 с.
36
ЛАБОРАТОРНАЯ РАБОТА № 6
ОПРЕДЕЛЕНИЕ рН. ГИДРОЛИЗ СОЛЕЙ
Цель работы: изучить особенность реакций гидролиза солей, причины, признаки гидролиза (изменение кислотности среды) с учетом водородного показателя среды.
Рабочее задание: экспериментальным путем определить водородный показатель (рН) различных растворов, в т.ч. солей; влияние различных факторов (концентраций, температуры) на смещение химического равновесия гидролиза.
СВЕДЕНИЯ ИЗ ТЕОРИИ
1. Определение рН
Процесс электролитической диссоциации воды протекает с образованием ионов гидроксония и гидроксид-ионов
2Н2О ↔ Н3О+ + ОН–.
Измерениями установлено, что концентрация ионов гидроксония и гидроксид-ионов в воде равна [ Н3О+ ] = [ОН–-] = 10-7 моль/л.
Для упрощения расчета вместо концентрации Н3О+ пользуются концентрацией [ Н+].
В этом случае ионное произведение воды равно
КH2O = [Н+][ОН–] = 10-14 (при t= 220С). |
(1) |
Растворы, в которых концентрация водородных и гидроксильных ионов одинакова и равна 10-7 моль/л, называются нейтральными. Реакцию среды любого водного раствора характеризуют концентрацией ионов водорода. Чтобы избавиться от отрицательной степени в значении [Н+], принято пользоваться отрицательным значением десятичного логарифма величины концентрации ионов водорода, так называемым водородным показателем рН
рН = – lg [Н+]. |
(2) |
В зависимости от среды рН может принимать следующие значения:
-в нейтральной среде - [Н+]=[ОН–] = 10-7 моль/л, рН = 7;
-в кислой среде – [Н+]>[ОН–] < 10-7 моль/л, рН < 7;
-в щелочной среде – [Н+]<[ОН–] > 10-7 моль/л, рН > 7.
37
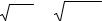
Концентрацию ионов водорода можно определить теоретически (формулы для примерного расчета рН водных растворов электролитов приведены в таблице) и практически.
Один из наиболее распространенных и простых методов – определение рН с помощью универсальной индикаторной бумаги. Эта бумага пропитана смесью целого ряда индикаторов с различными областями перехода. Каждому значению рН соответствует определенный оттенок в окраске индикаторной бумаги. При определении рН на полоску универсальной индикаторной бумаги наносят каплю исследуемой жидкости и сравнивают получившуюся окраску с окраской на шкале эталона. Совпадение окраски индикаторной бумаги с окраской на шкале означает совпадение рН.
Таблица Формулы для примерного расчета рН водных растворов электролитов
Электролит |
Формула для расчета рН |
|
|
|
|
H2O |
[H+] = [OH-] = |
Kw = 10-14 =10-7; pH = 7 |
|
|
|
Сильная кислота |
рН = -lgCHA |
|
|
|
|
Сильное основание |
рН = 14 + lgCBOH |
|
|
|
|
Слабая кислота |
pH = ½ (pKa - lgCHA) |
|
|
|
|
Слабое основание |
pH = 14 - ½ pKb + ½ lgCBOH |
|
|
|
|
Соль, образованная сильным основа- |
pH = 7 + ½ pKa+ ½ lgCсоли |
|
нием и слабой кислотой |
|
|
|
|
|
Соль, образованная слабым основани- |
pH = 7 - ½ pКb- ½ lgCсоли |
|
ем и сильной кислотой |
|
|
|
|
|
Соль, образованная слабым основани- |
pH = 7 + ½ pKa- ½ pKb |
|
ем и слабой кислотой |
|
|
|
|
|
Кислая соль (амфолит) |
pH = ½ pKa1 + ½ pKа2 |
|
|
|
|
Буферные растворы: |
pH = pKa - lg(CHA/Ссоли) |
|
а) слабая кислота и её соль |
pH = 14 - pKb + lg(CBOH/Ссоли) |
|
б) слабое основание и его соль |
|
|
|
|
|
Индикаторы: |
Переход окраски: pH ≈ pKind ± 1 |
|
а) метилоранж |
pK = 3,7 |
3,1 ≤ pH ≤ 4,4 |
б) фенолфталеин |
pK = 9,2 |
8,2 ≤ pH ≤ 9,8 |
|
|
|
38
2. Гидролиз солей
Гидролизом солей называется реакция обменного взаимодействия ионов (соли) с молекулами воды, ведущая к образованию более слабого электролита, нерастворимого или газообразного соединения.
Взависимости от электролитической силы образующих соль кислоты
иоснования соли можно разделить на четыре типа:
1) соли, образованные сильной кислотой и сильным основанием NaCl,
KNO3;
2) соли, образованные сильным основанием и слабой кислотой Na2CO3,
K2S, Na2S;
3) соли, образованные слабым основанием и сильной кислотой ZnCl2,
Al(NO3)3;
4) соли, образованные слабой кислотой и слабым основанием
(NH4)2CO3, CH3COONH4.
Соли первого типа гидролизу не подвергаются, т.е. при их взаимодействии с водой не могут быть получены слабые электролиты. В системе Н2О ↔ Н+ + ОН– равновесие не нарушается, поэтому в растворах этих солей рН равна 7.
Соли остальных трех типов подвергаются гидролизу. Соли, образованные многоосновными кислотами или многокислотными основаниями, гидролизуются ступенчато, переходя в кислые или основные соли.
Гидролиз – во втором и третьем типах солей - реакция обратимая. Реакция также подчиняется закону действия масс.
Гидролиз Na2S
1-ая ступень Na2S + НОН ↔ NaHS + NaOH, S2– + НОН ↔ HS– + OH–.
2-ая ступень NaHS + НОН ↔ H2S + NaOH, HS– + НОН ↔ H2S + OH–.
При гидролизе Na2S и других солей этого типа в растворе накапливаются ионы OH–, сообщающие ему щелочную реакцию рН > 7. Сильнее выражена первая ступень гидролиза, чем вторая.
Гидролиз FeCl3.
По первой ступени гидролиз идет через образование хлорида гидроксида железа (III), (+3).
39
